Können wir das Pankreaskarzinom endlich rechtzeitig diagnostizieren?
Autor:innen:
Prim. Univ.-Prof. Dr. Rainer Schöfl
Leiter der Abteilung für Gastroenterologie
Dr. Clara Meierhofer
Interne IV – Gastroenterologie & Hepatologie, Endokrinologie und Stoffwechsel, Ernährungsmedizin
Ordensklinikum Linz GmbH
Barmherzige Schwestern
E-Mail: rainer.schoefl@ordensklinikum.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Zur Diagnose von Pankreaskarzinomen stehen etablierte bildgebende Verfahren sowie ein serologischer Marker zur Verfügung. Ungefilterte Screenings der Bevölkerung sind hingegen wenig effizient. Als zielführender erweist sich die Überwachung von Risikopopulationen.
Keypoints
-
Globales Screening ist nicht effizient.
-
Die in überwachten Risikogruppen entdeckten Pankreaskarzinome sind meist operabel und Patient:innen überleben länger.
-
Unter den Pankreaszysten sollen Hauptgang-IPMN, muzinöses Zystadenom und Frantz-Tumor prophylaktisch operiert werden, die Seitenast-IPMN nach publizierten Richtlinien überwacht werden.
-
Wenn in einer Familiezumindest zwei Verwandte, davon eine:r erstgradig oder eine:r unter 50,erkrankt sind, soll für die anderen Familienmitglieder ein Überwachungsprogramm ab 50 Jahren oder 10 Jahre vor dem Erkrankungsalter des/der jüngsten betroffenen Verwandten beginnen.
-
Chronische Pankreatitiden, die vor dem 30. Lebensjahr klinisch manifest wurden, sollen überwacht werden.
-
Patient:innenaus Familien mit genetischen Syndromen wie Lynch, Peutz-Jeghers, FAMMM oder BRCA-Mutationen sollen überwacht werden.
-
Derzeitige Überwachungskonzepte nutzen jährliches Screening mit MRI oder EUS undBestimmung von CA 19-9.
Pro Jahr erkranken etwa 1800 Österreicher:innen an einem Pankreaskarzinom. Auf das ganze Leben gerechnet werden nach heutigem Stand der Medizin bei uns 1–2 von 100 Einwohnern an einem Pankreaskarzinom erkranken und wohl auch daran sterben – wenn wir uns nicht anstrengen. Zwar steigen die absoluten Zahlen etwas an, allerdings sind die alterskorrigierten Inzidenzzahlen stabil. Dass die Zahlen steigen, liegt also nicht daran, dass das Karzinom gefährlicher wird, sondern dass die Bevölkerung längerlebt. Ungefähr ein Drittel der neu diagnostizierten Fälle ist noch in einem lokalen oder regionalen Stadium. Die Zahl der Langzeitüberlebenden nach Resektion und multimodaler Therapie steigt ganz langsam an (derzeit sind es um die 10%).
Diagnosemöglichkeiten
Von den bildgebenden Verfahren sind Magnetresonanztomografie (MRI) und Endosonografie (EUS) mit einer Sensitivität von 90 bis 95% und einer Spezifität zwischen 85 und 90% für Screeninguntersuchungen gut geeignet, während Computertomografie (CT) und Sonografie wegen Strahlenbelastung bzw. mangelnder Auflösung nicht eingesetzt werden sollen. Bei einem suspekten Befund ist die endosonografisch gezielte Feinnadelbiopsie (EUS-FNB) die beste Bestätigung, ihre Sensitivität liegt um die 90%, aber ihre Spezifität praktisch bei 100%. Als serologischer Marker für ein Pankreaskarzinom ist CA 19-9 seit Langem etabliert, die Sensitivität beträgt 60%, die Spezifität über 95%.
An einem erweiterten Biomarker-Panel aus dem Serum wird gearbeitet, ein aus 10 Markern bestehendes Panel der LMU München hat eine „area under the curve“ (AUC) von 0,96 erreicht.1 Eine ganze Reihe molekulargenetischer Marker wie Speichel-RNA, Serum-Mikro-RNA, Next-generation Sequencing (NGS) aus Stenosematerial, DNA-Methylierung sowie zirkulierende DNA oder Mikrobiom-Signaturen, wurde experimentell untersucht, sie haben aber noch nicht den Weg in die Routine gefunden.
Würden wir mit unseren heutigen Methoden – MRI in Kombination mit Bestimmung von CA 19-9 – ein ungefiltertes Bevölkerungsscreening einführen, würden wir bei jährlicher Durchführungunter 100000 Österreicher:innen zwar17 Pankreaskarzinome entdecken, 3 übersehen, aber an die 12000 falschpositive Befunde produzieren, die mit– invasiver – EUS-FNB widerlegt werden müssten. Das Screening von Menschen mit gering erhöhtem Risiko, wie Patient:innen mit Diabetes mellitus oder Raucher:innen (jeweils doppelt so hohes Risiko),würde ebenso am Spezifitätsproblem scheitern.
Risikogruppen
Der einzig mögliche Ausweg scheint zu sein, das Screening für Gruppen mit hohem Risiko zu etablieren, also Personen mitPankreaszysten, früh manifestierenden Formen der chronischen Pankreatitis, Personen aus Familien mit Häufung von Pankreaskarzinomen sowie Personen mit bekannten genetischen Syndromen wie Lynch, Peutz-Jeghers, BRCA-Mutationen oder demfamiliären atypischen multiplenMuttermal- und Melanom-Syndrom(FAMMM).
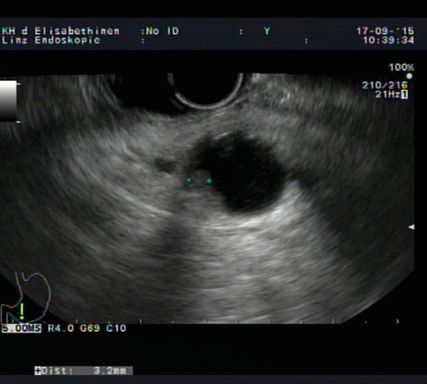
Unter den Pankreaszysten haben intraduktale papilläre muzinöse Neoplasien (IPMN), muzinöse Zystadenome sowie der seltene Frantz-Tumor das Potenzial, im Laufe der Zeit bösartig zu werden, mit unterschiedlicher Wahrscheinlichkeit. Ob und in welchen Abständen sie bildgebend und mit Bestimmung von CA 19-9 kontrolliert werden sollen oder ob bereits eine Operation indiziert ist, ist in den sogenannten Fukuoka-Guidelines und den diesbezüglichen europäischen Richtlinien festgelegt.2 Während (bei entsprechend hoher Lebenserwartung)muzinöse Zystadenome (Risiko ca. 25%) und Hauptgang-IPMN (Risiko ca. 80%) sowie Frantz-Tumoren (Risiko ca. 10%) primär operiert werden sollen, werden Seitenast-IPMN kontrolliert,besteht bei ihnendoch ein relativ bescheidenes Risiko für Malignisierung von ca. 3–15% über 5–15 Jahre.3 Abbildung 1 zeigt eine Seitenast-IPMN mit „worrisome feature“ in der Endosonografie.
Die Zystenpunktion mit Zystensaftanalyse (Amylase, CEA und Blutzucker) und Molekulargenetik (KRAS, GNAS, p53 ...) hat sich nie klar durchsetzen können,4 die Zukunft scheint eher in serologischen Markern (Liquid Biopsy) wie dem zuletzt beschriebenen MUC5AC zu liegen.5 Der MUC5AC-Nachweis weist mit 82% Sensitivität und 100% Spezifitätauf dysplastische oder frühkarzinomatöse Seitenast-IPMN hin, in Verbindung mit der Bildgebung wurden in einer Gastroenterology-Studie sogar alle Neoplasien korrekt erkannt.
Überwachung vonRisikopatient:innen
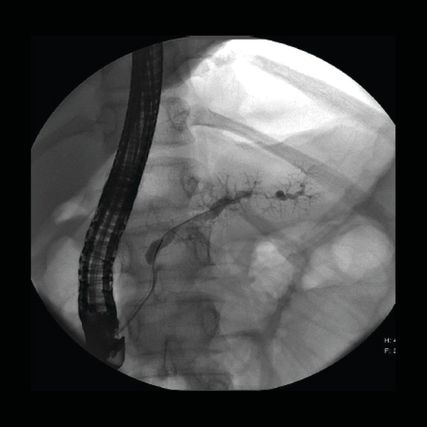
Die chronische Pankreatitis soll dann überwacht werden, wenn sie bereits vor dem 30. Lebensjahr klinisch manifest wurde, z.B. bei den durch genetische Mutationen (PRSS1, SPINK1, CFTR ...) bedingten Formen (hereditär/familiär/juvenil). Da das Risiko der Betroffenen, ein Karzinom zu entwickeln, auf das ganze Leben gerechnet 40 bis 70% beträgt, sollen sie etwa ab dem 30. Lebensjahr jährlich mit MRI oder EUS in Kombination mit Bestimmung von CA 19-9 überwacht werden. Abbildung 2 zeigt die fortgeschrittenen Veränderungen am Hauptgang bei einer 12-jährigen Patientin mit PRSS1-Mutation.
In Familien mit gehäuftem Auftreten von sporadischen Pankreaskarzinomen (2 Verwandte, davon 1 erstgradig, oder 1 Verwandte:r, der/die bereits vor dem 50. Lebensjahr erkrankt ist) soll die Überwachung mit dem Alter von 50 Jahren oder in einem Alter, das 10 Jahre unter demdes jüngsten Indexfalls in der Familie liegt, beginnen, ebenfalls jährlich mit MRI oder EUS.6
Erfahrungen aus Überwachungsprogrammen
2021 wurden in Gastroenterology erste Erfahrungen aus 16 internationalen Überwachungsprogrammen publiziert.7 1% der überwachten Patient:innen entwickelteein Pankreaskarzinom oder eine hochgradige Dysplasie im Laufe von im Mittel 2,5 Jahren. In der Hälfte der Fälle handelte es sich um neu entdeckte Neoplasien, in der anderenHälfte um bereits bekannte und unter Überwachung stehende Veränderungen. Allerdings hatten sich bereits drei Viertel dieser Malignome über das Organ hinaus verbreitet.Ein besonders erfolgreiches Überwachungsprogramm der Johns-Hopkins-Universität in Baltimore (USA) fand unter 354 Hochrisikopatient:innen in 7% Neoplasien, entsprechend einer jährlichen Malignitätsrate von 1,6%.Von diesenwaren85% resezierbar und die Patient:innen überlebtenlänger als 3 Jahre. Die „worrisome features“ der Fukuoka-Guidelines erwiesen sich dabei als valide Prädiktoren.8 Die chirurgische und die multimodale Therapie des Pankreaskarzinoms können heute respektable, wenn auch noch nicht befriedigende Ergebnisse liefern: Das finnische Pankreaskarzinom-Register zeigt eine 10-Jahres-Überlebensrate aller Operierten von 14% sowie bei T1-2-N0-Tumoren, die auf R0 reseziert werden konnten, eine Rate von immerhin 31%.9
Ausblick
Spannend für die Zukunft klingt die Beschäftigung mit Mikrobiomsignaturen, deren Dysbiose sich bei Pankreaskarzinompatient:innen häufen. Damit erlebt der Karzinom-Schnüffelhund vergangener Tage möglicherweise eine„Wiedergeburt“ in Gestalt von Atemtests, die Ausdruck der Gasproduktion des Mikrobioms sind.10
Die Weiterverfolgung der skizzierten Wege scheint einiges zu versprechen. Es wäre wünschenswert, wenn in Österreich ein strukturiertes Konzept zur Früherkennung unter Studienbedingungen etabliert und finanziert würde.
Literatur:
1 Mayerle J et al.: Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis.Gut 2018; 67(1): 12-37 2 European Study Group on Cystic Tumours of the Pancreas: European evidence-based guidelines on pancreatic cystic neoplasms. Gut 2018; 67(5): 789-804 3 Oyama H et al.: Long-term risk of malignancy in branch-duct intraductal papillary mucinous neoplasm. Gastroenterology 2020; 158(1): 226-37 4 Singhi AD et al.: Preoperative next-generation sequencing of pancreatic cyst fluid is highly accurate in cyst classification and detection of advanced neoplasia. Gut 2018; 67(12): 2131-41 5 Yang KS et al.: Extracellular vesicle analysis allows for identification of invasive IPMN. Gastroenterology 2021; 160(4): 1345-58 6 Goggins M et al.: Management of patients with increased risk for familial pancreatic cancer: updated recommendations from the International Cancer of the Pancreas Screening (CAPS) Consortium. Gut 2020; 69(1): 7-17 7 Overbeek KA et al.: Timeline of development of pancreatic cancer and implications for successful early detection in high-risk individuals.Gastroenterology 2022; 162(3): 772-85.e4 8 Canto MI et al.: Risk of neoplastic progression in individuals at high risk for pancreatic cancer undergoing long-term surveillance. Gastroenterology 2018; 155(3): 740-51 9 Seppänen H et al.: The results of pancreatic resections and long-term survival for pancreatic ductal adenocarcinoma: a single-institution experience. Scand J Surg 2017; 106(1): 54-61 10 Bellotti R et al.: Micro- and mycobiota dysbiosis in pancreatic ductal adenocarcinoma development. Cancers 2021; 13(14): 3431
Das könnte Sie auch interessieren:
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...
Therapie des Morbus Crohn: Biologikabehandlung optimieren
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die ...