Eine benigne Erkrankung – aber potenziell mit hohem Leidensdruck
Bericht:
Mag. Dr. Anita Schreiberhuber
Endometriose ist nach wie vor eine Erkrankung, die häufig viel zu lange nicht richtig diagnostiziert wird. Mit etwas Übung ist sie allerdings mit dem transvaginalen Ultraschall gut erkennbar. Der Ultraschall ist auch der Goldstandard für die Klassifikation und Operationsplanung. In zwei Dritteln der Fälle ist die Erkrankung medikamentös managebar.
Bei Endometriose handelt es sich um eine benigne, chronische östrogenabhängige Erkrankung, bei der endometriumartige Zellverbände außerhalb des Cavum uteri vorhanden sind. Sie kann mit ausgeprägten Schmerzen einhergehen und die Lebensqualität (QoL) beeinträchtigen.1–3
„Endometriose ist immer noch ein ‚Stiefkind‘ in der Gynäkologie und wird leider nach wie vor viel zu spät erkannt: In Österreich umfasst die Zeitspanne vom Beginn der Symptome bis zur Diagnose im Durchschnitt acht bis zehn Jahre“, gab OÄ Dr. Ursula Sevelda, Abteilung für Gynäkologie, Barmherzige Brüder Graz, zu bedenken. Sevelda, die sich auf die Behandlung von Endometriose spezialisiert hat, kritisierte auch, dass der Stellenwert des gynäkologischen Ultraschalls vor allem in der Facharztausbildung immer noch geringer ist als der des geburtshilflichen Ultraschalls. Dabei ist Endometriose – bis auf die peritoneale Lokalisation – sehr gut mittels Transvaginalsonografie diagnostizierbar.
Was die Verzögerung in der Diagnose bzw. Fehldiagnosen betrifft, gaben gemäß einer Umfrage 127 von 171 Patient:innen (74,3%) an, vor der definitiven eine falsche Diagnose erhalten zu haben. Die Fehldiagnosen umfassten chronischen Beckenbodenschmerz (n=57) und Reizdarmsyndrom (n=33) bis hin zu psychosexuellen Störungen (n=21).3
Lokalisationen und Symptome
Mögliche Lokalisationen sind das Peritoneum, die Ovarien („Endometriome“; Endometriosezysten), das Uterusmyometrium (Adenomyosis uteri), tief infiltrierende Endometrioseherde (TIE; in Septum rectovaginale, Vagina, Darm, Ligamentum sacrouterinum, Harnblase, Parametrien, Ureter) und extragenitale Orte (Appendix, Zwerchfell, Sectio-/Episiotomienarben, Nabel, Lunge), wobei die thorakale Endometriose selten ist. „Es gibt keine Korrelation zwischen dem Ausmaß der Schmerzen und dem Ausmaß der Endometriose. Per Zufallsbefund diagnostizierte asymptomatische Endometriosen sind nicht behandlungsbedürftig, außer im Falle einer drohenden Organbeeinträchtigung, wie z.B. einer Ureterstenose“, betonte Sevelda.
Die mit Endometriose assoziierten Symptome gehen mit der Lokalisation einher. Die peritoneale Endometriose ist durch chronische Unterbauchschmerzen und in den meisten Fällen – charakteristisch für die Erkrankung – mit Dysmenorrhö charakterisiert und die einzige Lokalisation, die nur mit einer Laparoskopie diagnostiziert werden kann.
Alle anderen Endometrioseherde können hingegen gut mittels Ultraschall erkannt werden. „Oft wird als erste Lokalisation die ovarielle Endometriose, sogenannte Endometriosezysten, im transvaginalen Ultraschall gesehen. Diese ist jedoch häufig – insbesondere, wenn sie beidseitig auftritt (‚kissing ovaries‘) – nur die Spitze des Eisbergs. Sie sind gewissermaßen ein Marker für das Vorliegen einer Endometriose im Becken und sollen Anlass für eine umfassendere Untersuchungsein. Bei 44% der Patient:innen wird konkomitant eine tief infiltrierende pelvine Endometriose nachgewiesen“, betonte Sevelda.
Die Adenomyose, die bei ca. 70% der Frauen mit Endometriose auftritt, stellt insofern ein Problem dar, als sie meist diffus im Myometrium wächst, sodass uteruserhaltende Operationen nur in seltenen Fällen möglich sind. Abgesehen von den damit assoziierten Dysmenorrhöen und Menorrhagien kann sie die Ursache von Infertilität und rezidivierendem Implantationsversagen im Rahmen einer IVF sein.
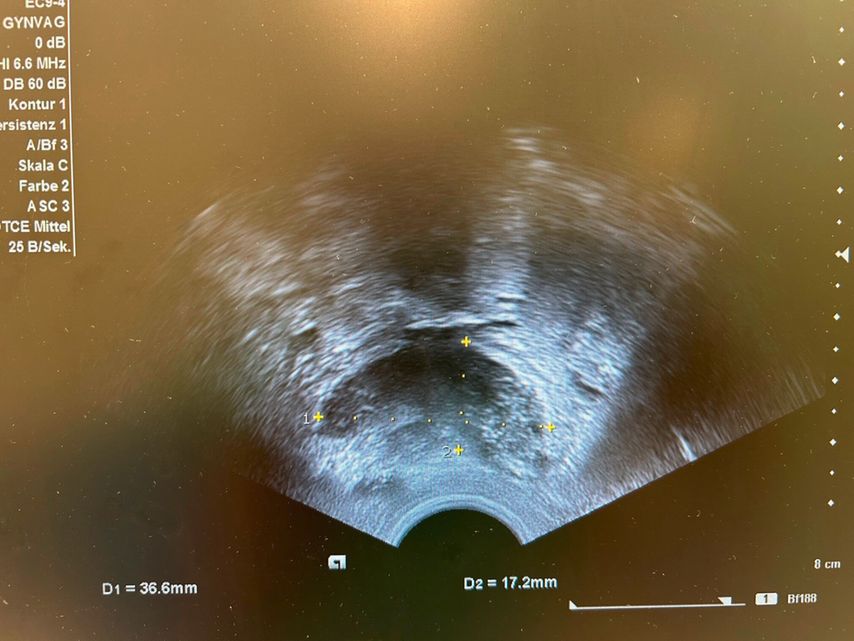
Eine TIE bedeutet eine Gewebeinfiltration von ≥5mm. Die häufigste Lokalisation ist das Ligamentum sacrouterinum. Genauso wie bei Lokalisation in der Vagina oder dem Parakolpium können die damit assoziierten Symptome Dyspareunie, also Schmerzen beim Geschlechtsverkehr, sein. „Diese Endometrioseherde können bei Progredienz zu einer extrinsischen Ureterstenose und chronischen Hydronephrose bis hin zum Verlust der Nierenfunktion führen. Aus diesem Grund ist es entscheidend, dass bei allen Endometriosepatient:innen ein Nieren-US durchgeführt wird“, betonte Sevelda. Eine tief infiltrierende Darmendometriose kann zu Symptomen wie Dyschezie, Hämatochezie, chronischen Unterbauchschmerzen und Obstipation führen (Abb. 1). Ein Ileus tritt jedoch selten auf.
Abb. 1: Bild einer tief infiltrierenden Darmendometriose im Transvaginalultraschall
Endometrioseherde in der Blase sind mit Harnwegsinfekt-ähnlichen Symptomen, also Dysurie, Pollakisurie und Hämaturie, assoziiert und gehen ebenfalls mit dem Risiko für eine Ureterinvolvierung einher. Als problematisch erwähnte Sevelda, dass sowohl die Darm- als auch die Blasenendometriose in der Kolonoskopie oder Zystoskopie oft übersehen werden, da die Mukosa von der Endometriose nicht betroffen ist.
Die thorakale Endometriose (Zwerchfell, Pleura, Lunge; in 95% ist die rechte Thoraxhälfte betroffen) kann mit Schmerzen in der rechten Schulter, Hämoptysen, Dyspnoe und Thoraxschmerzen einhergehen.
Für die Einteilung der Endometriose nach Lokalisation und Ausprägung hat sich in den letzten Jahren die #ENZIAN-Klassifikation international durchgesetzt.4 Die Klassifikation sollte bereits bei der US-Untersuchung erfolgen, da sie wesentlich für die Operationsplanung ist.
Diagnose von Endometriose
Anamnese:
Im Zuge der Anamnese sollten zyklusassoziierte Blutungsbeschwerden und Schmerzen sowie deren Lokalisation evaluiert werden. Dabei spielen die „4D“ eine zentrale Rolle – die Befragung nach Dysmenorrhö, Dyspareunie, Dyschezie und Dysurie. Die Beurteilung der Schmerzstärke durch die Patient:innen erfolgt mittels der VAS („visual analogue scale“).
Gynäkologische Untersuchung:
Die Untersuchung mit getrennten Specula ermöglicht das Auffinden einer tief infiltrierenden Scheidenendometriose – diese befindet sich meistens im hinteren Fornix und kann mit dem Selbsthaltespeculum übersehen werden. Endometrioseherde zeigen sich oft als derbe, blaue, hämorrhoidenartige Knoten, manchmal als weiße Einziehungen, die unverschieblich und mit freiem Auge gut ersichtlich sind.
Auch bei der bimanuellen Tastuntersuchung sind die derben Knoten gut tastbar und häufig stark druckdolent.
Bildgebung – Ultraschall:
Als Vorteile des US führte Sevelda die breite Verfügbarkeit, die geringen Kosten sowie die fehlende Strahlenbelastung an. Weiters handelt es sich um eine dynamische Untersuchung, die leicht erlernt werden kann.
„Der transvaginale US (TVUS) hat den höchsten Stellenwert in der Diagnose von gynäkologischen Erkrankungen und weist im kleinen Becken eine bessere Treffsicherheit auf als eine CT-Untersuchung. Eine MRT-Untersuchung ist nur für spezielle Fragestellungen (z.B. Plexus-sacralis-Infiltration, Zwerchfellbefall) notwendig und sollte, wenn überhaupt, von Radiolog:innen durchgeführt werden, die mit Endometriose vertraut sind. Eine akkurate präoperative Diagnostik und Patient:innenaufklärung sind für die gesamte OP-Planung entscheidend“, unterstrich Sevelda. Gemäß den Ergebnissen einer Studie weist der TVUS in der Detektion von Endometriose im kleinen Becken eine Sensitivität von 91% und eine Spezifität von 98% auf.5
Therapie – primär medikamentöse Strategie verfolgen:
Die Therapieziele bei Endometriose bestehen im Erzielen einer langen Beschwerdefreiheit, in der Vermeidung von Organdestruktionen, der Verbesserung der QoL, der Schmerzreduktion und dem Fertilitätserhalt. Insbesondere wenn eine OP erforderlich ist, sollen multiple Eingriffe vermieden werden. Bei zwei Dritteln der Patient:innen ist die Erkrankung medikamentös managebar.
Medikamentöse Therapie – Therapie der 1. Wahl:
Eine wesentliche Säule in der Therapie von Endometriose bildet die hormonelle Therapie. Sie dient dem Ziel der Induktion einer Amenorrhö bzw. einer Blutungsreduktion und der Verkleinerung der Endometrioseherde, kann der Progredienz entgegenwirken und auch als postoperative Rezidivprophylaxe zum Einsatz kommen. Als systemische Therapie werden in den S2k-Guidelines1 Gestagene, kombinierte orale Kontrazeptiva und GnRH-Analoga angeführt, wobei Sevelda Pillen im Langzeitzyklus den Vorrang einräumt. Relugilox als GnRH-Antagonist wäre eine weitere Option – die Substanz ist erst nach Erscheinen der Guidelines1 verfügbar geworden und daher darin noch nicht angeführt. Lokal kann ein LNG-IUD (Levonorgestrel-Intrauterinsystem) zur Anwendung kommen, das neben der Schmerzreduktion zu einer Endometriumatrophie und somit häufig zu einer Verbesserung von Blutungsstörungen vor allem bei Adenomyosis uteri führt.1
Zusätzlich sollte den Patient:innen eine symptomatische Schmerztherapie angeboten werden, wobei gute Daten für Mefenaminsäure vorliegen6 und gemäß der bestehenden Evidenz nichtsteroidale Antirheumatika effektiver sind als Paracetamol.1
Operative Therapie:
Eine OP ist bei Therapieresistenz unter medikamentöser Therapie indiziert oder wenn eine Kontraindikation oder Unverträglichkeit gegen die Medikation vorliegt, außerdem bei Organbeeinträchtigung (drohender Ileus, Hydronephrose) oder Sterilität.7 Sevelda machte insbesondere im Zusammenhang mit einem bestehenden Kinderwunsch auf die Berücksichtigung der ovariellen Reserve aufmerksam: Jede operative Entfernung von Endometriosezysten hat einen substanziellen Einfluss auf die ovarielle Reserve, sodass insbesondere bei geringer Symptomatik Zurückhaltung geboten ist. Komplexe, tief infiltrierende Endometriosen sollten ebenfalls nur bei symptomatischen, therapieresistenten Patient:innen in einem interdisziplinären Team operiert werden.7
Quelle:
Webinar „Endometriose – Diagnose und Therapie“ der Jungen Gyn in Kooperation mit Universimed, 5.6.2024
Literatur:
1 S2k-Leitlinie Diagnostik und Therapie der Endometriose der DGGG, OEGGG und SGGG, Stand: August 2020. Online unter https://register.awmf.org/assets/guidelines/015-045l_S2k_Diagnostik_Therapie_Endometriose_2020-09.pdf . Abgerufen am 29.7.2024 2 Bulun SE: N Engl J Med 2009; 360: 268-79 3 Hudelist G et al.: Hum Reprod 2012; 27: 3412-16 4 Keckstein J et al.: Acta Obstet Gyn Scand 2012; 100: 1165-75 5 Hudelist G et al.: Ultrasound Obstet Gynecol 2011; 37: 480-87 6 Brown J et al.: Cochrane Database Syst Rev 2017; 1(1): CD004753 7 Becker CM et al.: Human Reprod Open 2022; doi: 10.1093/hropen/hoac009. eCollection 2022
Das könnte Sie auch interessieren:
Künstliche Intelligenz in der Brustpathologie
Die Einführung von künstlicher Intelligenz (KI) markiert einen Paradigmenwechsel in der Pathologie – insbesondere in der Brustpathologie. Validierte KI-Tools steigern bereits heute ...
Postpartale Blutung im Fokus
Wenn sich die Sonne über dem Tafelberg erhebt und das goldene Licht über Kapstadt legt, ahnt man kaum, dass sich hier im Oktober 2025 mehr als 8000 Fachpersonen aus über 130 Ländern ...
Muss das duktale Carcinoma in situ noch operativ behandelt werden?
Das duktale Carcinoma in situ (DCIS) ist ein möglicher Vorläufer des invasiven Mammakarzinoms, wird jedoch zunehmend als heterogene Entität erkannt, sodass eine Standardtherapie mit ...