Advanced Heart Failure bei Kardiomyopathien
Autor:innen:
Dr. Viktoria Höller
Prof. PD Dr. Dr. Markus Wallner, FESC, FHFA
Universitätsklinik für Innere Medizin
Abteilung für Kardiologie
Universitätsklinikum Graz
E-Mail: viktoria.hoeller@medunigraz.at
Bei der Therapie der fortgeschrittenen Herzinsuffizienz („advanced HF“) stößt man konservativ rasch an seine Grenzen. Häufig ist es schwierig abzuschätzen, wann der richtige Zeitpunkt gekommen ist, um an eine Herztransplantation oder an ein mechanisches Unterstützungsverfahren zu denken. Bei spezifischen Kardiomyopathien gibt es in fortgeschrittenen Stadien zwar wenig Evidenz dafür, jedoch zeigen kleine, nichtrandomisierte Studien, dass auch hier bei kritischer Indikationsstellung ein Benefit mit zufriedenstellender Prognose erzielt werden kann.
Keypoints
-
Aufgrund der geringen Evidenz im „Advanced heart failure“-Bereich beruhen viele Empfehlungen auf Meinungen von Expert:innen. Multidisziplinäre Erfahrung und eine enge Zusammenarbeit im Heart- Team sind von zentraler Bedeutung, um eine optimale Versorgung zu gewährleisten.
-
Bei vorhandenen Red Flags sollte eine frühzeitige Zuweisung an ein spezialisiertes Zentrum erfolgen.
-
Aufgrund der technischen Fortschritte ist die LVAD-Therapie nicht mehr nur als „bridge to transplant“ geeignet, sondern durchaus auch für den dauerhaften Einsatz.
-
In Zukunft sollte auch die Option der palliativen Versorgung bei HI mehr in den Fokus gerückt werden.
Definition einer fortgeschrittenen Herzinsuffizienz
Gemäß den rezenten ESC Guidelines für Herzinsuffizienz (HI) besteht eine fortgeschrittene HI dann, wenn sowohl Symptome im Sinne von NYHA IV, eine schwere kardiale Dysfunktion, also mehr als eine ungeplante Hospitalisierung innerhalb eines Jahres, auftreten sowie eine objektivierbare höhergradig eingeschränkte körperliche Belastbarkeit besteht (Tab. 1).1
Tab. 1: Kriterien für die Definition der fortgeschrittenen Herzinsuffizienz. (modifiziert nach McDonagh TA et al. 2021)1
1–10% aller Herzinsuffizienzpatient:innen entwickeln im Verlauf eine fortgeschrittene Herzinsuffizienz und erreichen somit den Punkt, an dem trotz maximaler Therapie (Medikamente, Devices, Interventionen) anhaltende Symptome bei geringster Belastung oder sogar in Ruhe bestehen. Die Transition von einer chronischen Herzinsuffizienz zur „advanced HF“ ist häufig ein schleichender Prozess, welcher meist nicht als solcher eingeschätzt bzw. erkannt wird.
Zu den Red Flags, bei denen man an erweiterte Therapieoptionen (Herztransplantation oder mechanische Unterstützungssysteme) denken sollte, gehören unter anderem die schlechte Toleranz der HI-Medikation, zunehmende Abnahme der Nierenfunktion sowie Aggravierung der Symptome gepaart mit Verschlechterung der Lebensqualität. Bei Vorliegen von Hochrisikozeichen, wie einer höhergradigen Mitralinsuffizienz, ventrikuläreArrhythmien oder starkem, ungewolltem Gewichtsverlust, sollte jedenfalls die Überweisung an ein Herzinsuffizienzzentrum erfolgen.
Die fortgeschrittene HI ist mit einer sehr schlechten Prognose assoziiert. Je nach Studie liegt die 1-Jahres-Mortalität zwischen 25 und 75%. Scoring-Systeme, wie z.B. das SHFM, der HFSS oder MECKI, die klinische und teilweise auch therapeutische Parameter heranziehen, können zur Prognoseabschätzung herangezogen werden.
Therapieoptionen
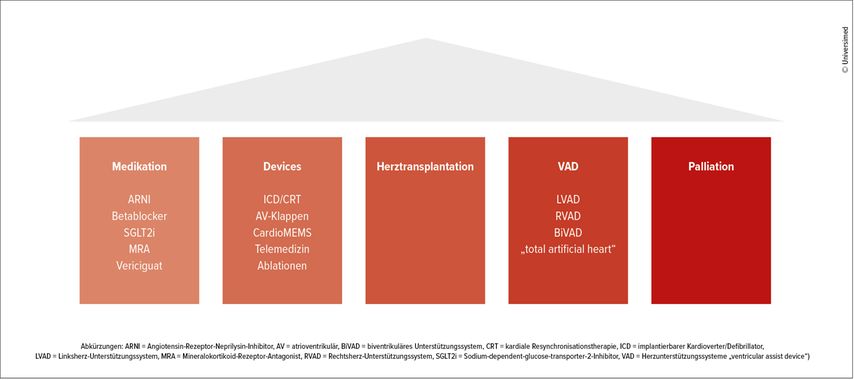
Die Therapie der fortgeschrittenen Herzinsuffizienz stützt sich auf 5 Säulen. Von Beginn an stehen eine Guideline-konforme medikamentöse Therapie, diverse Device-Therapien (z.B. ICD, CRT, CardioMEMS) sowie Interventionen (z.B. TEER-Verfahren bei AV-Klappeninsuffizienzen, Pulmonalvenenisolation bei Vorhofflimmern, Revaskularisierung der Koronarien etc.) zur Verfügung. Im weiteren Verlauf rücken vor allem die Herztransplantation (HTX) als Goldstandard sowie mechanische Unterstützungssysteme, wie das links-, rechts- oder biventrikuläre „assist device“ (LVAD, RVAD oder BiVAD) in den Vordergrund. Als wichtige 5. Säule der Therapie ist explizit die palliative Versorgung zu erwähnen, welche leider viel zu häufig wenig Beachtung im Bereich der Herzinsuffizienz findet (Abb. 1).
Medikamentöse Therapie bei fortgeschrittener Herzinsuffizienz
Bei chronischer HI mit reduzierter Linksventrikelfunktion (EF ≤40%) bringen die rasche Einleitung und Auftitrierung der „fantastic 4“ einen deutlichen Überlebensvorteil, weshalb für Betablocker, Aldosteronrezeptor-Antagonisten, ACE-Hemmer/ARNI/AT1-Blocker und SGLT2-Inhibitoren eine Klasse-I-Empfehlung gilt. Ob die „fantastic 4“ bei fortgeschrittener HI einen ähnlichen Benefit bringen, kann man nicht mit allerletzter Konsequenz sagen, da dazu große prospektive randomisierte Studien fehlen.
Aus kleineren Studien bzw. Subgruppenanalysen gibt es jedoch Hinweise, dass die neurohumorale Therapie bei fortgeschrittener HI weniger effektiv ist und vielleicht sogar einen Nachteil bringen kann.2 Im LIFE Trial wurden 335 Patient:innen zu ARNI oder Valsartan randomisiert. In der Run-in-Phase wurde bereits die niedrigste Dosierung von 76 Patienten nicht vertragen und auch im weiteren Studienverlauf fielen in beiden Gruppen ca. 30% aus. Zusätzlich zeigte sich ein deutlich erhöhtes Hyperkaliämierisiko unter ARNI.3 Auch die SGLT2-Inhibitoren zeigen deutlich bessere Wirksamkeit bei NYHA-Klasse I und II im Vergleich zu III und IV.4 Durch den Einsatz des Guanylatzyklase-Stimulators Vericiguat, der über die Freisetzung von zyklischem Guanosinmonophosphat (cGMP) zur Vasodilatation und Wasserausscheidung führt, konnte im VICTORIA Trial eine ca. 10%-ige Risikoreduktion der kardiovaskulären Endpunkte gezeigt werden. Ab NTproBNP-Werten über 5314pg/ml konnte durch das Medikament jedoch kein Überlebensvorteil mehr erwiesen werden.5 Ein weiteres Beispiel für eine abgeschwächte Wirksamkeit bei fortgeschrittener HI zeigte die GUIDE-HF-Studie. Die Messung von pulmonalarteriellen Drücken, wie z.B. mit dem „CardioMEMS“-System, ermöglicht hier bei Erkennung eines Anstieges und damit einer beginnenden kardialen Dekompensation die frühzeitige Anpassung der Diuretikatherapie, um eine Hospitalisierung zu verhindern. Bei Patienten mit NYHA IV konnten jedoch auch hier keine wesentlichen Vorteile gezeigt werden.6
Das Konzept der „Laplace-Therapie“
Aufgrund der unbefriedigenden Wirksamkeit der klassischen HI-Therapie wurde von M. Mehra ein neues Konzept geprägt, um die zentrale Hämodynamik zu verbessern – die „invasive Laplace-Therapie“. Dabei geht es um nichts anderes, als die erhöhte Wandspannung zu senken. Wenn man sich das Laplace-Gesetz genauer ansieht, wird klar, dass dies nur durch Senkung des transmuralen Drucks oder durch eine Modifizierung des Myokards(chirurgisch oder zellulär restaurativ) erreicht werden kann (Abb. 2). Da die Modifizierung des Myokards zum jetzigen Zeitpunkt noch keinen klinischen Stellenwert hat, bleibt aktuell nur eine Drucksenkung im linken Ventrikel (LV) als valide Therapieoption. Eine Entlastung des LV kann vor allem durch ein linksventrikuläres Assistenzsystem (LVAD) erzielt werden, das das Leben verlängert – sowohl als Überbrückung bis zur Transplantation als auch als lebenslange „destination therapy“.7
Abb. 2: Therapieoptionen der fortgeschrittenen Herzinsuffizienz (modifiziert nach Mehra MR et al. 2022)8
Der Beginn der LVAD-Therapie hat aufgrund der Gerätegröße sowie massiver Invasivität des Eingriffs zu einer sehr hohen Komplikations- und Mortalitätsrate geführt. So wurde z.B. HeartWare HVAD aufgrund eines höheren Schlaganfallrisikos und des Versagens von Gerätekomponenten aus dem Verkehr gezogen. Die mechanisch gelagerte HeartMate-II-LVAD-Pumpe wurde ebenso durch das vollständig magnetisch gelagerte HeartMate 3 LVAD (HM3) ersetzt, das nahezu keine Anfälligkeit für Gerätethrombosen mehr zeigt und mit einer erheblichen Verringerung der Schlaganfallrate und einem Rückgang der blutungsbedingten Komplikationen einhergeht.
An der zulassungsrelevanten Studie MOMENTUM 3 und dem anschließenden kontinuierlichen Zugangsprogramm nahmen 2200 Patient:innen teil, die mit einem HeartMate 3 versorgt wurden, und erreichten Überlebensraten von 88% nach 1 Jahr und 83% nach 2 Jahren – somit in etwa mit der HTX vergleichbare Ergebnisse. Auf einen Zeitraum von 5 Jahren betrachtet ist das Überleben mit ca. 57% der Herztransplantation (ca. 75%) zwar (noch) unterlegen, sowohl in randomisierten Studien als auch in „real world data“ zeigen sich jedoch eine deutliche Verbesserung der Lebensqualität sowie die Verbesserung der funktionalen Kapazität.8,9
Für diese Therapieoption muss eine selektive Patient:innenselektion erfolgen, vor allem da hier natürlich Nebenwirkungen auftreten können. Aufgrund der Blutverdünnung ist mit hämorrhagischen Ereignissen zu rechnen, und es sind, zumindest in den ersten beiden Jahren nach Implantation, häufiger Hospitalisierungen nötig. Zur Prognoseabschätzung kann z.B. der HeartMate 3 Risk Score verwendet werden.10 Zusätzlich sollte nicht außer Acht gelassen werden, dass dies eine Therapieoption ist, die den Alltag maßgeblich beeinflusst und somit darüber hinaus voraussetzt, dass die Patient:innen sich dazu in der Lage fühlen.
Die antithrombotische Therapie nach einer LVAD-Implantation umfasst üblicherweise eine Behandlung mit einem Vitamin-K-Antagonisten (VKA) und Aspirin. Beim HeartMate 3 (HM3) handelt es sich allerdings um eine vollständig magnetisch gelagerte Pumpe, die im Vergleich zum Vorgängermodell HeartMate II eine verbesserte Hämokompatibilität gezeigt hat. Die ARIES-HM3-Studie zeigte, dass eine Behandlungsstrategie ohne Aspirin bei Patient:innen mit einem HM3-Gerät einer Kombinationstherapie mit einem VKA und Aspirin in Bezug auf Blutungen überlegen war (signifikanter Rückgang um 34%) und zu keinem signifikanten Anstieg des Thromboembolierisikos geführt hat. Auch bei Patient:innen mit erhöhtem Thromboserisiko (z.B. bei früheren Gefäßerkrankungen, einschließlich chirurgischer oder perkutaner koronarer Revaskularisation) war die Behandlung ohne Aspirin überlegen.11
Abbildung 2 fasst die Therapieoptionen der fortgeschrittenen Herzinsuffizienz zusammen.8
Spezifische Kardiomyopathien
Spezifische Kardiomyopathien sollten prinzipiell nach den rezenten ESC-Kardiomyopathie-Guidelines 2023 behandelt werden.12 In fortgeschrittenem Stadium gibt es allerdings keine starken Empfehlungen aufgrund der geringen Evidenz.
Bei der hypertrophen Kardiomyopathie betrifft das rund 5–7%. Eine Listung zur Herztransplantation (HTX) beispielsweise ist meist im Frühstadium noch nicht indiziert. Aufgrund der oftmals raschen Progredienz ist man dann häufig jedoch zu spät dran. Das erreichte Spätstadium zeichnet sich häufig durch einen Wechsel des Phänotyps aus, bei dem es zu einer linksventrikulären Dilatation bei Abnahme der Wanddicke kommt.
Ungefähr 3,5% aller Herztransplantationen erfolgen bei HCM-Patient:innen und die Survival-Daten nach einem Jahr sind hier bei sorgfältiger Patient:innenselektion ähnlich dem Gesamtkollektiv. Bei der Überlegung der Herztransplantation bei HCM-Patient:innen sollte jedoch daran gedacht werden, dass spezifische Medikamente, wie z.B. bei der HOCM Mavacamten, nach HTX kontraindiziert sind. Zusätzlich kommt es häufig zu erhöhten Füllungsdrücken und bei kombinierter pulmonaler Hypertonie zeigt sich ein schlechteres Outcome nach Transplantation. Aufgrund des pathophysiologisch häufig vorliegenden Septumwulsts bzw. eines kleinlumigen linken Ventrikels gibt es hier bei der LVAD-Implantation technische Limitationen.
Ein wirklicher Überlebensnachteil bei HCM konnte im INTERMACS Registry zwar nicht gezeigt werden, jedoch bestand bei einem Großteil der HCM-Patient:innen bereits eine Dilatation des LV, was eine LVAD-Therapie möglich machte.13
Literatur:
1 McDonagh TA et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42(36): 3599-726 2 Greene SJ et al.: Management of worsening heart failure with reduced ejection fraction: JACC focus seminar 3/3. J Am Coll Cardiol 2023; 82(6): 559-71 3 Mann DL et al.: Effect of treatment with sacubitril/valsartan in patients with advanced heart failure and reduced ejection fraction: a randomized clinical trial. JAMA Cardiol 2022; 7(1): 17-25 4 Qiu M, Zhao LM: Commentary: cardiovascular outcome in patients treated with SGLT2 inhibitors for heart failure: a meta-analysis. Front Cardiovasc Med 2021; 8: 77828 5 Armstrong PW et al.: A multicenter, randomized, double-blind, placebo-controlled trial of the efficacy and safety of the oral soluble guanylate cyclase stimulator: the VICTORIA trial. JACC Heart Fail 2018; 6(2): 96-104 6 Lindenfeld J et al.: Haemodynamic-guided management of heart failure (GUIDE-HF): a randomised controlled trial. Lancet 2021; 398(10304): 991-1001 7 Mehra MR et al.: Life-prolonging benefits of LVAD therapy in advanced heart failure: a clinician’s action and communication aid. JACC Heart Fail 2023; 11(8 Pt 1): 1011-7 8 Mehra MR et al.: Five-year outcomes in patients with fully magnetically levitated vs axial-flow left ventricular assist devices in the MOMENTUM 3 randomized trial. JAMA 2022; 328(12): 1233-42 9 Schmitto JD et al.: Long-term results in real world patients treated with HeartMate 3 LVAD for advanced heart failure: data from the ELEVATE registry. Paper presented at: European Association for Cardio-Thoracic Surgery (EACTS) Annual Meeting; 2022 10 [ https://codetoheal.shinyapps.io/HeartMate3 ], accessed in July 2024 11 Mehra MR et al.: Aspirin and hemocompatibility events with a left ventricular assist device in advanced heart failure: the ARIES-HM3 randomized clinical trial. JAMA 2023; 330(22): 2171-81 12 Arbelo E et al.: 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J 2023; 44(37): 3503-626 13 Liang LW et al.: Advanced heart failure therapies for hypertrophic cardiomyopathy: state-of-the-art review and an updated analysis from UNOS. JACC Heart Fail 2023; 11(11): 1473-80
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Resultate zur Transthyretin-Amyloidose-Therapie im Real-World-Setting
Die Longitudinalstudie THAOS zeigt, dass die Behandlungserfolge, die mit dem Transthyretin-Stabilisator Tafamidis in der Behandlung der Transthyretin-Amyloidose (ATTR) mit ...