Highlights aus der Thoraxonkologie
Autor:innen:
Núria Zellweger1
Prof. Dr. med. Dr. phil. nat. Sacha Rothschild2
1 Universitätspital Basel
Medizinische Onkologie
2 Kantonsspital Baden
Zentrum für Onkologie & Hämatologie
Korrespondenz:
E-Mail: sacha.rothschild@ksb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit einer Rekordzahl von 34000 Teilnehmenden hat der diesjährige Jahreskongress derEuropäischen Gesellschaft für Medizinische Onkologie (ESMO) in Barcelona eine grosse Bandbreite an interessanten, aufschlussreichen Studien gezeigt. Auch im Bereich der Thoraxonkologie gibt es neue Daten, die die tägliche Praxis beeinflussen und verändern werden.
Kleinzelliges Bronchialkarzinom (SCLC)
Während eine Immuntherapie mit den PD-L1-gerichteten Immuncheckpoint-Inhibitoren Atezolizumab1 beziehungsweise Durvalumab2 als Erhaltungstherapie beim metastasierten kleinzelligen Lungenkarzinom («extensive-stage small-cell lung cancer», ES-SCLC) bereits Teil des Therapiestandards ist, so ist der Stellenwert in früheren Stadien («limited stage SCLC», LD-SCLC) noch unklar. Die STIMULI-Studie, die eine Erhaltungstherapie mit einer kombinierten Blockade mit dem Anti-PD-1-Antikörper Nivolumab und dem Anti-CTLA-4-Antikörper Ipilimumab untersucht hat, ist negativ ausgefallen.3
Demgegenüber zeigte eine Interimsanalyse der ADRIATIC-Studie,4 die eine Konsolidierung mit Durvalumab mit und ohne den Anti-CTLA-4-Antikörper Tremelimumab vs. Placebo untersuchte, einen signifikanten Vorteil im Gesamtüberleben («overall survival», OS) und im progressionsfreien Überleben («progression-free survival», PFS) für die Konsolidierungstherapie mit Durvalumab. Bisher wurden erst Resultate für den primären Endpunkt der Studie, den Vergleich zwischen Durvalumab und Placebo, gezeigt. Für den dritten Arm der Studie, die Konsolidierung mit Durvalumab und Tremelimumab, liegen noch keine Resultate vor. In diese Studie wurden Patient:innen eingeschlossen, die nach der Radiochemotherapie, die gemäss lokalen Standards durchgeführt werden konnte, nicht progredient waren. Die Durchführung einer prophylaktischen Ganzhirnbestrahlung («prophylactic cranial irradiation», PCI) war erlaubt. Für die kombinierte Radiochemotherapie war sowohl eine Therapie mit Carboplatin als auch mit Cisplatin in Kombination mit Etoposid möglich, wobei drei oder vier Zyklen verabreicht werden konnten. Die am ESMO präsentierten zuvor festgelegten Subgruppenanalysen haben nun gezeigt, dass die Konsolidierung mit Durvalumab in allen Subgruppen einen Vorteil bringt.5
Das Ausmass des Vorteils für die Konsolidierung mit Durvalumab ist unabhängig davon, ob Patient:innen eine PCI erhalten haben oder nicht. Es ist auch nicht abhängig von der Fraktionierung der Bestrahlung (einmal vs. zweimal täglich). Bei mit Carboplatin behandelten Patient:innen war der Effekt einer anschliessenden Konsolidierung mit Durvalumab numerisch grösser als bei einer Radiochemotherapie mit Cisplatin. In der multivariaten Analyse zeigten weder die Wahl der Chemotherapie noch die Fraktionierung der Bestrahlung oder die Durchführung einer PCI einen Einfluss auf den Nutzen der Konsolidierungstherapie mit Durvalumab. Frühere Resultate bestätigend, zeigten Patient:innen, die eine Bestrahlung zweimal täglich sowie eine PCI erhielten, unabhängig von der Konsolidierungstherapie eine bessere Prognose mit längerem PFS und OS.
So lässt sich auch nach weiteren Subgruppenanalysen konkludieren, dass eine Erhaltungstherapie mit Durvalumab unabhängig von der Durchführung einer PCI und Fraktionierung der Radiotherapie beim LD-SCLC einen neuen Therapiestandard darstellt.
Frühes, resektables NSCLC
Adjuvante Therapie mit PD-L1-Inhibitor im Frühstadium
Der PD-L1-Inhibitor Durvalumab wurde in der Behandlung des nichtkleinzelligen Lungenkarzinoms (NSCLC) schon in verschiedenen Situationen untersucht und hat einen Nutzen gezeigt.6,7 Eine adjuvante Therapie mit einem Immuncheckpoint-Inhibitor hat sich etabliert. Die Grundlage waren zwei randomisierte Studien mit einem signifikanten Vorteil im krankheitsfreien Überleben.8,9
Die kanadische BR.31-Studie10 hat Durvalumab (D) nun als adjuvante Therapie nach R0-Resektion bei PD-L1-positiven Tumoren im Frühstadium (Stadium IB–IIIA) gegen Placebo (PBO) getestet. Auch Patient:innen mit einer bekannten EGFR-Mutation oder ALK-Translokation wurden eingeschlossen. Den Patient:innen wurde vor der Randomisierung eine adjuvante Chemotherapie angeboten, danach erfolgte die Randomisierung 2:1. Bei einer medianen Nachbeobachtungszeit von 60 Monaten zeigte sich kein signifikanter Vorteil bezüglich des krankheitsfreien Überlebens (D: 69,9 vs. PBO: 60,2 Monate; 95% CI: 0,706–1,247; p=0,642), dies galt auch für Patient:innen ohne EGFR/ALK-Mutation (D: 60,0 vs. PBO: 53,9 Monate; 95% CI: 0,752–1,065; p=0,207) und hoher PD-L1-Expression (D: 59,9 vs. PBO: 60,3 Monate; 95% CI: 0,788–1,248; p=0,926). Der negative Ausgang dieser Studie könnte einerseits dadurch begründet sein, dass trotz korrekten Stagings einige Patient:innen mit Stadium IV eingeschlossen wurden oder dass durch optimale R0-Resektion kein zusätzlicher Benefit erzielt werden kann. Zudem war in dieser Studie die adjuvante Chemotherapie, die einen etablierten Stellenwert hat, nicht obligat; 15% der Patient:innen erhielten keine adjuvante Chemotherapie, wobei auch eine Carboplatin-basierte adjuvante Chemotherapie möglich war. Von denjenigen, die eine adjuvante Chemotherapie erhielten, bekamen nur 62% eine Cisplatin-Dosierung von ≥300mg/m1 und waren somit den Richtlinien entsprechend behandelt.
Diese Studie hat ein umfassendes translationales Biomarker-Programm beinhaltet, von dem wir die Resultate noch erwarten und vielleicht mehr Details zum Stellenwert einer adjuvanten Immuntherapie erfahren werden. Trotz dieser negativen Studie haben die Immuncheckpoint-Inhibitoren einen festen Stellenwert in der Behandlung der frühen, resektablen NSCLC.
Lokal fortgeschrittenes, nichtresektables NSCLC
Tägliche Chemotherapie für ältere Patient:innen
Die Zunahme des Anteils älterer Patient:innen ist eine Herausforderung in der täglichen onkologischen Praxis. Oft sind diese Patient:innen multimorbid und ihr Allgemeinzustand lässt eine Behandlung nach Standardprotokoll nicht zu. Zudem wird diese Population in klinischen Studien, welche Therapiestandards verändern, meist ausgeklammert.
Umso wichtiger sind Studien, wie die Nichtunterlegenheitsstudie JCOG191411 aus Japan, die zwei Optionen einer besser verträglichen und bei älteren Menschen bereits untersuchten Therapie miteinander vergleicht. Untersucht wurden die tägliche Gabe von Carboplatin in reduzierter Dosis von 30mg/m2 (Arm A) und wöchentlich verabreichtes Carboplatin + nab-Paclitaxel (Arm B) bei therapienaiven ≥75-jährigen Patient:innen mit gutem Performance-Status (ECOG PS 0–1) mit nicht resektablem, lokal fortgeschrittenem NSCLC. Alle Patient:innen erhielten zusätzlich zu dieser Therapie eine Bestrahlung mit 30x2=60Gy, und die Erhaltungstherapie mit Durvalumab wurde empfohlen. Das mediane OS nach rund 12 Monaten Nachbeobachtungszeit war in Arm A (Carboplatin dosisreduziert) nicht erreicht und betrug 26,1 Monate in Arm B (Carboplatin+nab-Paclitaxel) (HR: 1,562; 95% CI: 0,786–3,107). Das PFS war 17,3 Monate in Arm A vs. 13,5 Monate in Arm B (HR: 1,188; 95% CI: 0,712–1,982). Eine Nichtunterlegenheit von Arm B zeigt sich gemäss dieser Analyse nur mit einer Wahrscheinlichkeit von 8%.
Die tägliche Gabe von Carboplatin zeigte eine etwas erhöhte Hämatotoxizität, vor allem Thrombozytopenie, jedoch kam es mit Carboplatin/Paclitaxel zu mehr Pneumonitiden, insbesondere auch zu schweren Fällen, und es traten in diesem Arm zwei therapieassoziierte Todesfälle auf. Aufgrund dieser Resultate wurde die Studie nach der ersten Interimsanalyse abgebrochen. Die tägliche Gabe von Carboplatin in Kombination mit Radiotherapie gefolgt von einer Konsolidation mit Durvalumab für 12 Monate ist damit eine mögliche Therapieoption für betagte Patient:innen mit nichtresektablem NSCLC.
Metastasiertes NSCLC
Dosisreduktion für Pembrolizumab?
Bei Patient:innen mit metastasiertem NSCLC ist eine Chemotherapie kombiniert mit dem PD-1-Inhibitor Pembrolizumab Standard.12 Für Patient:innen mit einer PD-L1-Expression ≥50% ist eine Monotherapie mit einem PD-1/PD-L1-Inhibitor, zum Beispiel Pembrolizumab (basierend auf der KEYNOTE-024-Studie),13 die Standardtherapie. Die Dosierung von Pembrolizumab war immer wieder Diskussionsthema.
Die Autor:innen der DEDICATION-1/NVALT-30-Studie14 untersuchen zurzeit den Einfluss einer reduzierten Dosis von Pembrolizumab auf das PFS und OS. Am ESMO wurden die Resultate der Analyse nach Einschluss von 250 Patient:innen vorgestellt. Anstatt der Standardtherapie von 150–200mg alle drei Wochen oder 400 mg alle sechs Wochen erhielten Patient:innen im Interventionsarm (1:1-Randomisierung) die reduzierte Dosis von 100mg alle drei Wochen oder 300mg alle sechs Wochen. Die Interimsanalyse zeigte keinen signifikanten Unterschied in Bezug auf das Überleben nach einem Jahr (57,7% im Standarddosis-Arm und 55% im dosisreduzierten Arm), das mediane PFS war ebenfalls in beiden Gruppen gleich (6,9 vs. 7,6 Monate). Basierend auf dieser Interimsanalyse wird die Studie weitergeführt. Es sollen insgesamt 750 Patient:innen randomisiert werden.
Diese Studie ist nicht zuletzt aus gesundheitsökonomischen Überlegungen sowie unter Berücksichtigung des Zugangs zu diesen verhältnismässig teuren Therapien in weniger privilegierten Gegenden der Welt von Bedeutung. Die niederländische Arbeitsgruppe, die diese Studie mit finanzieller Unterstützung von Krankenversicherern durchführen kann, macht damit eine wichtige und global gesehen bedeutungsvolle Arbeit. Die Tatsache, dass nun eine Interimsanalyse mit Überlebensdaten präsentiert wurde, muss aus statistischen und ethischen Überlegungen kritisch beurteilt werden, da so die weitere Rekrutierung für die Studie gefährdet werden könnte.
ALK-positives NSCLC
Bei der anaplastischen Lymphom-Kinase (ALK) handelt es sich um ein Proto-Onkogen, welches vor allem im Nervensystem vorkommt.15 Eine Veränderung in diesem Signalweg wird heute beim NSCLC standardmässig mittels Immunhistochemie untersucht und mittels Fluoreszenz-in-situ-Hybridisierung (FISH) oder Gensequenzierung («next-generation sequencing», NGS) bestätigt.
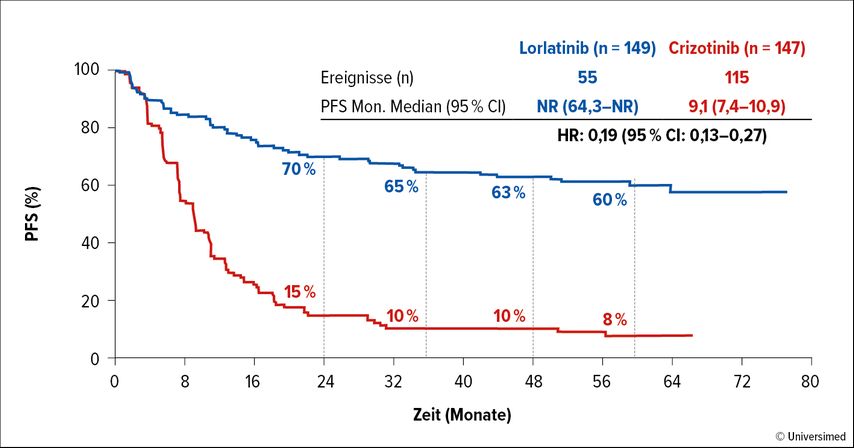
Eine ALK-Translokation liegt in etwa 3–7% aller NSCLC vor16 und gilt als Angriffspunkt in der zielgerichteten Therapie mit Tyrosinkinase-Inhibitoren (TKI).17,18 Mittlerweile werden TKI der 3. Generation therapeutisch eingesetzt.19 Die Langzeitdaten der CROWN-Studie haben den Stellenwert der Therapie mit Lorlatinib gefestigt: Nach einer mittleren Nachbeobachtungszeit von über fünf Jahren war das mediane PFS für mit Lorlatinib behandelte Patient:innen noch nicht erreicht, mit Crizotinib lag es bei 9,1 Monaten (HR: 0,19; 95% CI: 0,13–0,27).20
Abb. 1: Progressionsfreies Überleben (PFS) in der «Intention to treat»-Population (modifiziert nach Solomon BJ et al. 2024)20
Ein neuer TKI, NVL-655, soll sich besonders durch seine Blut-Hirn-Schranken-Gängigkeit und die Tatsache, dass er den NTRK-Signalweg nicht beeinflusst und damit weniger Neurotoxizität aufweisen sollte, hervorheben. Im präklinischen Setting war er auch gegen Resistenzmutationen und die herausfordernden Compound-Mutationen, die auch gegen Lorlatinib resistent sind, wirksam. NVL-655 wurde in der Phase-I/II-Studie ALKOVE-121 bei Patient:innen mit einem soliden ALK-positiven Tumor untersucht. Alle Patient:innen durften mit maximal zwei Chemo-/Immuntherapien vorbehandelt worden sein; Patient:innen mit einem NSCLC mussten mindestens einen ALK-TKI erhalten haben. Im ersten Teil der Studie wurden 150mg täglich als Dosis für die Phase-II-Studie festgelegt. In der Gesamtpopulation der Patient:innen mit NSCLC lag die Ansprechrate («overall response rate», ORR) unabhängig von der Vorbehandlung bei 38%, die mediane Ansprechdauer über alle Dosisstufen war 14,4 Monate. Für die Dosis von 150mg täglich wurde die mediane Dauer des Ansprechens noch nicht erreicht. Bei Patient:innen, die zuvor bereits drei oder mehr ALK-gerichtete TKI inklusive Lorlatinib erhalten hatten, war die ORR mit 35% praktisch gleich hoch. Die mediane Zeit des Ansprechens lag über alle Dosisstufen bei 7,7 Monaten und wurde für die Dosis von 150mg ebenfalls nicht erreicht.
Bei Patient:innen mit vorbestehenden Hirnmetastasen konnte ebenfalls ein Ansprechen beobachtet werden. Weitere Studien mit diesem sehr interessanten ALK-TKI laufen zurzeit, beispielsweise eine Phase-II-Studie bei ALK-positivem NSCLC nach 0–2 Vortherapien (inklusive Zweit-/Drittgenerationen-ALK-TKI). Eine randomisierte Studie in der Erstlinientherapie ist ebenfalls in Planung. Diese Studien sind auch in der Schweiz aktiv.
TROP2-gerichteter Antikörper
Einen interessanten neuen Therapieansatz beim fortgeschrittenen/metastasierten NSCLC untersucht die am WCLC 2024 vorgestellte und kurz darauf im Journal of Clinical Oncology publizierte Studie TROPION-Lung01.22 In einer bereits erfolgten Phase-I-Studie zeigte ein Antikörper-Wirkstoff-Konjugat (ADC), konkret eine Kombination aus dem monoklonalen Antikörper Datopotamab gegen TROP2 und dem Topoisomerase-I-Hemmer Deruxtecan, vielversprechende Ergebnisse bezüglich der Antitumoraktivität, vor allem bei Patient:innen, die zuvor bereits mit mehreren Therapien vorbehandelt wurden.23 In TROPION-Lung01 erhielten Patient:innen, welche bereits mit 1–2 Therapielinien vorbehandelt waren, in der Interventionsgruppe Datopotamab-Deruxtecan (Dato-DXd) 6mg/kg alle drei Wochen, im Kontrollarm erfolgte die Behandlung mit der Standardtherapie Docetaxel 75mg/m2 alle drei Wochen. Die Mehrheit der Teilnehmenden beider Arme hatte eine nichtplattenepitheliale Tumorhistologie (78% im Interventionsarm, 77% im Kontrollarm).
Die objektive Ansprechrate (ORR) lag bei 26,4% mit Dato-DXd vs. 12,8% bei Docetaxel. Das mediane PFS war im Interventionsarm mit 4,4 Monaten signifikant länger als bei Docetaxel mono mit 3,7 Monaten (95% CI: 0,62–0,91, p=0,004). Dies zeigte sich besonders bei nichtplattenepithelialen Tumoren mit einem PFS von 5,5 Monaten vs. 3,6 Monate und einem OS von 14,6 Monaten vs. 12,3. In Bezug auf das mediane OS zeigte sich keine signifikante Überlegenheit der Kombinationstherapie (12,9 Monate vs. 11,8 Monate, 95% CI: 0,78–1,14, p=0,530).
Therapieassoziierte Nebenwirkungen traten bei 87% aller Patient:innen auf, und dies praktisch gleich häufig in beiden Gruppen. Es zeigten sich jedoch deutlich mehr Grad-≥3-Toxizitäten im Docetaxel-Arm als im Interventionsarm (42,1% vs. 25,6%), was sich auch in einer geringeren Häufigkeit von notwendigen Dosisreduktionen (29,7% vs. 20,2%) und Therapieabbrüchen (12,1% vs. 8,1%) manifestierte. Kleiner war der Unterschied bei den schwerwiegenden therapieassoziierten Nebenwirkungen, die bei 9,4% aller Patient:innen im Interventionsarm und 11,7% im Kontrollarm auftraten.
Zusammengefasst zeigte sich also in dieser Population von vorbehandelten Patient:innen ein kleiner, aber signifikanter Vorteil durch die Behandlung mit dem Anti-TROP2 ADC Dato-DXd gegenüber Docetaxel, vor allem bei nichtplattenepithelialen Tumoren. Dieser Vorteil des TROP2-Inhibitors lässt sich am ehesten dadurch erklären, dass nichtplattenepitheliale Tumoren vermehrt TROP2 exprimieren. Der genaue Stellenwert der TROP2-Expression muss noch definiert werden. Ein möglicher interessanter Biomarker ist die normalisierte Membran-Ratio («normalized membrane ratio», NMR), die mit quantitativem kontinuierlichem Scoring («quantitative continuous scoring», QCS), einem neuen digitalen Ansatz, gemessen werden kann.24
Zielgerichtete Therapie gegen LAG3 beiNSCLC im Stadium IV
Relatlimab, der gegen das Lymphozyten-Aktivations-Gen 3 (LAG3) gerichtete Immuncheckpoint-Inhibitor, wurde bereits in der RELATIVITY-047-Studie beim metastasierten, therapienaiven malignen Melanom in Kombination mit Nivolumab (Anti-PD-1) untersucht. In dieser Studie zeigte sich eine signifikante und numerisch relevante Verlängerung des PFS.25 Im Gesamtüberleben zeigte sich kein statistisch signifikanter Unterschied.26
Im Rahmen der Studie RELATIVITY-104 erhielten Studienteilnehmende Relatlimab und Nivolumab in Kombination mit einer platinbasierten Chemotherapie. Verglichen wurde diese Therapie mit der Kombination von Nivolumab und platinbasierter Chemotherapie bei Patient:innen mit metastasiertem/rezidiviertem NSCLC ohne EGFR-Mutation, ALK-Translokation oder ROS1-Fusion.27 Fokus der Studie waren die Sicherheit der Therapie sowie das PFS. Wichtig zu erwähnen ist hierbei, dass 32% im experimentellen Arm (Arm A) und 34% im Kontrollarm (Arm B) eine LAG-3-Expression von <1% zeigten. Die PD-L1-Expression lag bei 44% der Patient:innen in beiden Armen bei <1%. Bei 30% der Patient:innen in Arm A und 21% der Patient:innen in Arm B lag sie bei 1–49% und bei 20% in Arm A und 26% in Arm B bei >50%. Dies ist deshalb relevant, da eine Subgruppenanalyse den grössten Benefit der Kombinationstherapie bei Vorliegen eines PD-L1-Status von >1% gezeigt hat.
Bezüglich der Toxizität waren die beiden Arme vergleichbar, mit einer Rate von unerwünschten Ereignissen aller Schweregrade von 23% in Arm A und 24% in Arm B. In der Gesamtpopulation war das PFS durch die doppelte Immuncheckpoint-Inhibition nicht signifikant verlängert (medianes PFS 6,7 vs. 6,0 Monate, HR: 0,88, 95% CI: 0,71–1,11). In der Subgruppenanalyse zeigte sich ein Vorteil für die Therapie mit Relatlimab bezüglich PFS bei Patient:innen mit Tumoren mit einer PD-L1-Expression ≥1% (medianes PFS 9,8 vs. 6,1 Monate).
Der Interaktionstest für diese Subgruppenanalyse war mit 0,023 signifikant. Auch in der Subgruppe der Patient:innen mit nichtplattenepithelialer Histologie ergab sich ein Vorteil im PFS für die kombinierte Therapie mit Relatlimab (medianes PFS 8,3 vs. 6,0 Monate). Die Autor:innen der Studie machten in der Folge eine nicht geplante Subgruppenanalyse der Patient:innen mit nichtplattenepithelialer Histologie und einer PD-L1-Expression ≥1% und konnten in dieser Subgruppe einen noch prononcierteren PFS-Vorteil von 9,8 Monaten vs. 5,6 (HR: 0,45; 95% CI: 0,25–0,81) zeigen. Diese Analyse ergibt ein interessantes Signal. Es ist aber wichtig, zu betonen, dass die Studie insgesamt als negativ zu bewerten ist und die letztgenannte Subgruppenanalyse nicht präspezifiziert war.
Anti-TIGIT-Antikörper beim therapie-naiven, lokal fortgeschrittenen NSCLC
Seit die Immuntherapie fester Bestandteil eines multimodalen Therapiekonzeptes ist, gewinnt die Frage, wie die Wirksamkeit dieser Therapien verbessert werden kann, an Bedeutung. Die GALAXIES-Studie untersuchte einen Ansatz mit dem Anti-TIGIT-Antikörper Belrestotug in Kombination mit dem Anti-PD-1-Antikörper Dostarlimab bei Patient:innen mit fortgeschrittenem/metastasiertem NSCLC und hoher PD-L1-Expression (≥50%).28 Am ESMO wurden Resultate der Interimsanalyse vorgestellt.
In vier Armen wurde Dostarlimab mono mit der Kombination Dostarlimab + Belrestotug in Dosen von 100mg, 400mg und 1000mg, jeweils dreiwöchentlich, verglichen. Hinsichtlich der ORR war die Dostarlimab-Monotherapie mit 37,5% den Kombinationen mit Belrestotug unterlegen. Die ORR stieg dosisabhängig an und betrug 63,3% für Kombination mit 100mg Belrestotug, 65,6% bei zusätzlicher Gabe von 400mg und 76,7% bei Gabe von 1000mg Belrestotug. Allerdings zeigten sich mit steigender Dosis auch bezüglich der Toxizität markante Unterschiede: 43% der Patient:innen mit der Maximaldosis von 1000mg Belrestotug erlitten eine höhergradige Toxizität (Grad ≥3), während es in den anderen Armen 22% (400mg), 33% (100mg) und 16% (Dostarlimab mono) waren. Gleiches galt für therapieassoziierte immunvermittelte Nebenwirkungen (37% bei 1000mg, 16% bei 400mg, 30% bei 100mg und 19% ohne Belrestotug). Auch der Anteil an Toxizitäten, die einen Therapieabbruch notwendig machten, war im Arm mit 1000mg Belrestotug mit 40% am höchsten (16% bei 400mg, 23% bei 100mg und 6% ohne Belrestotug). Daraus abgeleitet zeigt sich bei der Kombinationstherapie aus Dostarlimab und Belrestotug durchaus ein interessantes Signal bei der ORR, aufgrund der Toxizität muss aber auf die Dosis besonderes Augenmerk gelegt werden.
An diese Erkenntnisse anschliessend untersucht aktuell die Phase-III-Studie GALAXIES Lung-301 (NCT05565378) die beiden Arme Placebo + Pembrolizumab vs. Belrestotug + Atezolizumab.
Versagen der Erstlinientherapie – wieweiter?
Der Fortschritt in der Behandlung des metastasierten NSCLC führt zu neuen Herausforderungen, besonders wenn die Erstlinientherapie mit Immuncheckpoint-Inhibitoren und meist platinbasierter Chemotherapie versagt. Docetaxel hat sich lange vor Einführung von Immuntherapien als Zweitlinientherapie etabliert und ist auch heute noch der Standard der Behandlung.29 In einer Phase-III-Studie wurde nun das neue Molekül Plinabulin in Kombination mit Docetaxel (DP-Gruppe, Plinabulin an Tag 1 und 8) gegen Docetaxel + Placebo (D-Gruppe) untersucht.30
Plinabulin blockiert die Polymerisierung von Tubulin und hat eine stimulierende Wirkung auf das adaptive und angeborene Immunsystem über die Induktion der Reifung von dendritischen Zellen. Damit hat die Substanz das Potenzial, die Immuntherapieresistenz zu überwinden. In diese Studie eingeschlossen wurden Patient:innen mit NSCLC und EGFR-Wildtyp in der zweiten oder dritten Therapielinie, deren Erkrankung unter platinbasierter Chemotherapie progredient war. Eine vorhergegangene Therapie mit einem Immuncheckpoint-Inhibitor war erlaubt; rund 20% der Patient:innen hatten eine solche Therapie bereits gehabt. Dabei zeigte die Kombination mit Plinabulin ein signifikant längeres OS von 10,5 Monaten vs. 9,4 Monate (HR: 0,82, p=0,0399), akzentuiert bei nicht-plattenepithelialer Histologie mit 11,4 Monaten vs. 8,8 (HR: 0,72, p=0,0078). Die Rate an therapieassoziierten Nebenwirkungen war in beiden Gruppen praktisch gleich (DP 99,6%, D 99,3%), vor allem auch die Rate an höhergradigen Toxizitäten (G3–5) (77% vs. 74,9%). Interessanterweise ergab sich bei Patient:innen in der DP-Gruppe eine signifikante Reduktion von Grad-4-Neutropenien (33,6% vs. 5,1%). Damit einhergehend waren auch die Rate an Hospitalisationen aufgrund einer febrilen Neutropenie sowie der Einsatz von G-CSF bei Patient:innen, die mit der Kombination behandelt wurden, geringer. Demgegenüber steht eine höhere Rate an gastrointestinalen Nebenwirkungen sowie arterieller Hypertonie.
Thymome
Maligne Thymustumoren sind mit einer Inzidenz von etwa 0,13/100000 Personen selten,31 was die Machbarkeit von kontrolliert-randomisierten Studien erschwert. Besonders für die Zweitlinientherapie bestehen zum jetzigen Zeitpunkt keine Therapieempfehlungen. Frühere Studien hatten bereits Everolimus, Etoposid und Pemetrexed untersucht, ohne einen entscheidenden Vorteil zeigen zu können.32–34
Nun konnte die PECATI-Studie potenziell wegweisende Resultate berichten.35In der einarmigen Phase-II-Studie wurden die Wirksamkeit und Sicherheit von Lenvantinib (20mg p.o. täglich) in Kombination mit dem Anti-PD-1-Antikörper Pembrolizumab (200mg i.v. alle 3 Wochen) bei Patient:innen mit fortgeschrittenem B3-Thymom, die bereits mindestens eine platinbasierte Chemotherapie erhalten hatten, untersucht. 45 Patient:innen wurden eingeschlossen. Die Metastasenlast in der Kohorte war hoch; 54% der Studienteilnehmer:innen wiesen Metastasen an drei oder mehr Lokalisationen auf. Es zeigte sich eine ORR von 23,3%, wobei es sich nur um ein partielles Ansprechen handelte, eine komplette Remission wurde nicht erreicht. Das PFS nach fünf Monaten lag bei 91%, nach einem Jahr bei 62%. Das Gesamtüberleben nach einem Jahr betrug 85%.
Höhergradige (≥Grad 3) therapieassoziierte Nebenwirkungen traten in 39% auf, die häufigsten waren Durchfall (7%), Hypertonie (7%) und Lebertoxizität (5%). 16% aller Patient:innen erlitten eine schwere therapieassoziierte Nebenwirkung, je ein Patient Myokarditis und Pneumonitis. Zusammengefasst zeigt die PECATI-Studie mit der Kombination von Lenvantinib + Pembrolizumab eine mögliche Therapieoption für das vorbehandelte, fortgeschrittene B3-Thymom. Die Rate an Nebenwirkungen überstieg das erwartete Ausmass nicht, es empfiehlt sich jedoch eine enge Überwachung.
Literatur:
1 Horn L et al.: First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379(23): 2220-9 2 Paz-Ares L et al.: Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394(10212): 1929-39 3 Peters S et al.: Consolidation nivolumab and ipilimumab versus observation in limited-disease small-cell lung cancer after chemo-radiotherapy - results from the randomised phase II ETOP/IFCT 4-12 STIMULI trial. Ann Oncol 2022; 33(1): 67-79 4 Cheng Y et al.: Durvalumab after chemoradiotherapy in limited-stage small-cell lung cancer. N Engl J Med 2024; 391(14): 1313-27 5 Senan S et al.: Durvalumab (D) as consolidation therapy in limited-stage SCLC (LS-SCLC): outcomes by prior concurrent chemoradiotherapy (cCRT) regimen and prophylactic cranial irradiation (PCI) use in the ADRIATIC trial. Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/durvalumab-d-as-consolidation-therapy-in-limited-stage-sclc-ls-sclc-outcomes-by-prior-concurrent-chemoradiotherapy-ccrt-regimen-and-prophyla 6 Antonia SJ et al.: Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017; 377(20): 1919-29 7 Heymach JV et al.: Perioperative durvalumab for resectable non-small-cell lung cancer. N Engl J Med 2023; 389(18): 1672-84 8 Felip E et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021; 398(10308): 1344-57 9 O’Brien M et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 2022; 23(10): 1274-86 10 Goss G et al.: A global, double-blind placebo-controlled, randomized phase III study of adjuvant durvalumab in completely resected non-small cell lung cancer (NSCLC). Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/cctg-br.31-a-global-double-blind-placebo-controlled-randomized-phase-iii-study-of-adjuvant-durvalumab-in-completely-resected-non-small-cell-lung 11 Omori S et al.: A phase III study comparing weekly carboplatin plus nab-paclitaxel and daily low-dose carboplatin for concurrent chemoradiotherapy in elderly patients (≥75 years) with unresectable locally advanced NSCLC: JCOG1914. Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/a-phase-iii-study-comparing-weekly-carboplatin-plus-nab-paclitaxel-and-daily-low-dose-carboplatin-for-concurrent-chemoradiotherapy-in-elderly-patie 12 Garassino MC et al.: Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the phase 3 KEYNOTE-189 study. JClin Oncol 2023; 41(11): 1992-8 13 Reck M et al.: Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016; 375(19): 1823-33 14 van den Heuvel M et al.: Low dose versus standard dose pembrolizumab for treatment of stage IV stage non-small cell lung carcinoma: results of the pre-planned interim analysis of the NVALT-30 clinical trial. Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/low-dose-versus-standard-dose-pembrolizumab-for-treatment-of-stage-iv-stage-non-small-cell-lung-carcinoma-results-of-the-pre-planned-interim-analy 15 Huang H: Anaplastic lymphoma kinase (ALK) receptor tyrosine kinase: a catalytic receptor with many faces. Int J Mol Sci 2018; 19(11): 3448 16 Peng L et al.: Targeting ALK rearrangements in NSCLC: current state of the art. Front Oncol 2022; 12: 863461 17 Soda M et al.: Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer. Nature 2007; 448(7153): 561-6 18 Koivunen JP et al.: EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res 2008; 14(13): 4275-83 19 Bearz A et al.: Efficacy of lorlatinib in treatment-naive patients with ALK-positive advanced NSCLC in relation to EML4::ALK variant type and ALK with or without TP53 mutations. J Thorac Oncol 2023; 18(11): 1581-93 20 Solomon BJ et al.: Lorlatinib versus crizotinib in patients with advanced ALK-positive non-small cell lung cancer: 5-year outcomes from the phase III CROWN study. JClin Oncol 2024; 42(29): 3400-9 21 Drilon AE et al.: Phase I/II ALKOVE-1 study of NVL-655 in ALK-positive (ALK+) solid tumours. Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/phase-i-ii-alkove-1-study-of-nvl-655-in-alk-positive-alk-solid-tumours 22 Ahn MJ et al.: Datopotamab deruxtecan versus docetaxel for previously treated advanced or metastatic non-small cell lung cancer: the randomized, open-label phase III TROPION-Lung01 study. J Clin Oncol 2024; JCO2401544 23 Shimizu T et al.: First-in-human, phase I dose-escalation and dose-expansion study of trophoblast cell-surface antigen 2-directed antibody-drug conjugate datopotamab deruxtecan in non-small-cell lung cancer: TROPION-PanTumor01. J Clin Oncol 2023; 41(29): 4678-87 24 Garassino MC: Normalized membrane ratio of TROP2 by quantitative continuous scoring is predictive of clinical outcomes in TROPION-Lung 01. Available from: https://wclc2024.iaslc.org/wp-content/uploads/2024/09/WCLC-2024-Full-Conference-Abstract-Book.pdf 25 Tawbi HA et al.: Relatlimab and nivolumab versus nivolumab in untreated advanced melanoma. N Engl J Med 2022; 386(1): 24-34 26 Long GV et al.: Overall survival and response with nivolumab and relatlimab in advanced melanoma. NEJM Evid 2023; 2(4): EVIDoa2200239 27 Girard N et al.: Nivolumab (NIVO) plus relatlimab with platinum-doublet chemotherapy (PDCT) vs NIVO + PDCT as first-line (1L) treatment (tx) for stage IV or recurrent NSCLC: results from the randomized phase II RELATIVITY-104 study. Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/nivolumab-nivo-plus-relatlimab-with-platinum-doublet-chemotherapy-pdct-vs-nivo-pdct-as-first-line-1l-treatment-tx-for-stage-iv-or-recurre 28 Spigel DR et al.: Interim analysis of GALAXIES Lung-201: phase II, randomized, open-label platform study of belrestotug plus dostarlimab in patients (pts) with previously untreated locally advanced/metastatic (LA/M) PD-L1 high (TPS >/=50%) non-small cell lung cancer (NSCLC). Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/interim-analysis-of-galaxies-lung-201-phase-ii-randomized-open-label-platform-study-of-belrestotug-plus-dostarlimab-in-patients-pts-with-previ 29 Shepherd FA et al.: Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 2000; 18(10): 2095-103 30 Feinstein TM et al.: Plinabulin/docetaxel versus docetaxel in survival benefits of 2L/3L EGFR wild-type NSCLC after platinum regimens (DUBLIN-3): A randomized phase III trial. Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/plinabulin-docetaxel-versus-docetaxel-in-survival-benefits-of-2l-3l-egfr-wild-type-nsclc-after-platinum-regimens-dublin-3-a-randomized-phase-iii 31 Engels EA: Epidemiology of thymoma and associated malignancies. J Thorac Oncol 2010; 5(10 Suppl 4): S260-65 32 Zucali PA et al.: Phase II study of everolimus in patients with thymoma and thymic carcinoma previously treated with cisplatin-based chemotherapy. J Clin Oncol 2018; 36(4): 342-9 33 Bluthgen MV et al.: Activity and safety of oral etoposide in pretreated patients with metastatic or recurrent thymic epithelial tumors (TET): a single-institution experience. Lung Cancer 2016; 99: 111-6 34 Gbolahan OB et al.: A phase II study of pemetrexed in patients with recurrent thymoma and thymic carcinoma. J Thorac Oncol 2018; 13(12): 1940-8 35 Remon Masip J et al.: A phase II trial to evaluate the efficacy and safety of lenvatinib in combination with pembrolizumab in pretreated advanced B3-thymoma and thymic carcinoma. Available from: https://oncologypro.esmo.org/meeting-resources/esmo-congress-2024/pecati-a-phase-ii-trial-to-evaluate-the-efficacy-and-safety-of-lenvatinib-in-combination-with-pembrolizumab-in-pretreated-advanced-b3-thymoma-and