Medikamentöse Therapie bei Morbus Wilson
Autor:
Prof. DDr. h.c. Peter Ferenci
Universitätsklinik für Innere Medizin III Gastroenterologie und Hepatologie
Medizinische Universität Wien
E-Mail: peter.ferenci@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bis heute gilt eine lebenslange medikamentöse Therapie als Standard bei Morbus Wilson. Die Wahl des jeweiligen Medikamentes beruht auf der Verfügbarkeit, dem Preis und vorwiegend auf der Privatmeinung des behandelnden Arztes. Keines der verwendeten Medikamente wurde in kontrollierten Studien getestet und/oder mit anderen verglichen. Daher können für die Therapiewahl nicht allein die Prinzipien der evidenzbasierten Medizin angewendet werden.
Keypoints
-
Kontrollierte Vergleichsstudien der Substanzen zur Behandlung des M. Wilson fehlen.
-
D-Penicillamin gilt als Goldstandard der M.-Wilson-Therapie, ist jedoch mit einigen Nebenwirkungen (u.a. Störung der Kollagen- und Elastinbildung bei Langzeitgebrauch) verbunden.
-
Trientin ist ebenso effektiv wie D-Penicillamin und besser verträglich, in der EU allerdings nur als Zweitlinientherapie zugelassen.
-
Zink und Tetrathiomolybdat eignen sich ebenfalls zur Therapie des M. Wilson.
Gemäß den von der US-amerikanischen (AASLD)1, 2und der europäischen Lebergesellschaft (EASL)3erarbeiteten Praxisrichtlinien sollte die initiale Therapie für symptomatische Wilsonpatienten einen Kupferchelator (D-Penicillamin oder Trientin) beinhalten. Zur Behandlung präsymptomatischer Patienten oder zur Erhaltungstherapie erfolgreich behandelter symptomatischer Patienten kann ein Chelator oder Zink gegeben werden. Eine Lebertransplantation ist nur beim fulminanten M. Wilson und bei therapierefraktären Fällen indiziert.
Derzeit zur Therapie des M. Wilson verwendete Medikamente
D-Penicillamin
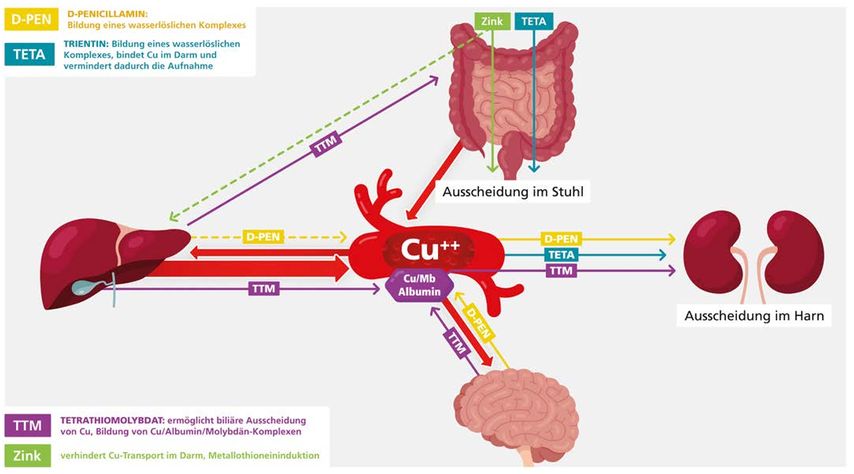
D-Penicillamin gilt nach wie vor als „Goldstandard“ der Therapie des M. Wilson. D-Penicillamin hat eine höhere Kupferbindungsaffinität als Albumin. Dadurch wird Kupfer an das Medikament gebunden. Das so mobilisierte Kupfer wird dann im Urin ausgeschieden (Abb. 1). Die meisten symptomatischen Patienten (sowohl mit hepatischer als auch neurologischer Präsentation) sprechen innerhalb weniger Monate auf die Therapie an. Bei neurologischen Patienten kann es, besonders wenn die volle Dosis von D-Penicillamin von Anfang an gegeben wird, zu einer initialen Verschlechterung der neurologischen Symptomatik kommen. Die übliche Dosis beträgt 1 bis 1,5g/Tag. Wir bevorzugen eine schrittweise Dosissteigerung – beginnend mit 500mg/Tag – in wöchentlichen Schritten von zusätzlichen 250mg/Tag bis zur Erreichung der Volldosis. Sobald es zu einer stabilen klinischen Besserung kommt (meist nach 1–2-jähriger Therapie), kann die Dosis auf 0,5 bis 1g/Tag reduziert werden. Zu Therapiebeginn führt D-Penicillamin zu einem starken Anstieg der Kupriurese, die im Laufe der Zeit wieder absinkt und dann oft unter 500µg/Tag liegt. Da D-Penicillamin zu einem Mangel an Pyridoxin (Vitamin B6) führen kann, ist eine Dauersubstitution mit 50mg/Woche notwendig. Das Hauptproblem der Therapie mit D-Penicillamin ist die doch beträchtliche Toxizität.
Nebenwirkungen von D-Penicillamin
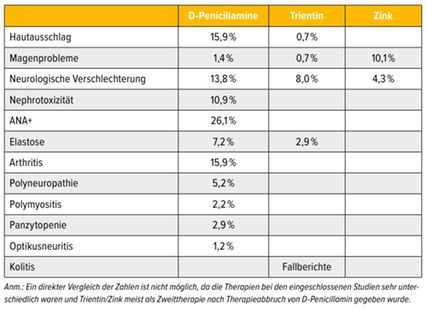
Tab. 1: Häufigkeit der Nebenwirkungen bei der Therapie des M. Wilson. Resultate einer Metaanalyse von 23 Studien mit insgesamt über 2055 Patienten (modifiziert nach Appenzeller-Herzog C et al. 2019)4
Es gibt zwei wesentliche Formen der D-Penicillamin-bedingten Nebenwirkungen: eine direkte, dosisabhängige Toxizität sowie eine immunologisch hervorgerufene. Die meisten Probleme sind in Fallberichten beschrieben, die genaue Häufigkeit einzelner Nebenwirkungen ist nicht bekannt. Eine Metaanalyse(siehe Tab. 1) verglich die Wirkungen und Nebenwirkungen von D-Penicillamin bei über 2055 Patienten (in 23 Studien) meistens mit keiner Behandlung (n=4), Zink (n=12), Trientin (n=7).4 Nur eine der Studien war prospektiv randomisiert (mit kleiner Fallzahl und Dauer von nur 12 Wochen), 20 waren retrospektiv und 11 der Studien von geringer Qualität. Eine Studie verglich Tetrathiomolybdat und Trientin. Die Erhaltungstherapie nach der „Entkupferung“ wurde nur in einer Studie behandelt. Mit allen Therapien waren Mortalität und Prävention oder Besserung klinischer Symptome ähnlich. Umgekehrt war D-Penicillamin im Vergleich mit Trientin wesentlich häufiger mit Nebenwirkungen und Behandlungsabbrüchen assoziiert. Bei etwa 20% der Patienten musste die Therapie wegen starker Nebenwirkungen geändert werden.5
Störungen der Kollagen- und Elastinbildung treten erst nach jahrlanger Behandlung mit D-Penicillamin auf. Elastin ist ein extrazelluläres Matrixprotein mit hoher funktioneller Bedeutung in zahlreichen Geweben wie der Haut, der Arterienwand und der Bronchien. Die Bildung von Elastin beginnt bereits vor der Geburt und wird nur in den ersten Lebensjahren fortgesetzt. Elastin hat eine Halbwertszeit von mehr als 70 Jahren.6 In Verbindung mit seinem langsamen Umsatz sammelt Elastin jedoch alters- und krankheitsbedingte Schäden an, die zu einem Versagen von elastinreichen Geweben führen können. Nebst vielen anderen Mechanismen können Medikamente wie z.B. D-Penicillamin den Elastinabbau stören. Da M.-Wilson-Patienten D-Penicillamin lebenslang einnehmen müssen, sind Störungen von elastischen Fasern zu erwarten. Histologisch sind die Veränderungen bereits nach einjähriger Therapie zu sehen. (Anm.: Vor über 20 Jahren haben wir mit Prof. Klaus Konrad[†] bei 10 Patienten vor Therapiebeginn und ein Jahr später eine Hautbiopsie gemacht. Leider wurden diese Daten nach dem Unfalltod von Prof. Konrad nie publiziert.) Klinisch symptomatisch werden Hautveränderungen frühestens nach fünf Jahren. Sie umfassen frühe Faltenbildung, Cutis laxa und in der schwersten Form die Elastosis perforans serpiginosa, die sich bei 1–8% der Patienten findet. Bei dieser seltenen Hauterkrankung gehen abnorme elastische Fasern von der Papillarschicht in die Epidermis über und präsentieren sich als Ansammlung kleiner rötlicher Beulen, die oft in linearen, kreisförmigen oder serpiginösen Mustern gruppiert sind.
Der Mechanismus für die Störung des Elastinumbaus durch Penicillamin ist nicht gut erforscht. Ein möglicher Mechanismus könnte die Penicillamin-verursachte Kupferverminderung im Bindegewebe sein.7 Kupfer wird zur Synthese des kupferabhängigen Enzyms Lysyloxidase benötigt, welche für die Vernetzung von elastischen und kollagenen Fasern in der Dermis benötigt wird. Ein weiterer Mechanismus ist die direkte medikamentöse Hemmung der Desaminierung der für die Elastinreifung notwendigen Lysinreste.8
Trientin
Trientin ist ein Kupferchelator, der primär die Ausscheidung von Kupfer steigert. Trientin ist zur Therapie des M. Wilson zugelassen und ist ebenso effektiv wie D-Penicillamin, aber mit weniger Nebenwirkungen verbunden. Es gibt allerdings keine direkten Vergleichsstudien, insbesondere nicht zur Ersttherapie. Fallberichte und eigene Erfahrungen zeigen jedoch, dass Trientin eine akzeptable Ersttherapie für M. Wilson ist. Initial scheint Trientin mehr Kupfer mobilisieren zu können als D-Penicillamin, die Kupriurese nimmt aber viel schneller ab als unter D-Penicillamin. Die Trientin-induzierte Kupriurese ist allerdings ausreichend, um die Patienten stabil zu halten.
Die Pharmakokinetik von Trientin wurde nur bei sehr wenigen Patienten untersucht.9 Auffallend ist die sehr variable Bioverfügbarkeit von Trientin, die sich interindividuell um den Faktor 6 ändern kann. Die Aufnahme von Trientin wird stark vom Zeitpunkt der Nahrungsaufnahme beeinflusst. Dies ist kein wirklicher Nachteil: Wenn Trientin nicht resorbiert wird, kann es Cu im Darm binden und mit dem Stuhl ausgeschieden werden (Abb. 1). Das ist möglicherweise ein Grund für die niedrigere Harnkupferausscheidung im Vergleich zu D-Penicillamin. Hohe Trientin-Konzentrationen im Stuhl könnten die Trientin-induzierte Enterokolitis erklären.10, 11 Ein relativer Kupfermangel im hämopoetischen System kann zur mikrozytären Anämie (Trientin, Zink) führen.
Neuer Wirkmechanismus von Trientin – Verstärkung der Autophagie
Kürzlich wurde eine neue Wirkung von Trientin beschrieben, die zur Vermeidung einer vorzeitigen Hautalterung bei M.-Wilson-Patienten beitragen könnte.12
Experimentell zeigen ATP7B-Knockout-Zellen nach Cu++-Exposition im Vergleich zu Wildtypzellen einen signifikanten Anstieg der Expression von 103 Genen, die die Autophagie regulieren. Hepatozyten in Lebergeweben von Patienten mit M. Wilson und von ATP7B-Knockout-Mäusen und Ratten (aber nicht Kontrollen) hatten mehrere Autophagosomen. Pharmakologische Inhibitoren der Autophagie oder des Knockdowns der Autophagieproteine ATG7 und ATG13 induzierten und beschleunigten den Tod von ATP7B-Knockout-HepG2-Zellen im Vergleich zu Wildtypzellen. Autophagie schützte ATP7B-Knockout-Zellen vor kupferinduziertem Tod.13 Trientin verstärkt die Autophagie, einen zellulären Prozess, der für die allgemeine Zellaktivität von Proteinen sowie die Funktion der Mitochondrien entscheidend ist.14
Tierexperimentell scheint die Erhöhung des Spermidins in der Nahrung lebensverlängernd zu sein und Alterungsprozesse zu verlangsamen.15 Daher wird es in der alternativen Szene als „Jungbrunnen“ empfohlen. Die Rolle von Spermidin in der Humanmedizin, insbesondere bei M. Wilson, ist weitgehend unerforscht. Azetylierung durch die Spermidin/Spermin-N1-Acetyltransferase (SAT1) erhöht die intrazelluläre Konzentration von Spermidin. Trientin ist wie Spermidin ein Polyamin, welchem eine wichtige Rolle im Stoffwechsel, insbesondere im Alter, zukommt. Trientin aktiviert SAT1, was dafür spricht, dass SAT1 ein weiteres Hauptziel von Trientin ist.12
Zink
Zink interferiert mit der intestinalen Kupferabsorption: Kupfer und Zink werden über den gleichen Carrier aus dem Darm aufgenommen, eine Vorbehandlung mit Zink blockiert daher diesen Carrier für den Kupfertransport (Abb. 1).16 Darüber hinaus induziert Zink die Bildung von Metallothionein, welches intrazellulär Metalle bindet.17 Metallothionein-gebundenes Zink wird durch Abschilferung von Enterozyten im Stuhl ausgeschieden. Die fäkale Kupferausscheidung steigt unter Zinktherapie. Durch Induktion von Metallothionein ermöglicht Zink eine nichttoxische Kupferspeicherung in Hepatozyten.
Daten über die Wirksamkeit von Zink stammen von unkontrollierten Studien, in denen unterschiedliche Zinkpräparationen (Zinksulfat, Zinkazetat) mit unterschiedlichen Dosen (75–250mg/d) verwendet wurden.18
Bei symptomatischen Patienten, die D-Penicillamin nicht vertrugen, besserten sich die hepatischen bzw. neurologischen Symptome nach Umstellung auf Zink. Die Therapie war meist gleich effektiv, einige Patienten mit hepatischer Präsentation verschlechterten sich aber unter der Behandlung mit Zink.19
Tetrathiomolybdat
Dieses Medikament hat zwei Wirkmechanismen: Einerseits komplexiert es mit Kupfer bereits im Gastrointestinaltrakt20 und verhindert damit die Kupferresorption21, andererseits bildet es im Blut einen Komplex mit Kupfer und Albumin und verhindert die Aufnahme von Kupfer in die Zellen (Abb. 1). In niedrigeren Dosen entfernt Ammonium-Tetrathiomolybdat (TTM) Kupfer aus Metallothionein, höhere Dosen führen jedoch zu unlöslichen Kupferkomplexen, die in der Leber abgelagert werden, was möglicherweise die Hepatotoxizität von Ammonium-TTM erklärt.22
Die Resultate der Phase-II-Studie mit Bis-cholin-TTM waren vielversprechend.23 Das Medikament wird derzeit in einer prospektiven, randomisiert-kontrollierten Phase-III-Studie untersucht.24
Ist es egal, welcher Chelator gegeben wird?
Wenn man bedenkt, dass D-Penicillamin seit 195625 und Trientin seit 198626 verwendet wird, ist diese Frage überraschend. Der Hauptgrund für die Bevorzugung von D-Penicillamin ist ein banaler: Trientin wurde zur Behandlung von Patienten entwickelt, die auf D-Penicillamin schwere Nebenwirkungen hatten, und ist daher in der EU noch immer nur als Zweittherapie des M. Wilson zugelassen.27
Sicherlich ein weiterer Grund sind die nicht erklärbaren Preisunterschiede.28 Rein medizinisch gesehen ist es 2022 kaum verständlich, warum bei gleicher Effizienz das besser verträgliche Präparat nicht zur Ersttherapie verwendet werden kann.
Viele Unterschiede im Wirkspektrum könnten das unterschiedliche Nebenwirkungsprofil erklären. Bereits in den ersten Untersuchungen zum Mechanismus der Kupriurese durch die zwei Chelatorenzeigten sich deutliche Unterschiede.29, 30 Die unterschiedliche Kinetik von 64Cu im Radiokupfertest weist darauf hin, dass diese beiden Chelatbildner Kupfer aus verschiedene Kompartments mobilisieren können. Ähnlich sind frühe In-vitro-Daten: Trientin bildet mit Kupfer einen kleinen molekularen Komplex, wohingegen der Kupfer-D-Penicillamin-Komplex von polymerer Natur ist. Trientin konkurriert effektiv um Albumin-gebundenes Kupfer im Blut, während D-Penicillamin in dieser Hinsicht schlechter funktioniert.
Literatur:
1 Roberts EA, Schilsky ML: AASLD practice guidelines: a practice guideline on Wilson disease. Hepatology 2003; 37: 1475-92 2 Saroli Palumbo C, Schilsky ML: Clinical practice guidelines in Wilson disease. Ann Transl Med 2019; 7(Suppl 2): S65 3 EASL Clinical Practice Guidelines: Wilsonʼs disease. J Hepatol 2012; 56: 671-85 4 Appenzeller-Herzog C et al.: Comparative effectiveness of common therapies for Wilson disease: a systematic review and meta-analysis of controlled studies. Liver Int 2019; 39: 2136-52 5 Seessle J et al.: Concomitant immune-related events in Wilson disease: implications for monitoring chelator therapy. J Inherit Metab Dis 2016; 39: 125-30 6 Le Page A et al.: The role of elastin-derived peptides in human physiology and diseases. Matrix Biol 2019; 84: 81-96 7 Lewis BK et al.: Penicillamine-induced elastosis of the mucosal lip. J Am Acad Dermatol 2009; 60: 700-3 8 Light N et al.: Collagen and elastin changes in D-penicillamine-induced pseudoxanthoma elasticum-like skin. Br J Dermatol 1986; 114:381-8 9 Pfeiffenberger J et al.: The steady state pharmacokinetics of trientine in Wilson disease patients. Eur J Clin Pharmacol 2018; 74: 731-6 10 Boga S et al.:Trientine induced colitis during therapy for Wilson disease: a case report and review of the literature. BMC Pharmacol Toxicol 2015; 16: 30 11 Mayr T et al.: Optimized trientine-dihydrochloride therapy in pediatric patients with Wilson disease: Is weight-based dosing justified? J Pediatr Gastroenterol Nutr 2021; 72: 115-22 12 Pietrocola F et al.: Triethylenetetramine (trientine): a caloric restriction mimetic with a new mode of action. Autophagy 2020; 16: 1534-6 13 Polishchuk EV et al.: Activation of autophagy, observed in liver tissues from patients with Wilson disease and from ATP7B-deficient animals, protects hepatocytes from copper-induced apoptosis. Gastroenterology 2019; 156: 1173-89 14 Pietrocola F et al.: Extending the mode of action of triethylenetetramine (trientine): autophagy besides copper chelation. J Hepatol 2020; 73: 970-2 15 Breisenberg T et al.: Induction of autophagy by spermidine promotes longevity. Nat Cell Biol 2009; 11: 1305-14 16 Condomina J et al.: Kinetics of zinc transport in vitro in rat small intestine and colon: interaction with copper. Eur J Pharm Sci 2002; 16: 289-95 17 Yuzbasiyan-Gurkan V et al.: Treatment of Wilsonʼs disease with zinc: X. Intestinal metallothionein induction. J Lab Clin Med 1992; 120: 380-6 18 Ferenci P: Zinc treatment of Wilsonʼs disease. In: Zinc and Diseases of the Digestive Tract. Kruse-Jarres JD, Schölmerich J (eds). Lancaster: Kluwer Academic Publishers, 1997. 117-24 19 Weiss KH et al.: Zinc monotherapy is not as effective as chelating agents in treatment of Wilson disease. Gastroenterology 2011; 140: 1189-98 20 Alvarez HM et al.: Tetrathiomolybdate inhibits copper trafficking proteins through metal cluster formation. Science 2010; 327: 331-4 21 Brewer GJ et al.: Treatment of Wilson’s disease with ammonium tetrathiomolybdate: I. Initial therapy in 17 neurologically affected patients. Arch Neurol 1994; 51: 545-54 22 Ogra Y, Suzuki KT: Targeting of tetrathiomolybdate on the copper accumulating in the liver of LEC rats. J Inorg Biochem 1998; 70: 49-55 23 Weiss KH et al.: Bis-choline tetrathiomolybdate in patients with Wilson’s disease: an open-label, multicentre, phase 2 study. Lancet Gastroenterol Hepatol 2017; 2: 869-76 24 Weiss KH et al.: Efficacy and safety of ALXN1840 versus standard of care in Wilson disease: primary results from an ongoing phase 3, randomized, controlled, rater-blinded trial. J Hepatol 2022; 77( Suppl-1): S1 25 Walshe JM: Penicillamine, a new oral therapy for Wilson’s disease. Am J Med 1956; 21: 487-95 26 Walshe JM: Treatment of Wilsonʼs disease with trientine (triethylene tetramine) dihydrochloride. Lancet 1982; 1(8273): 643-7 27 Scheinberg IH et al.: The use of trientine in preventing the effects of interrupting penicillamine therapy in Wilson’s disease. N Engl J Med 1987; 23(317): 209-13 28 Schilsky ML et al.: Costly choices for treating Wilsonʼs disease. Hepatology 2015; 61: 1106-8 29 Walshe JM: Copper chelation in patients with Wilson’s disease - a comparison of penicillamine and triethylene tetramine dihydrochloride. QJMed: an International Journal of Medicine 1973; 42: 441-52 30 Říha M et al.: Novel method for rapid copper chelation assessment confirmed low affinity of D-penicillamine for copper in comparison with trientine and 8-hydroxyquinolines. J Inorg Biochem 2013; 123: 80-7
Das könnte Sie auch interessieren:
Konsensuspapier zur metabolisch bedingten steatotischen Lebererkrankung
Bei der ÖGGH-Jahrestagung präsentierten Ap. Prof. Priv.-Doz. DDr. Mattias Mandorfer und DDr. Georg Semmler, Klinische Abteilung für Gastroenterologie und Hepatologie an der MedUni Wien, ...
UEGW 2025: Neues aus der Hepatologie
In der Indikation metabolisch bedingte Lebersteatose bzw. Steatohepatitis scheiterten über viele Jahre zahlreiche Therapieversuche. Seit Kurzem stehen erstmals wirksame und zugelassene ...
Lebersteatose und Fibrose: unerwartete Prävalenzverteilungen und Aussagekraft moderner Diagnostik
Eine aktuelle österreichische Studie untersuchte die Prävalenz von hepatischer Steatose und Fibrose in fünf österreichischen Versorgungseinheiten. Zudem wurden in diesem Zusammenhang ...