Akute Pulmonalembolie: Therapieentscheidung zwischen Nutzen und Blutungsrisiko?
Autorin:
OÄ Dr. Karin Janata-Schwatczek
Universitätsklinik für Notfallmedizin
Medizinische Universität Wien
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der Therapie der akuten Pulmonalembolie (PE) ist es entscheidend, in jedem Einzelfall den Nutzen der gewählten Therapie gegen das Blutungsrisiko abzuwägen. Im Extremfall muss man sich also zwischen dem Risiko des Patienten, an der akuten PE, und dem Risiko, an einer intrazerebralen Blutung zu versterben, entscheiden – eine Wahl zwischen Skylla und Charybdis. Diese Übersicht hilft dabei.
Keypoints
-
Die Therapie der akuten Pulmonalembolie orientiert sich am individuellen Mortalitäts-/Rezidivrisiko sowie am patientenbezogenen und therapieassoziierten Blutungsrisiko.
-
Ein lokales PERT-Team kann in der Therapieentscheidung helfen.
Ein heterogenes klinisches Erscheinungsbild und eine limitierte Anzahl kontrollierter Studien stellen uns bei der Behandlung von Patienten mit akuter Pulmonalembolie (PE) oftmals vor Herausforderungen. Das Therapieziel besteht meist in einer (indirekten) Auflösung der Thromben sowie dem Verhindern von Thrombenprogression und Rezidiven, was durch Heparine und orale Antikoagulanzien erfolgt.
Im Falle einer bestehenden oder drohenden hämodynamischen Instabilität kann eine zusätzliche direkte Reduktion der Thrombuslast lebensrettend sein. Als direkte Reperfusionsmaßnahmen stehen eine systemische Thrombolyse (STL), Katheterverfahren (CDT +/– lokaler Thrombolyse) sowie perkutan interventionelle bzw. chirurgische Embolektomieverfahren zur Verfügung. Bei allen Therapieformen können Komplikationen, im Besonderen Blutungen, auftreten. Es ist daher entscheidend, in jedem Einzelfall den Nutzen der gewählten Therapie gegen das Blutungsrisiko abzuwägen. Im Extremfall bedeutet dies, zwischen dem Risiko, an der akuten PE, und dem Risiko, an einer intrazerebralen Blutung zu versterben, zu entscheiden.
PE-assoziierte Mortalität
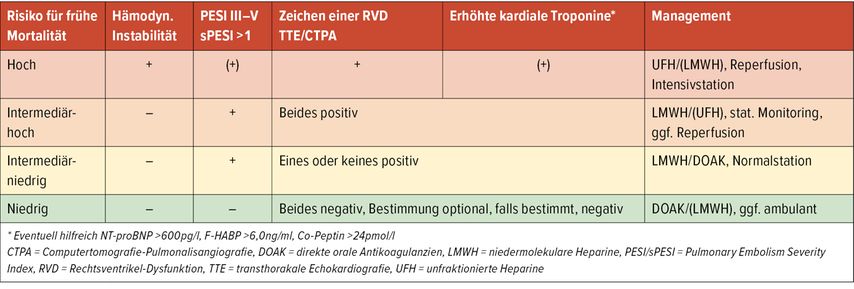
Die initiale Abschätzung von Krankheitsverlauf und individuellem Mortalitätsrisiko ist von entscheidender Bedeutung für das Patientenmanagement. Beurteilung von Hämodynamik sowie Beeinträchtigung des rechten Ventrikels im Sinne einer Dysfunktion (RVD) bzw. Myokardschadens sind die Eckpfeiler dieser Risikostratifizierung. Alter und Komorbiditäten limitieren die individuellen Kompensationsmechanismen zusätzlich.
Risikogruppen
In den Leitlinien der European Society of Cardiology (ESC) wird anhand dieser Parameter zwischen Niedrig-, Intermediär- (niedrig/hoch) und Hochrisiko-PE differenziert. Der Pulmonary Embolism Severity Index (PESI/sPESI) hilft, vor allem Patienten in der Niedrigrisikogruppe zu identifizieren, welche infolge einer niedrigen 30-Tage-Mortalität (1%) auch ambulant behandelt werden könnten (Tab. 1).1
Bei hämodynamischer Instabilität, definiert als Reanimation/obstruktiver Schock (RRsys <90mmHg oder Vasopressorbedarf und Endorganminderperfusion)/oder persistierende Hypotonie (RRsys <90mmHg bzw. Abfall >40mmHg in >15min), sterben >60% der Betroffenen, rasche Reperfusionsmaßnahmen erhöhen die Überlebenschancen.
Bei normotensiven Patienten ist infolge eines günstigen Verlaufs zumeist eine alleinige Antikoagulation ausreichend.
Die Therapie von Intermediärrisiko-Patienten (früher submassive PE) wird kontrovers diskutiert. Die Mortalität liegt bei diesen zwischen 2,9% und 14,7%. Ca. 5% der Patienten dekompensieren im Verlauf. Das Bestreben ist, Patienten mit hoher Wahrscheinlichkeit für diese klinische Verschlechterung zu identifizieren, um rechtzeitig Reperfusionsmaßnahmen durchzuführen. In den europäischen Leitlinien wird daher zwischen Intermediär-/Hochrisiko (RVD und Myokardschaden) und Intermediär-/Niedrigrisiko (RVD oder Ischämiemarker und/oder klinisches Risiko) differenziert. Zusätzlich zu RVD und Myokardschaden werden ein erhöhter Schock-Index, Synkope, schwere Hypoxämie, ausgeprägte Rechtsherzbelastung, signifikante Tachykardie, Laktaterhöhung als Risikomarker diskutiert. Diverse klinische Parameter kombiniert mit Biomarkern +/– Bildgebung sollen die „Treffsicherheit“ hinsichtlich Verlaufsprognose verbessern. Keiner dieser „Scores“ erweist sich als signifikant überlegen oder hoch prädiktiv.2–5 Der klinische Zustand der Patienten kann sich rasch verändern, Monitoring und regelmäßige klinische Reevaluation sind daher entscheidend.
Blutungsrisiko
Gleichzeitig zur Risikoevaluierung für einen komplizierten Verlauf muss das Blutungsrisiko evaluiert werden. Dieses hängt von bestehenden Risikofaktoren, der gewählten Therapie und deren Dauer ab. Der klare Benefit einer Antikoagulation ist unbestritten. Sie ist die First-Line-Therapie für die Mehrzahl aller PE-Patienten, wenn keine absoluten Kontraindikationen vorliegen.
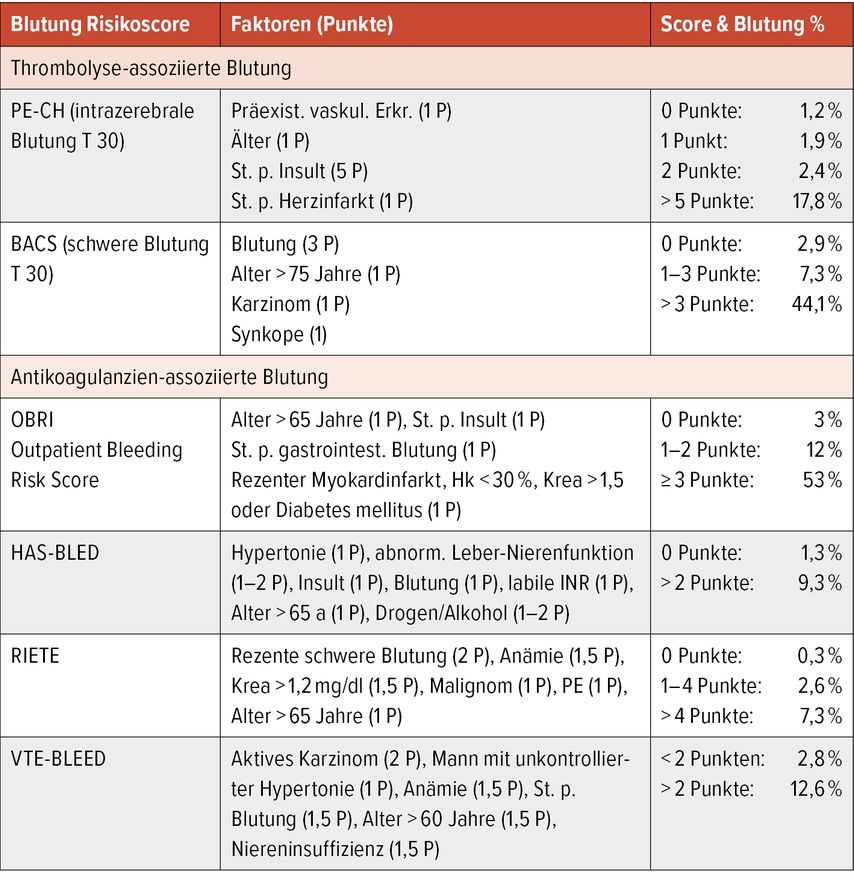
Rezidivembolien sowie Blutungskomplikationen treten überwiegend innerhalb der ersten Tage bzw. Wochen nach Therapiebeginn auf. Fatale Blutungen sind unter Antikoagulation dreimal häufiger als fatale PE-Rezidive. Die Blutungsinzidenz unter Antikoagulation beträgt 7,22 pro 100 Patientenjahre, mit einer Mortalität bis zu 20%, es ist daher entscheidend, Patienten mit Risiko für schwere Blutungen zu identifizieren. Hierzu wurden PE-spezifische Risikoscores bzw. jene für Vorhofflimmern untersucht.
Klok et al. analysierten die Vorhersagekraft fünf verschiedener Scores hinsichtlich schwerer Blutungskomplikationen innerhalb von 30 Tagen bei 448 Patienten mit PE. Kein Score hatte eine ausreichende Vorhersagekraft, weder PE-spezifische noch für Vorhofflimmern validierte.6
Das Blutungsrisiko ist bei einem Alter >65 a, Einnahme von Thombozytenaggregationshemmern, eingeschränkter Nierenfunktion, Blutungsanamnese und Anämie erhöht. Die Reperfusionstherapie mittels STL gibt Anlass für Studien und Kontroversen, die Angst vor Blutungskomplikationen hält ihren Einsatz in Grenzen. Vor jeglicher Lysetherapie müssen absolute und relative Kontraindikationen identifiziert werden, welche Faktoren in der Entscheidung zum Tragen kommen, hängt von der Dringlichkeit der Akutsituation ab, wodurch sich Kontraindikationen relativieren können (Tab. 2).1 Es ist anzunehmen, dass in Zukunft „sicherere“ Reperfusionsregime wie reduzierte STL und CDT eine bevorzugte Therapieoption darstellen. Tabelle 3 gibt eine Auswahl von Risikoscores für Thrombolyse-/Antikoagulanzien-assoziierte Blutungen.4,6
Tab. 3: Blutungsscores für Thrombolyse und Antikoagulanzien (modifiziert nach Triantafyllou G et al.4 und Klok F et al.6)
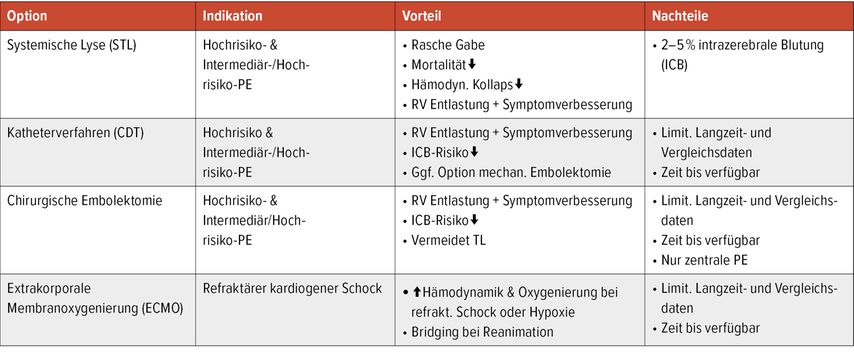
Therapieoptionen bei instabilen Patienten
Thrombolysetherapie
Studien und Metaanalysen zeigen für diese Situation trotz mäßiger Evidenz einen Benefit der Thrombolysetherapie.7,8 Bei Hochrisiko-Patienten wird daher von den Fachgesellschaften eine systemische Thrombolyse zusätzlich zur sofortigen Gabe eines UFH-Bolus empfohlen (ESC/ERC Grad IB, ACCP Grad 2B, AHA 2aB).1,9,10 Die am häufigsten eingesetzten fibrinspezifischen Thrombolytika sind Alteplase (rtPA), Reteplase und Tenecteplase, wobei lediglich Alteplase zur Thrombolyse bei PE zugelassen ist.
Im Rahmen eines Herz-Kreislauf-Stillstandes (Inzidenz 5%) sind die Überlebenraten gering, der Benefit, wieder stabile Kreislauf-Verhältnisse zu erreichen, überwiegt das Risiko für Blutungen, absolute Kontraindikationen werden relativ. Zumeist sind alternative Reperfusionsmaßnahmen nicht sofort verfügbar, sodass als Ultima Ratio auch bei hohem Blutungsrisiko lysiert wird. In den meisten Studien und Fallserien wurde rtPA als Bolus von 50mg bis max. 100mg verabreicht (Bolus 50mg rtPA, dann ggf. Wiederholung). Empfehlungen zur Reanimationsdauer nach Lyse reichen von 15–90 Minuten.11,12
Auch bei nicht reanimationspflichtigen instabilen Patienten besteht eine klare Indikation für eine STL (ESC IB), üblicherweise wird Alteplase als Bolus (0,6mg/kg, max. 50mg) oder als Kurzzeitregime (10mg Bolus, dann 90mg über 2 Std., HWZ 5min) verabreicht. Reteplase (2x 10mg Bolus im Abstand von 30min, HWZ 13min) oder Tenecteplase (gewichtsadaptiert max. 50mg, HWZ 90min) stehen off-label zur Verfügung.1 Heparin kann während einer STL mit rtPA kontinuierlich verabreicht werden, manche Autoren empfehlen, UFH bis zu einer aPTT <80 sec zu pausieren, um dann ohne Bolus neuerlich zu beginnen. Dies scheint besonders bei einem gewissen Blutungsrisiko sinnvoll.
Entgegen allen Empfehlungen zeigen rezente Daten aus Deutschland, dass eine Thrombolysetherapie im Rahmen einer Reanimation lediglich in 25,6% und bei Schock in 14,6% der Fälle verabreicht wird. Gründe hierfür sind vorwiegend Alter, chirurgische Eingriffe und Karzinome. Gerade aber Patienten nach kardiogenem Schock hatten einen eindeutigen Überlebensbenefit durch Lysetherapie, unabhängig von Alter, Geschlecht und Komorbiditäten.13
Perkutane interventionelle Katheterembolektomie & chirurgische Embolektomie
Verschiedenste Devices zur interventionellen perkutanen Thrombusfragmentation, -aspiration, -ektomie mit und ohne Thrombolytikagabe gelangten bis dato zum Einsatz.14 Rezent wurden das FlowTriever Embolectomy Device und das Indigo-Thrombektomie-System zur direkten Thrombektomie vorgestellt.
Das in Österreich bereits eingesetzte FlowTriever Device (Inari Medical) bietet die Möglichkeit, über eine 20-French-Kanüle thrombotisches Material mittels Vakuumaspiration zu entfernen, was zu einer raschen und signifikanten Reduktion der RV/LV-Ratio führt (FLARE Study).15 Dieses Verfahren kann vor allem bei erhöhtem Blutungsrisiko eingesetzt werden, allerdings können mechanische Komplikationen auftreten. Derzeit fehlen noch Mortalitätsdaten und randomisierte Studien, um die Risiko/Benefit-Ratio zu klären und eindeutige Empfehlungen abzugeben. Die Chancen für vermehrten Einsatz in entsprechenden Zentren scheinen günstig.
Bei entsprechender Expertise ist eine chirurgische Embolektomie bei Lyse-KI eine sichere Therapieoption. Als zusätzliche Indikationen wären ein Thrombus in Transit und ein offenes Foramen ovale zu nennen.16 Infolge der Invasivität wird sie allerdings meist erst als Ultima Ratio oder nach Lyseversagen eingesetzt, was die Überlebensdaten naturgemäß beeinflusst.Schwangerschaft und Post-partum-Periode gelten als relative KI für STL, bei instabilen Patienten kann jedoch eine STL oder eine chirurgische Embolektomie (ESC IIa/C) durchgeführt werden – Thrombolytika. Anzumerken ist, dass Heparine die Plazentaschranke nicht passieren. Ein Literatur-Review findet bei STL eine geringere Anzahl maternaler (4,4% vs. 14,7%) und fetaler (1,65% vs. 5,2%) Komplikationen im Vergleich zu CDT.17
Extrakorporale Membranoxygenierung (ECMO)
Hinsichtlich ECMO, entweder als „bridging to recovery“ oder bis zum Erfolg von Reperfusionsmaßnahmen, existieren Berichte über ein günstiges Outcome. Eine STL sollte idealerweise nach Kanülierung appliziert werden. Rezente Daten lassen sogar vermuten, dass die meisten Patienten mit Hochrisiko-PE und ECMO (welche eine relative KI zur Lyse darstellt) sich unter alleiniger Antikoagulation verbessern.18 Die Entscheidung zur Reperfusion sollte rasch erfolgen, 2/3 aller instabilen Patienten versterben innerhalb der ersten Stunden (Tab. 4)
Zusammenfassende Empfehlungen bei Hochrisiko-PE (ESC-Guidelines)1:
-
Systemische Thrombolyse (IB)
-
Chirurgische Embolektomie bei Lyse-KI/-versagen und entsprechender Verfügbarkeit (IC)
-
Kathetergestützte Therapie bei Expertise und Ressourcen bei hohem Blutungsrisiko, nach frustraner STL oder wenn Schock zum Tod führen kann, bevor die STL wirkt (ESC IIaC)
-
ECMO kombiniert mit chirurgischer Embolektomie oder Katheterverfahren bei refraktärem Schock oder Kreislaufstillstand (IIbC)
Therapieoptionen bei Intermediärrisiko-PE
Differenzierter zu betrachten sind Intermediärrisiko-Patienten.
Jene mit intermediär-niedrigem Risiko sollten in der Regel initial kurzzeitig LMWH in stationärem Setting und in der Folge eine orale Antikoagulation, bevorzugt ein DOAK, erhalten.
Bei Intermediär-Hochrisiko-Patienten wird primär eine Antikoagulation mit Heparinen empfohlen. Infolge rascher Reversibilität wird, vor allem bei drohender klinischer Verschlechterung, UFH bevorzugt, um jederzeit Reperfusionsmaßnahmen initiieren zu können. Ein Bolus (80IE/kg KGW UFH) gefolgt von einem UFH-Perfusor (18IE/kg KGW/h) unter Therapiemonitoring wird hier empfohlen. Das Normogramm nach Raschke hilft, stabile aPTT-Werte von 60–80 Sek. zu erzielen.19 Infolge der Dosierungsproblematik unter UFH-Perfusor geht der Trend in Richtung LMWH-Therapie. Entgegen vielen Erwartungen hat bei Intermediär-Hochrisiko-PE die bis dato größte kontrollierte randomisierte Studie (PEITHO) mit 1000 Patienten hinsichtlich Gesamtmortalität keinen signifikanten Vorteil einer STL (Tenecteplase plus Heparin) gegenüber alleiniger Heparintherapie gezeigt. Der kombinierte Endpunkt Mortalität und hämodynamischer Kollaps trat zwar in der Lysegruppe signifikant seltener ein (NNT 28), allerdings auf Kosten schwerer Blutungskomplikationen (NNH 19).20 Als mögliche Ursache für die erhöhte Blutungsinzidenz wurde Tenecteplase diskutiert, allerdings haben Metaanalysen bereits vor PEITHO keine verbesserte Nutzen-Risiko-Korrelation bei stabilen Patienten durch STL gezeigt.21
Während in Studien die Rate von schweren Blutungsereignissen bei 6,6% und von ICB bei 1,7% liegt, wird diese in der realen Welt als höher eingeschätzt. Genaue Vorhersagen bleiben schwierig, zerebrovaskuläre Vorerkrankungen und Alter >65 Jahre spielen eine wesentliche Rolle. Eine routinemäßige STL bei Intermediär-Hochrisiko-PE wird daher abgelehnt, eine STL erst bei drohender Instabilität empfohlen.1
Reduzierte systemische Thrombolyse
Alternativ zur Volldosis-STL wurden zuletzt, vor allem bei kompromittierten Patienten mit Intermediär-Risiko-PE (Tachykardie, Hypoxämie …) und geringem Blutungsrisiko, eine dosisreduzierte STL sowie eine Katheterlyse (CDTL) eingesetzt und zeigen eine günstige Nutzen-Risiko-Relation. So fand sich im MOPETT Trial unter rtPA in einer Dosierung von 0,5mg/kg KGW (maximal 50mg) keine höhere Blutungsinzidenz verglichen mit Heparin.22 Eine Metaanalyse zeigte keine Therapieunterlegenheit gegenüber einer Volldosis-Lyse sowie einen Trend zu weniger schweren Blutungsereignissen.23 Eine Dosisreduktion scheint daher eine Behandlungsoption, die Evidenz für eine Therapieempfehlung ist noch gering.
Kathetergestützte lokale Thrombolyse
Noch niedrigere Lysedosen können lokal mittels Katheter (derzeit überwiegend EKOS Sonic) verabreicht werden. Dieser wird bei zentralen Thromben ein- oder beidseitig in der Pulmonalarterie platziert und rtPA über Seitausgänge lokal appliziert. Hochfrequenz-Ultraschallwellen sollen zu einer verbesserten Penetration des Lytikums in den Thrombus und somit zu dessen Disruption führen. CDTL-Verfahren bewirkten eine raschere Reduktion der RV/LV-Ratio und des Pulmonalisdruckes als alleinige Antikoagulation.24,25 Diverse Protokolle betreffend Lysedosis und -dauer liegen vor, eine Gesamtdosis von 30mg rtPA wird selten überschritten. Die Tendenz geht zu weiterer Reduktion der Lysedosis und -dauer (4–12mg rtPA/Lunge über 2–6Std.).
Schwere Blutungskomplikationen treten entsprechend einer Metaanalyse in einer Häufigkeit von 5,4% auf, leichtere in 6%.26 Interessanterweise scheint eine niedrig dosierte, mittels Katheter über einen längeren Zeitraum lokal applizierte Menge an rtPA einen höheren fibrinogenolytischen Effekt zu besitzen als in einem kürzeren Zeitintervall systemisch verabreichte höhere Dosen. Einige Experten kontrollieren daher Fibrinogen während der Prozedur und pausieren, wenn dieses einen festgesetzten Wert unterschreitet.27
Auch wenn bis dato keine direkten Vergleichsstudien von CDT und systemischer Thrombolyse vorliegen, so ereignen sich weniger Blutungskomplikationen unter CDT. Katheterassoziierte Komplikationen wie Gefäßperforation, Herzbeuteltamponade (cave PFO) und Rhythmusstörungen müssen in Betracht gezogen werden.28
Eine rezente Analyse von ca. 980000 Patienten in Deutschland zeigt, dass insgesamt 4,3% eine STL und 0,1% eine lokale Lyse erhielten, die Rate an intrazerebralen Blutungen betrug unabhängig von der Art der Applikation ca. 1,5%.29
Eine Network-Analyse von 22 randomisierten Studien mit Vergleich diverser Rekanalisationsmethoden und alleiniger Antikoagulation zeigte keinen signifikanten Benefit einer spezifischen Therapie. Eine Low-Dose-STL war in dieser Publikation mit der geringsten Sterblichkeit und Blutungsrate verbunden.30 Direkte Vergleichsstudien interventioneller Methoden mit STL liegen nicht vor.14
Die ideale Therapie für Intermediär-Hochrisiko-Patienten festzulegen ist komplex, es gibt kein „Rezept“ für alle, Therapieentscheidungen bleiben weiterhin individuell, abhängig von Blutungsrisiko, Thrombuslokalisation und Verfügbarkeit sowie lokaler Expertise.31 Ein multidisziplinäres PERT-Team (Pulmonary Embolism Response Team) kann in der Therapieentscheidung helfen.32 Wesentlich sind Aufklärung der Patienten sowie Diskussion von Therapieoptionen und Präferenzen. Zusammenfassende Empfehlungen bei Intermediär-Hochrisiko-PE: Antikoagulation mit Heparinen (IA), STL bei drohender Dekompensation und niedrigem Blutungsrisiko (ESC IB), Katheterverfahren/chirurgische Embolektomie alternativ zur Notfallthrombolyse bei sich unter Antikoagulation verschlechternden Patienten (IIaC), keine routinemäßige STL (IIIB).
Therapie bei Intermediär-Niedrigrisiko-, Niedrigrisiko-PE & Rezidivprophylaxe
Heparine
Heparine sind die First-Line-Therapie für die meisten Patienten mit PE (IA) und sollten bei höherem Verdacht bereits während der Diagnostik verabreicht werden (IC). Infolge der unkomplizierteren Anwendung (stabilere Wirkstoffspiegel, keine Notwendigkeit einer routinemäßigen Kontrolle, einfache Verabreichung und geringeres HIT-Risiko) wird LMWH der Vorzug gegenüber UFH gegeben (IA). In der Rezidivprophylaxe bei Patienten mit KI gegen orale Antikoagulanzien (Schwangerschaft, GI Karzinome, rezente Blutungen, Thrombozytopenie …) sollten LMWH fortgesetzt werden.
Orale Antikoagulanzien
Vor der Einführung direkter oraler Antikoagulanzien (DOAK) bestanden Therapie und Rezidivprophylaxe bei Patienten ohne Karzinom in der Verabreichung von LMWH gefolgt von VKA, initial überlappend bis zum Erreichen einer Ziel-INR von 2,0–3,0.33
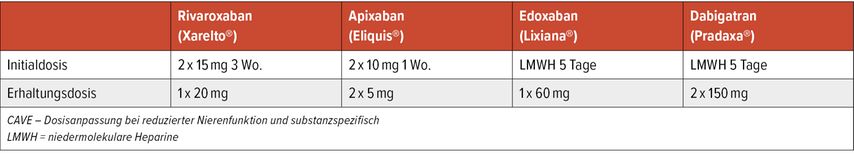
Verglichen mit diesem Regime haben sich Rivaroxaban (EINSTEIN-PE), Apixaban (AMPLIFY), Dabigatran und Edoxaban (Hokusai) als gleichwertig hinsichtlich Rezidivprophylaxe erwiesen und zeigten zusätzlich ein geringeres Risiko für schwere, vor allem intrazerebrale Blutungen.34 Eine rezente Metaanalyse findet ebenso keine höhere Inzidenz von schweren GI Blutungen unter DOAK oder LMWH im Vergleich zu Warfarin, das geringste GI Blutungsrisiko besteht unter Apixaban.35 DOAK (Tab. 5) sind daher die bevorzugte Therapie für alle Patienten, die dafür infrage kommen (IA).1 Direkte Vergleichsstudien der einzelnen DOAK liegen nicht vor.
Bei Antiphospholipidsyndrom, schwerer Niereninsuffizienz sowie in Schwangerschaft und Stillperiode sollen keine DOAK verabreicht werden.
Pharmakologische Eigenschaften und Medikamenteninteraktionen müssen individuell beachtet werden (Tab. 5).
Karzinompatienten haben das höchste Rezidiv- und Blutungsrisiko, besonders unter Chemotherapie. LMWH haben sich in dieser Patientengruppe als sicherer als VKA hinsichtlich Rezidiv und Blutung erwiesen. Im Vergleich zu LMWH zeigten DOAK eine deutliche Reduktion von Rezidiven, allerdings im gleichen Ausmaß eine Erhöhung der Rate schwerer Blutungen.36 Limitierend sind vor allem die Art des Malignoms (Urothelkarzinome, GI Karzinome) und Medikamenteninteraktionen (Chemotherapeutika, Antibiotika, Antimykotika, Virustatika …).37 Die Gabe von DOAK sollte daher individuell erfolgen, Edoxaban oder Rivaroxaban können, außer bei Patienten mit gastrointestinaler Krebserkrankung, alternativ zu LMWH in Betracht gezogen werden (IIa).1
Therapiedauer
Die Mindesttherapiedauer beträgt bei allen PE-Patienten 3 Monate.1 Für die Gesamttherapiedauer der Antikoagulation ist ein regelmäßiges Evaluieren von individuellem Rezidiv- und Blutungsrisiko sowie Patientenpräferenz erforderlich. Rezidiv- und Blutungsrisiko sind am höchsten in den ersten Monaten nach Akutereignis.
Cava-Schirm (VCF)
Ein routinemäßiger Einsatz von Cava-Schirmen wird abgelehnt (IIIA) und diese lediglich bei absoluter KI gegen Antikoagulation bzw. Rezidiv unter therapeutischer Antikoagulation empfohlen (IIaC).1 Die PREPIC-2-Studie zeigte auch bei symptomatischer PE und DVT und Risikofaktoren für ungünstigen Verlauf (verminderte kardiale Reserve) keinen Benefit von Cava-Schirmen.38
Literatur:
1 Konstantinides S et al.: 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2019; 41: 543-603 2 Marshall P et al.: Controversies in the management of life-threatening pulmonary embolism. Semin Respir Crit Care Med 2015; 36: 835-41 3 Tapson V, Friedman O: Systemic thrombolysis for pulmonary embolism: who and how. Tech Vasc Interv Radiol 2017; 20: 162-74 4 Triantafyllou G et al.: Risk stratification in acute pulmonary embolism: the latest algorithms. Semin Respir Crit Care Med 2021; 42: 183-98 5 Barnes G et al.: Comparison of 4 acute pulmonary embolism mortality risk scores in patients evaluated by pulmonary embolism response teams. JAMA Network Open 2020; 3: e2010779 6 Klok F et al.: Performance of five different bleeding-prediction scores in patients with acute pulmonary embolism. J Thromb Thrombolysis 2016; 41: 312-20 7 Li X et al.: A meta-analysis of cardiopulmonary resuscitation with and without administration of thrombolytic agents. Resuscitation 2006; 70: 31-6 8 Marti C et al.: Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis . Eur Heart J 2015; 36: 605-14 9 Stevens S et al.: Antithrombotic therapy for VTE disease. Second update of the CHEST guideline and expert panel report. Chest 2021; 160: e545-e608 10 Jaff MR et al.: Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic hypertension: a scientific statement from the AHA. Circulation 2011; 123: 1788-830 11 Truhlář A et al.: European Resuscitation Council Guidelines for Resuscitation 2015: section 4. Cardiac arrest in special circumstances. Resuscitation 2015; 95: 148-201 12 Lott C et al.: Kreislaufstillstand unter besonderen Umständen. Leitlinien des ERC 2021. NotfallRettungsmed 2021; 24: 447-523 13 Keller K et al.: Trends in thrombolytic treatment and outcomes of acute pulmonary embolism in Germany. Eur Heart J 2020; 41: 522-9 14 Giri J et al.: Interventional therapies for acute pulmonary embolism: current status and principles for the development of novel evidence: a scientific statement of the AHA. Circulation 2019; 140: e774-801 15 Tu T et al.: A prospective, single arm, multicenter trial of catheter-directed mechanical thrombectomy for intermediate-risk acute pulmonary embolism: the FLARE study. JACC Cardiovasc Interv 2019; 12: 859-69 16 Kalra J et al.: Surgical embolectomy for acute pulmonary embolism: a systematic review and comprehensive meta-analysis. Ann Thorac Surg 2017; 103: 982-90 17 Ho V et al.: Thrombolysis for venous thromboembolism during pregnancy: a literature review. Vasc Endovascular Surg 2018; 52: 527-34 18 Ghoreishi M et al.: Predictors of recovery in patients with VA-ECMO for acute massive pulmonary embolism. Ann Thorac Surg 2020; 110: 70-5 19 Raschke RA et al.: The weight-based heparin dosing nomogram compared with a “standard care” nomogram. Ann Intern Med 1993; 119: 874-81 20 Meyer G et al.: Fibrinolysis for patients with intermediate-risk pulmonary embolism. NEJM 2014; 370: 1402-11 21 Wan S et al.: Thrombolysis compared with heparin for the initial therapy of pulmonary embolism. A meta-analysis of the randomized controlled trials. Circulation 2004; 110: 744-9 22 Sharifi M et al.: Moderate pulmonary embolism treated with thrombolysis-the MOPETT trial. Am J Cardiol 2013; 111: 273-7 23 Zhang Z et al.: Lower dosage of recombinant tissue-type plasminogen activator (rt-PA) in the treatment of acute pulmonary embolism: a systematic review and meta-analysis. Thromb Res 2014; 133: 357-63 24 Kucher N et al.: Randomized controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation 2014; 129: 479-86 25 Piazza G et al.: A prospective, single-arm, multicenter trial of ultrasound-facilitated, catheter-directed, low-dose fibrinolysis for acute massive and submassive pulmonary embolism: the SEATTLE II study. JACC Cardiovasc Interv 2015; 8: 1382-92 26 Pei D et al.: Meta-analysis of catheter directed ultrasound-assisted thrombolysis in pulmonary embolism. Am J Cardiol 2019; 124: 1470-7 27 Kaufman C et al.: Practice trends of fibrinogen monitoring in thrombolysis. J Clin Med 2018; 7: 111 28 Eberle H et al.: Clinical update on thrombolytic use in pulmonary embolism: a focus on intermediate-risk patients. Am J Health Syst Pharm 2018; 75: 1275-85 29 Hobohm L et al.: In-hospital outcomes of catheter-directed thrombolysis in patients with pulmonary embolism. Eur Heart J 2021; 10: 258-64 30 Jimenez D et al.: Efficacy and safety outcomes of recanalisation procedures in patients with acute symptomatic pulmonary embolism: a systematic review and network meta-analysis. Thorax 2018; 73: 464-71 31 Piazza G: Advanced management of intermediate and high-risk pulmonary embolism. JACC 2020; 76: 2117-27 32 Rosovsky R et al.: Pulmonary embolism response teams: purpose, evidence for efficacy, and future research directions. Res Pract Thromb Haemost 2019; 3: 315-30 33 Kearon C et al.: Antithrombotic therapy for venous thromboembolic disease. ACCP evidence-based clinical practice guidelines (8th edition). Chest 2008; 134: 454S-545S 34 van Es N et al.: Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood 2014; 124: 1968-75 35 Oh H et al.: The risk of gastrointestinal hemorrhage with non-vitamin K antagonist anticoagulants. A network meta-analysis. Medicine 2021; 100: 11 36 Khan F et al.: Venous thromboembolism. Lancet 2021; 398: 64-77 37 Pernod G et al.: Direct oral anticoagulant (DOAC) versus low-molecular-weight heparin (LMWH) for the treatment of cancer-associated thrombosis (which agent for which patient). J Med Vasc 2020; 45: 6S17-6S23 38 Muriel A et al.; RIETE Investigators: Survival effects of inferior vena cava filter in patients with acute symptomatic venous thromboembolism and a significant bleeding risk. JACC 2014; 63: 1675-83
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
State of the Art Mitralklappen-therapie 2025
Bei Mitralklappenerkrankungen, allen voran der Mitralinsuffizienz (MI), stehen heute, durch die rasante Weiterentwicklung innovativer Therapieverfahren, fortschrittliche ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...