Asymptomatische Vorhofflimmerepisoden bei Patienten mit implantierten kardialen Devices: Wer sollte antikoaguliert werden?
Autoren:
Dr. med. Andrea Papa
Prof. Dr. med. Christian Sticherling
Universitäres Herzzentrum
Universitätsspital Basel
E-Mail: christian.sticherling@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei Patienten mit Herzschrittmachern, implantierbaren Defibrillatoren oder Loop-Rekordern werden bei deren Abfrage häufig kurze Episoden von Vorhofarrhythmien, sogenannte «device-detected atrial fibrillations» (DDAF), detektiert. Es ist unklar, ob bei Patienten ohne bekanntes Vorhofflimmern eine orale Antikoagulation begonnen werden sollte. Zwei grosse randomisierte kontrollierte Studien geben Einblicke in den potenziellen Nutzen und die Nachteile einer Antikoagulationstherapie.
Keypoints
-
DDAF sind Episoden schneller atrialer elektrischer Aktivität, welche von implantierbaren elektrischen Herzgeräten oder von implantierbaren Herzmonitoren erfasst werden.
-
Die Inzidenz von DDAF liegt bei rund 30% nach 3 Jahren.
-
Das jährliche Risiko für ein thromboembolisches Ereignis ist in dieser Population sehr niedrig (rund 1%).
-
Rund 25% der Patienten mit DDAF entwickeln in den folgenden 3 Jahren ein klinisches Vorhofflimmern.
-
Auf dem Boden der Studien NOAH-AFNET 6 und ARTESiA werden keine generellen Empfehlungen zur oralen Antikoagulation gegeben. Bei Patienten mit einem sehr hohen thromboembolischen Risiko (CHA2DS2-VASc >4) sollte diese aber erwogen werden.
Vorhofflimmern (VHF) ist die häufigste Herzrhythmusstörung und geht mit einer erhöhten Mortalität und Morbidität einher, insbesondere mit Schlaganfall, Herzinfarkt, Herzinsuffizienz und kognitivem Abbau.1 Die geschätzte Prävalenz liegt bei etwa 2–4% weltweit und steigt bei Erwachsenen über 80 Jahren auf 9% an. Das Lebenszeitrisiko für das Auftreten von VHF wird auf 1 von 3 Personen europäischer Abstammung im Alter von 55 Jahren geschätzt.
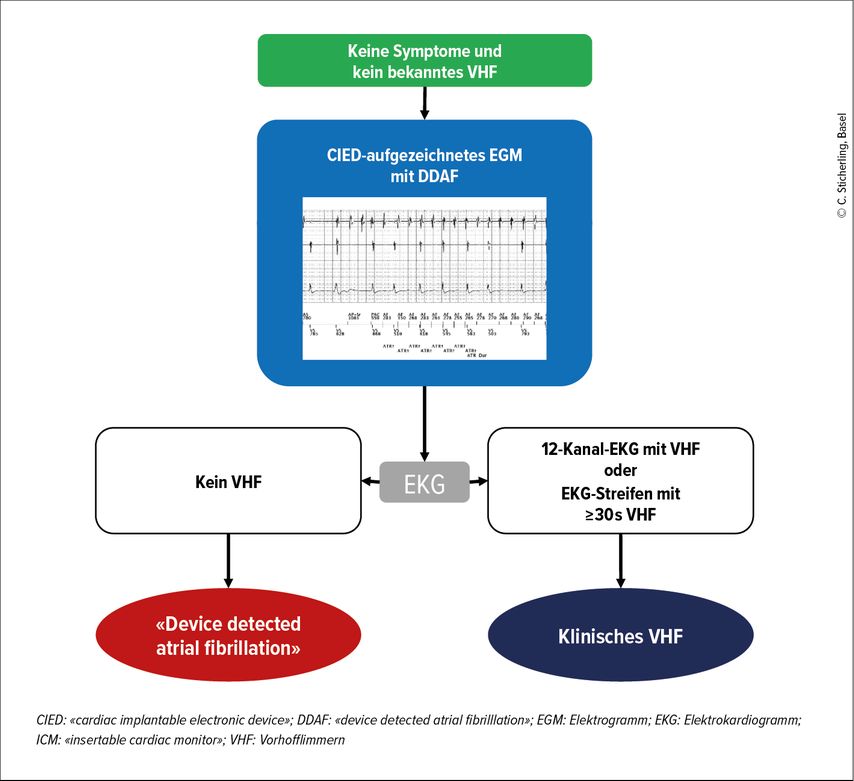
Ein klinisches VHF liegt vor, wenn ein konventionelles 12-Kanal-EKG oder eine Ein-Kanal-EKG-Aufzeichnung von ≥30s einen unregelmässigen Herzrhythmus ohne erkennbare P-Wellen zeigt.
Vor allem bei älteren Menschen ist VHF häufig asymptomatisch und manifestiert sich erstmals als zerebrale Thromboembolie. Bei circa 20% der Schlaganfälle liegt ein VHF zugrunde. Sucht man mit kontinuierlicher Rhythmusüberwachung wie beispielsweise einem implantierbaren Loop-Rekorder (ILR) früh nach einem ischämischen Ereignis nach VHF, so findet man dies bei weiteren 30% der Patienten mit kryptogenem Schlaganfall. Basierend auf diesen Beobachtungen liegt im Moment ein grosses Augenmerk darauf, Personen mit einem höheren Risiko für die Entwicklung von VHF frühzeitig zu identifizieren. Ob der Beginn einer frühzeitigen oralen Antikoagulation (OAK) in der Population mit asymptomatischen VHF-Episoden, die im Speicher von implantierten Herzschrittmachern, ICD und Loop-Rekordern detektiert werden, die Rate an thromboembolischen Ereignissen oder gar die Mortalität senkt, wurde in zwei grossen kürzlich publizierten randomisierten Studien untersucht.
«Device-detected atrial fibrillation»: die Dimension des Problems
In den ESC-Guidelines für das Management von Vorhofflimmern von 2024 wurde der Begriff des «Device-detektierten Vorhofflimmerns» («device-detected atrial fibrillation», DDAF) etabliert, der die alten Begriffe «atrial high rate episodes» und «subclinical atrial fibrillation» ersetzt.1 DDAF beschreibt eine schnelle atriale elektrische Aktivität mit einer atrialen Frequenz von ≥175/min und einer Dauer ≥5 Minuten, die von kardialen implantierbaren elektrischen Geräten (CIED) mit der Möglichkeit der Aufzeichnung der atrialen Aktivität, wie z.B. Herzschrittmachern und Defibrillatoren, oder von implantierbaren Herzmonitoren erfasst wird. Da gespeicherte Elektrogramme Artefakte oder Rauschen enthalten können, ist eine sorgfältige visuelle Inspektion erforderlich, um eine Vorhofarrhythmie zu bestätigen (Abb. 1). DDAF wird in der Regel zufällig bei einer Routineabfrage des CIED entdeckt und ist meist asymptomatisch.
Abb. 1: Diagnose von Geräte-detektiertem Vorhofflimmern (DDAF). Kardiale implantierbare elektrische Geräte (CIED) mit einer atrialen Ableitung können den Vorhofrhythmus überwachen und die Aufzeichnungen speichern. Implantierbare kardiale Monitoren (ICM) überwachen kontinuierlich die elektrische Aktivität des Herzens durch Aufzeichnung und Analyse eines bipolaren Oberflächen-EKGs (adaptiert nach Hindricks G et al.: Eur Heart J 2021; 42: 373-498)
Die Inzidenz von DDAF bei Patienten mit einem CIED liegt bei rund 30%. Sehr kurze Episoden (<20s pro Tag) sind klinisch irrelevant. Längere Episoden von DDAF sind jedoch mit einem erhöhten Risiko für klinisches Vorhofflimmern, ischämischen Schlaganfall und schwere kardiovaskuläre Ereignisse verbunden.2
Thromboembolierisiko bei klinischem und subklinischem Vorhofflimmern
In frühen Studien, in denen die Wirksamkeit von Vitamin-K-Antagonisten im Vergleich zu Placebo untersucht wurde, lag die durchschnittliche Schlaganfallrate bei Patienten mit klinischem VHF ohne Behandlung bei 5% pro Jahr und erreichte bei der Sekundärprävention bis zu 12% pro Jahr. Vitamin-K-Antagonisten reduzieren das Schlaganfallrisiko bei Patienten mit VHF im Vergleich zu Placebo um 64% mit einer absoluten Risikoreduktion bei allen Schlaganfällen von 2,7% pro Jahr in der Primärprävention und 8,4% pro Jahr in der Sekundärprävention.3
Eine Metaanalyse von vier grossen randomisierten Studien mit 42411 Patienten, die ein orales Nicht-Vitamin-K-Antikoagulans (NOAK) erhielten, und 29272 Patienten, die Warfarin erhielten, zeigte eine signifikant höhere Wirksamkeit von NOAK, im Vergleich zu Warfarin bei der Prävention von Schlaganfällen und systemischen Embolien (SE) (HR: 0,81; p<0,001). Die NOAK verringerten auch signifikant die Gesamtmortalität (HR: 0,90; p=0,0003) und das Risiko für intrakranielle Blutungen (HR: 0,48; p<0,001), erhöhten aber das Risiko für gastrointestinale Blutungen (HR: 1,25; p=0,04).4
Vor der NOAK-Ära galt ein jährliches Schlaganfallrisiko von 1,7% als Schwellenwert für den Beginn einer OAK bei Patienten mit Vorhofflimmern.5 In den letzten zehn Jahren, nach den VHF-Studien mit NOAK, haben die Leitlinien eine Antikoagulation für Patienten mit einem jährlichen Schlaganfallrisiko von 1,0% empfohlen. Diese Verschiebung nach unten steht im Einklang mit der grösseren Sicherheit von NOAK. Ein CHA2DS2-VA-Score <1 definiert eine Gruppe mit einem jährlichen Schlaganfall- und/oder SE-Risiko von <1%, bei der aufgrund des minimalen absoluten Nutzens auf eine OAK verzichtet werden kann. Die ESC-Leitlinien zur Behandlung von Vorhofflimmern von 2024 empfehlen NOAK für Patienten mit VHF und einem geschätzten jährlichen Thromboembolierisiko von >0,6–1% (entspricht einem CHA2DS2-VA-Score >2). Bei einem CHA2DS2-VA-Score von 1 kann eine OAK erwogen werden.1
«Device-detected atrial fibrillation»
Im Jahr 2009 zeigte die TRENDS-Studie, dass in einer Kohorte von Patienten mit Herzschrittmachern oder Defibrillatoren und mindestens einem Risikofaktor für Schlaganfall (Herzinsuffizienz, Bluthochdruck, Alter ≥65 Jahre, Diabetes oder frühere SE) das annualisierte Risiko für thromboembolische Ereignisse während eines mittleren Follow-ups von 1,4 Jahren bei 1,1% für Patienten ohne VHF, bei 1,1% für Patienten mit geringer VHF-Belastung (<5,5 Stunden) und bei 2,4% für Patienten mit hoher VHF-Belastung (≥5,5 Stunden) lag.6
Die ASSERT-Studie legte ebenfalls nahe, dass Patienten mit subklinischem VHF ein 2,5-fach erhöhtes Risiko für einen ischämischen Schlaganfall mit einem absoluten Risiko von 1,7% pro Jahr aufwiesen.7 Eine weitere Analyse der ASSERT-Kohorte ergab, dass das Schlaganfallrisiko fast ausschliesslich auf DDAF zurückzuführen war, die länger als 24 Stunden dauerten (absolutes Risiko 3,1% pro Jahr, HR: 3,24; p=0,003), während sich das Risiko bei Patienten mit atrialen Hochfrequenzepisoden (AHRE) von kürzerer Dauer nicht signifikant von dem von Patienten ohne AHRE unterschied.8
Soll man alle Patienten mit DDAF antikoagulieren?
Es stellt sich nun die Frage, ob eine OAK bei Patienten mit DDAF die Rate an thrombembolischen Komplikationen senkt und ob möglicherweise sogar ein Screening auf DDAF gerechtfertigt ist. Die erste von mehreren randomisierten Studien, in der Geräte-detektiertes Vorhofflimmern und Antikoagulation untersucht wurden, war die LOOP-Studie.9 In dieser Studie wurden ältere dänische Patienten mit mindestens einem zusätzlichen Schlaganfall-Risikofaktor (CHA2DS2-VASc-Score ≥2) und einem mittleren Alter von 75 Jahren entweder einer Überwachung mittels ILR oder der Standardversorgung (1:3) mit jährlichen Visiten zugeteilt. In der ILR-Gruppe wurde eine OAK eingeleitet, wenn die VHF-Episoden 6 Minuten oder länger dauerten.
Die Studie zeigte, dass implantierbare Herzmonitore die Erkennung von DDAF erhöhen, was zu einer häufigeren Initiierung einer Antikoagulationstherapie führt. Die Zahl der Schlaganfälle oder SE wurde in der ILR-Gruppe im Vergleich zur Kontrollgruppe jedoch nicht gesenkt (4,5% vs. 5,6%; p=0,11). Grössere Blutungen traten bei 4,3% der Patienten in der ILR-Gruppe gegenüber 3,5% in der Kontrollgruppe auf (p=0,11).
Bemerkenswert ist, dass 91% der Patienten mit VHF in der ILR-Gruppe und 86,5% in der Kontrollgruppe eine OAK erhielten. Trotz der dreifach höheren Detektionsrate von DDAF/VHF (32 vs. 12%) in der ILR-Gruppe führte dies nicht zu einem geringeren Schlaganfallrisko. Zwei kürzlich publizierte Studien (GUARD-AF10, STROKESTOPP II11) bestätigen, dass ein Screening in grossen Populationen zwar mehr DDAF/VHF detektiert, der daraus folgende Beginn einer OAK aber leider nicht das Schlaganfallrisiko senkt.
NOAK in DDAF – die Studien NOAH-AFNET 6 und ARTESiA
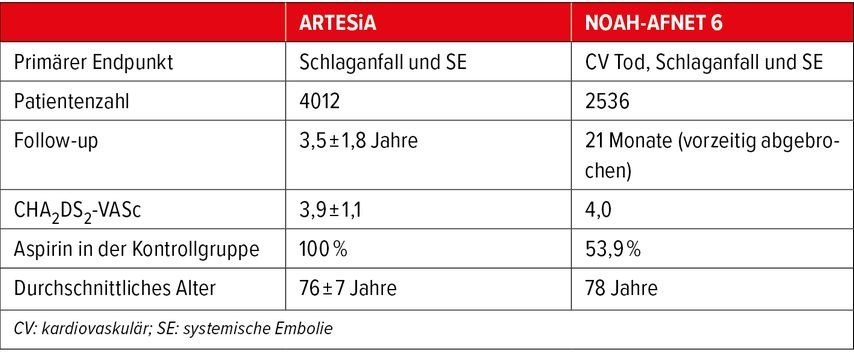
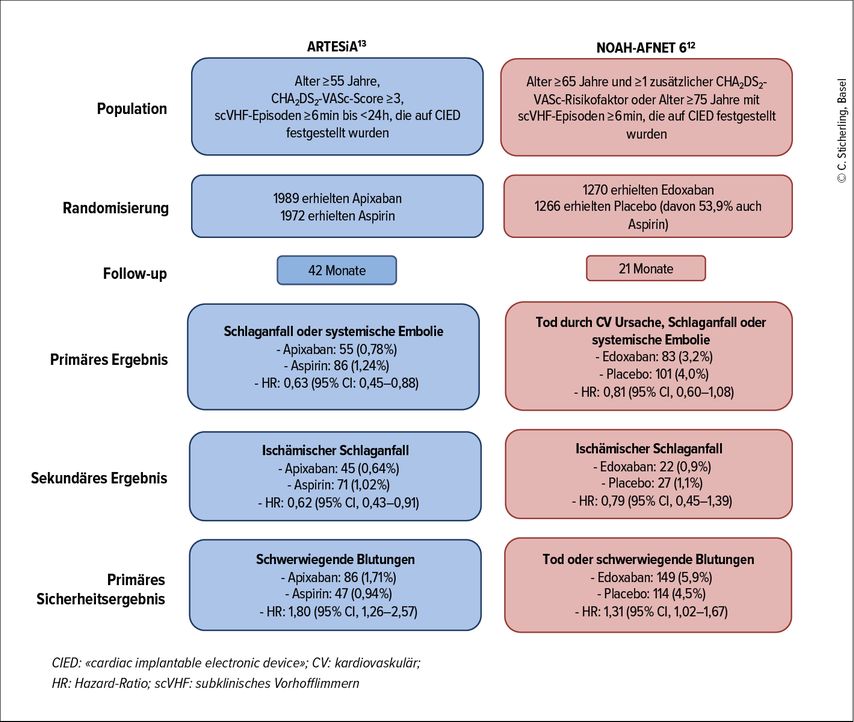
Zwei grosse randomisierte Studien zur Rolle von NOAK bei DDAF wurden kürzlich veröffentlicht (Tab.1, Abb.2).
Abb. 2: Übersicht über die randomisierten, kontrollierten Studien zur Verwendung oraler Antikoagulanzien bei subklinischem Vorhofflimmern. Die Resultate sind als Anzahl der Patienten mit Ereignis (%/Patientenjahr) angegeben (adaptiert nach Svennberg E: N Engl J Med 2024; 390: 175-7)
In der Studie NOAH-AFNET 6 wurden 2536 Personen mit DDAF zu Edoxaban oder Placebo randomisiert.12 Hierbei ist wichtig zu erwähnen, dass mehr als die Hälfte der Patienten in der Placebogruppe zusätzlich Aspirin einnahm. Der primäre Endpunkt der Studie war der Tod durch kardiovaskuläre Ursachen, Schlaganfall oder SE. Nach einer mittleren Nachbeobachtungszeit von 21 Monaten wurde die Studie aufgrund von Sicherheitsbedenken und der Bewertung einer unzureichenden Wirksamkeit vorzeitig abgebrochen. Bei Studienende war der primäre Endpunkt bei 3,2% der Patienten in der Verumgruppe und bei 4% in der Placebogruppe aufgetreten (HR: 0,81; p=0,15). In beiden Gruppen war die Schlaganfallinzidenz sehr niedrig bei 0,9 bzw. 1,1% pro Patientenjahr. Der zusammengesetzte Sicherheitsendpunkt aus Gesamtmortalität und schweren Blutungen war bei 5,9% der Patienten in der Edoxaban-Gruppe und bei 4,5% der Placebogruppe aufgetreten (HR: 1,31; p=0,03), was auf eine 2-fach höhere Rate schwerer, aber nicht fataler Blutungen zurückzuführen war, da sich die Gesamtmortalität zwischen den Gruppen nicht unterschied.
In der Studie ARTESiA wurden 4012 Patienten mit DDAF von einer Dauer zwischen 6 Minuten und 24 Stunden randomisiert und erhielten entweder Apixaban oder Aspirin.13 In Fällen, in denen das VHF länger als 24 Stunden anhielt oder sich ein klinisches VHF entwickelte, wurden die Studienmedikamente abgesetzt und eine OAK begonnen. Während der mittleren Nachbeobachtungszeit von 3,5 Jahren trat der primäre Endpunkt (Schlaganfall oder SE) bei 55 Apixaban-Patienten und 86 Aspirin-Patienten auf (0,78% vs. 1,24% pro Patientenjahr; HR: 0,63; p=0,007). Schwere Blutungen traten unter Apixaban häufiger auf (HR: 1,81; p=0,04). Es wurden jedoch keine signifikanten Unterschiede in Bezug auf das Auftreten von tödlichen Blutungen oder symptomatischen intrakraniellen Blutungen festgestellt.
In einer zeitnah veröffentlichten Metaanalyse der ARTESiA- und NOAH-AF-Konsortien14 konnte dann konsistent bestätigt werden, dass die OAK zu einer relativen Risikoreduktion von 32% für einen Schlaganfall (absolute Risikoreduktion 1,2%) führt, das relative Risiko für eine schwere Blutung um 62% erhöht (absolute Risikozunahme 1,6%) und keinen Effekt auf die kardiovaskuläre oder Gesamtmortalität zeigt.
Glücklicherweise ist die jährliche Schlaganfallrate also sehr niedrig (ca. 1%). Es gilt aber zu beachten, dass das Auftreten von zu Behinderungen führenden bis tödlichen Schlaganfällen (modifizierte Rankin-Skala zwischen 3 und 6) unter Apixaban um die Hälfte reduziert wurde. Gleichzeitig konnten die schweren Blutungen unter Apixaban in 90% der Fälle konservativ behandelt werden.
Patientenselektion ist entscheidend
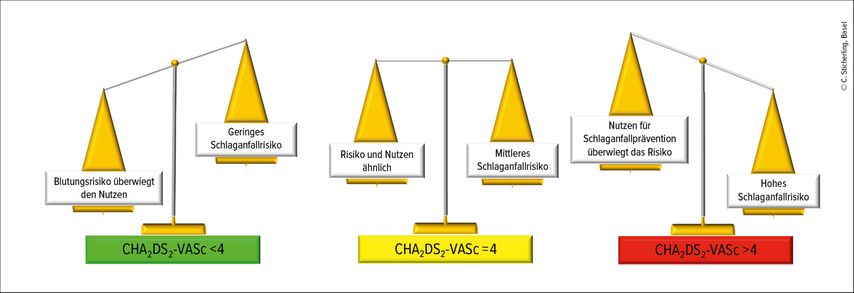
Die Informationen aus den zwei randomisierten kontrollierten Studien sind grundlegend für eine evidenzbasierte Entscheidungsfindung bei Patienten mit DDAF. Die Ergebnisse verschiedener Subanalysen der beiden Studien können einige Hinweise auf die Faktoren geben, die mit dem Schlaganfallrisiko in Verbindung stehen könnten. In einer Subanalyse von ARTESiA15 wurde gezeigt, dass weder die Häufigkeit noch die Dauer der längsten DDAF-Episode das Schlaganfallrisiko oder den Behandlungsnutzen von Apixaban veränderten. In ähnlicher Weise ergab sich in der NOAH-Kohorte, dass die Dauer der DDAF keinen Einfluss auf die Wirksamkeit und Sicherheit der Antikoagulation hatte,16 während höheres Alter, Diabetes und eingeschränkte Nierenfunktion wichtige Prädiktoren für Thromboembolien und Blutungen waren.17 Eine im Mai 2024 von Lopes et al. veröffentlichte Subanalyse der ARTESiA-Studie18 zeigte, dass bei Patienten mit einem CHA2DS2-VASc-Score >4 die Rate an Schlaganfällen/SE unter Apixaban 0,98% pro Jahr und unter Aspirin 2,25% pro Jahr betrug. In dieser Subgruppe verhinderte Apixaban über einen Zeitraum von 3,5 Jahren 1,28 Schlaganfälle/SE pro 100 Patientenjahre und verursachte 0,68 grössere Blutungen im Vergleich zu Aspirin, wobei die Zunahme der Blutungen statistisch nicht signifikant war. Bei Patienten mit einem CHA2DS2-VASc-Score >4 betrug die «number needed to treat» für einen Nutzen nach 3,5 Jahren 25, um 1 Schlaganfall/SE zu verhindern, und die «number needed to harm», um 1 grössere Blutung zu verursachen, 59. Die Autoren kamen zu dem Schluss, dass diese Höchstrisikopatienten mit NOAK behandelt werden sollten, da diese im Vergleich zu den schweren Blutungen fast doppelt so viele Schlaganfälle/SE zu verhindern scheinen. Bei Patienten mit einem CHA2DS2-VASc-Score <4 ist es unwahrscheinlich, dass die Patienten von der OAK profitieren, da sie ein geringes Schlaganfallrisiko haben und diese Behandlung mehr schwere Blutungen verursacht als sie Schlaganfälle/SE verhindert. Es gibt eine beträchtliche Zwischengruppe (CHA2DS2-VASc=4), bei der die Patientenpräferenzen bei der Behandlungsentscheidung helfen können (Abb. 3).
Abb. 3: Nutzen-Risiko-Abwägung bei der Behandlung von Geräte-detektiertem Vorhofflimmern mit Apixaban nach CHA2DS2-VASc-Score (adaptiert nach Lopes RD et al., 2024)18
Schlussfolgerungen
Bei Geräte-detektiertem VHF (DDAF) kann zurzeit keine allgemeine Empfehlung zum Beginn einer OAK gegeben werden. Bei ausgewählten Patienten, insbesondere solchen mit einem hohen individuellen Schlaganfallrisiko (CHA2DS2-VASc >4), kann der Einsatz von NOAK unter Berücksichtigung des erwarteten klinischen Nettonutzens und der informierten Patientenpräferenzen erwogen werden. Da zudem rund ein Viertel der Patienten innerhalb der folgenden 3 Jahre ein klinisches VHF (Dauer >24h) entwickeln wird, ist es ratsam, Patienten mit DDAF engmaschiger zu kontrollieren.
Literatur:
1 Van Gelder IC et al.: Eur Heart J 2024; 45: 3314-3414 2 Toennis T et al.: Europace 2023; 25: euad166 3 Hart RG et aI.: Ann Intern Med 2007; 146: 857-67 4 Ruff CT et al.: Lancet 2014; 383: 955-62 5 Eckman MH et al.: Circ Cardiovasc Qual Outcomes 2011; 4: 14-21 6 Glotzer TV et al.: Circ Arrhythm Electrophysiol 2009; 2: 474-80 7 Heale JS et al.:N Engl J Med 2012; 366: 120-9 8 Rahimi K: Eur Heart J 2017; 38: 1345-7 9 Svendsen JH et al.: Lancet 2021; 398: 1507-16 10 Lopes RD et al.: J Am Coll Cardiol 2024; 29: S0735-1097 11 Kemp Gudmundsdottir K et al.: Circulation 2024; doi: 10.1161/CIRCULATIONAHA.124.071176 12 Kirchhof P et al.: N Engl J Med 2023; 389: 1167-79 13 Healey JS et al.: N Engl J Med 2024; 390: 107-17 14 McIntyre WF et al.: Circulation 2024; 149: 981-8 15 McIntyre WF et al.: Circulation 2024; doi: 10.1161/CIRCULATIONAHA.124.069903 16 Becher N et al.: Eur Heart J 2024; 45: 837-49 17 Lip GYH et al.: Eur Heart J 2024; 45: 1733-7 18 Lopes RD et al.: J Am Coll Cardiol 2024; 84: 354-64
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Antibiotika bei Endokarditis: ambulante Fortsetzung der stationären Therapie
Nach einer erfolgreichen initialen stationären, parenteralen Antibiotikatherapie besteht bei vielen Patient:innen mit bakterieller Endokarditis die Option einer ambulanten ...