Hypertrophe Kardiomyopathie im Fokus – verstehen und behandeln
Autor:innen:
Dr. Julian Ehmsen
OÄ Dr. Maria Heger
2. Medizinische Abteilung für Kardiologie und internistische Intensivstation
Wiener Gesundheitsverbund, Klinik Landstraße
Die hypertrophe Kardiomyopathie (HCM) ist die häufigste erbliche Kardiomyopathie, die oft unbemerkt bleibt. Mit einer globalen Prävalenz von 1:500 und einem erhöhten Risiko für kardiovaskuläre Ereignisse bleiben die Diagnose und Behandlung dieser Krankheit eine Herausforderung.
Keypoints
-
Der Phänotyp einer HCM kann verschiedenste Ätiologien aufweisen. Die häufigste Ursache ist eine Mutation in Genen der kardialen Sarkomerproteine.
-
Die Echokardiografie nimmt eine Schlüsselrolle in der Phänotypenbeschreibung ein.
-
Für die Diagnosestellung und Differenzialdiagnostik ist häufig die Integration anderer Bildgebungen/Untersuchungen und/oder die Genetik essenziell.
-
Mavacamten ist eine „neue“ Therapieoption bei der HCM mit Obstruktion im LVOT.
Definition
Eine HCM besteht bei einer Dickenzunahme von ≥15mm in einem Myokardsegment, wenn diese Dickenzunahme nicht alleine durch abnormale Füllungszustände wie eine Aortenklappenstenose oder einen Hypertonus erklärbar ist. Bei Verwandten, genetischen Formen oder bei typischen EKG-Veränderungen kann jedoch auch schon eine geringere Wandverdickung (13–14mm) vorliegen.1 Klinisch werden Beschwerden wie Dyspnoe, Angina pectoris, Schwindel oder Synkope neben Herzrhythmusstörungen beschrieben.
Prävalenz
Die globale Prävalenz der HCM liegt bei 0,2%, dies entspricht ca. 20 Mio. Personen weltweit. Allerdings wird ein großer Teil davon, man schätzt 85–90%, nicht diagnostiziert. Etwa 60% der Betroffenen entwickeln Symptome.2–4 Patient:innen mit HCM haben nachweislich ein erhöhtes Risiko für kardiovaskuläre Ereignisse und die Gesamtmortalität ist etwa 4-mal höher als in der Allgemeinbevölkerung. Bei ca. 62% tritt Vorhofflimmern auf und das Risiko für einen plötzlichen Herztod liegt bei 1–2%.5–8
Ätiologie und Pathogenese
Dem Phänotypen einer HCM liegen verschiedene Ätiologien und Pathomechanismen zugrunde. Bei bis zu 60% der Patient:innen mit HCM-Phänotyp handelt es sich um eine autosomal-dominant vererbte Variante, die durch Mutationen in den Genen der kardialen Sarkomerproteine verursacht wird. Dadurch kommt es zur vermehrten Bildung von Aktin-Myosin-Querbrücken mit Hyperkontraktilität, eingeschränkter Relaxation, erhöhter Steifigkeit und Fibrose. Der Großteil der beschriebenen Mutationen findet in den schweren Ketten des Beta-Myosins (MYH7), des Myosinbindeproteins-C (MYBPC3), Troponin I (TNNI3) und des Troponin T (TNNT2) statt. Bei ca. 10% der Betroffenen hat der HCM-Phänotyp verschiedenste Ursachen, dabei sind Speichererkrankungen wie die Amyloidose, lysosomale Speichererkrankungen (M. Fabry, Danon-Erkrankung) oder auch Glykogenspeichererkrankungen am häufigsten. Bei ungefähr 30% der Patient:innen bleibt die Genese ungeklärt.9
Obstruktion im linksventrikulären Ausflusstrakt (LVOTO)
Die Identifizierung einer LVOTO ist wichtig für das Management von Symptomen und in der Evaluierung des „Sudden cardiac death“(SCD)-Risikos. Etwa 37% haben eine Obstruktion in Ruhe, während 70% nur unter Provokation eine Obstruktion entwickeln.10 Die Verengung im Ausflusstrakt ist bedingt durch die Hypertrophie und durch anatomische Veränderungen des Mitralklappenapparates. Typisch ist ein „Daggerd shape“-Flusssignal im CW-Doppler sowie ein SAM(„systolic anterior motion“)-Phänomen des vorderen Mitralklappensegels. Wenn der Gradient >30mmHg ist, liegt eine Obstruktion vor.
Diagnosefindung
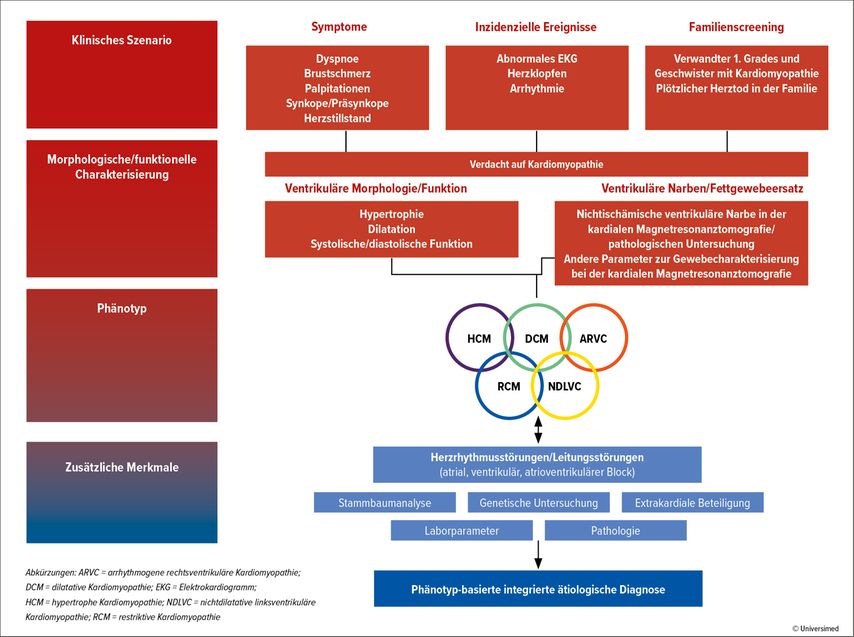
Kardiomyopathien werden, nach den aktuellen ESC Guidelines 2023 für das Management von Kardiomyopathien, in fünf verschiedene Phänotypen eingeteilt: die hypertrophe Kardiomyopathie (HCM), dilatative Kardiomyopathie (DCM), nichtdilatative linksventrikuläre Kardiomyopathie (NDLVC), arrhythmogene rechtsventrikuläre Kardiomypopathie (ARVC) und die restriktive Kardiomyopathie (RCM) (Abb. 1).1
Bei Auftreten von Symptomen wie Dyspnoe, Brustschmerzen, Palpitationen, Synkopen sowie bei Vorliegen von pathologischen EKG-Veränderungen oder auskultatorischen Auffälligkeiten, wird eine Bildgebung wie Echokardiografie und oder Magnetresonanztomografie (MRI) empfohlen. Des Weiteren werden genetische Untersuchungen und Laborparameter empfohlen und die Familienanamnese/der Familienstammbaum erhoben.
Die Bestimmung des Phänotyps (HCM, DCM, NDLVC, ARVC, RCM) stellt an sich keine Diagnosestellung dar, sondern ist eine Beschreibung der Morphologie aus der kardialen Bildgebung. Die Ätiologie bzw. den Pathomechanismus gilt es für die Diagnosestellung mit weiteren Untersuchungen zu bestimmen. Deshalb sollte der systematische Ansatz nicht bei der Bildgebung enden. Besonders der Genetik wird ein hoher Stellenwert zugeschrieben, diese soll bei allen Patient:innen mit Kardiomyopathie erhoben werden, die hinsichtlich Diagnose, Prognose und Therapie davon profitieren (Klasse-1B-Empfehlung).1
Stellenwert der Echokardiografie
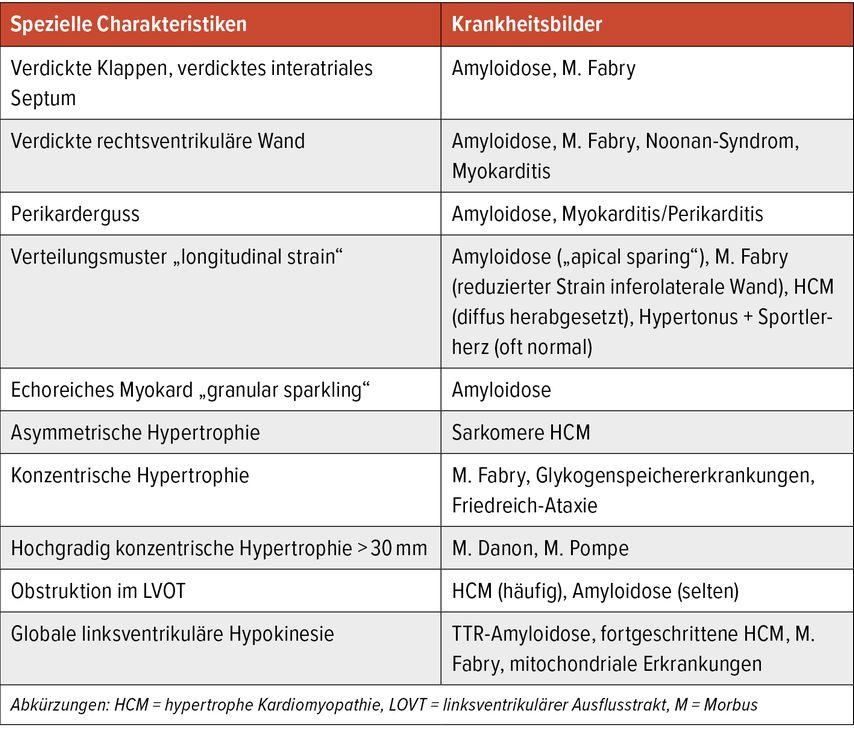
Als erstes und wichtigstes Diagnostikum wird die Echokardiografie angewendet. Es gibt spezielle bildgebende Merkmale, die auf eine bestimmte Ätiologie der HCM hinweisen können, jedoch für sich alleine nicht diagnosesichernd sind (Tab. 1). In der transthorakalen Echokardiografie sollte neben der systolischen und diastolischen Funktion, Klappenbeschreibung, Herzkammergrößen und dem systolischen Pulmonalarteriendruck (sPAP) ein besonderes Augenmerk auf der exakten Messung der maximalen Wanddicke liegen. Diese erfolgt enddiastolisch und Messungen aus verschiedenen Herzachsenansichten sind empfohlen. Typisch bei der HCM ist eine asymmetrische Verteilung der Hypertrophie. Die Messung der linksventrikulären Masse kann aufgrund der isolierten asymmetrischen Verteilung der Hypertrophie bei bis zu 20% normal sein.11
Tab. 1: Echokardiografische Charakteristiken, die auf eine bestimmte Ätiologie der HCM hinweisen (modifiziert nach Arbelo E et al. 2023)1
Die Identifizierung einer LVOTO wichtig für das Management von Symptomen und in der Evaluierung des Risikos für einen „sudden cardiac death“ (SCD). Eine 2D-Analyse zur Identifizierung eines SAM-Phänomens und eine Dopplermessung sollen sowohl in Ruhe als auch unter Valsalva-Manöver bzw. „Stress“ durchgeführt werden. Bei eingeschränkten Schallbedingungen und/oder dem Verdacht einer apikalen HCM erweist sich der Einsatz von linksgängigem Kontrastmittel als hilfreich. In einer Arbeit von Yang et al. wurden 1332 Patient:innen mit MRT gesicherter apikaler HCM retrospektiv analysiert. Wenige (2,3%) hatten ein apikales Aneurysma, jedoch wurden 65% der apikalen Aneurysmen nicht in der Echokardiografie diagnostiziert.12 Unter Verwendung von Strainanalysen, insbesondere des Global Longitudinal Strains (GLS), wird die globale und regionale Kontraktilität des Myokards noch exakter bestimmt. Bei noch erhaltener systolischer Linksventrikelfunktion kann der GLS bereits reduziert sein. Auf diese Weise können myokardiale Schäden früher erkannt werden. Ebenso gibt es bei abnormalem GLS eine Assoziation mit erhöhten kardialen Ereignissen und Arrhythmien.13
Speicherkrankheiten wie Amyloidose oder M. Fabry weisen in der Strainanalyse spezielle Verteilungsmuster auf. Dies kann in der Differenzialdiagnostik hilfreich sein. Ein reduzierter linksatrialer Vorhofstrain bei der HCM kann außerdem ein Prädiktor für De-novo-Vorhofflimmern sein.14
Stellenwert der kardialen Magnetresonanztomografie
Neben der Echokardiografie wird der Einsatz der kardialen Magnetresonanztomografie (MRI) bei allen Kardiomyopathiephänotypen empfohlen (Klasse-1B-Empfehlung).1 Kardiale MRI kombiniert den Vorteil einer nicht invasiven Bildgebung mit einer Gewebecharakterisierung. Besonders hilfreich ist sie, wenn echokardiografisch schlechte Schallbedingungen vorliegen und, um Regionen zu beurteilen die in der Echokardiografie oft schlecht einsehbar sind, wie die anterolaterale Wand oder der linksventrikuläre Apex. Die Verteilung des „late gadolinium enhancement“ (LGE) und das Vorhandensein einer Fibrose hilft in der Differenzialdiagnostik und Diagnosefindung.
Therapie
Grundsätzlich kommt es bei der HCM aufgrund von zwei Mechanismen zur Herzinsuffizienz, zum einen der obstruktive Phänotyp und zum anderen die Progression der Erkrankung mit Fibrose bis hin zum Endstadium. Viele Patient:innen mit HCM bleiben allerdings asymptomatisch und haben eine normale Lebenserwartung. Einige entwickeln Symptome erst Jahre, nachdem ein pathologisches EKG oder eine Linksventrikelhypertrophie festgestellt wurde.
Da es nur wenige randomisierte Studien gibt, baut die pharmakologische Therapie auf einer empirischen Basis auf und dient in erster Linie der Reduktion von Symptomen.
Therapie bei obstruktiver HCM
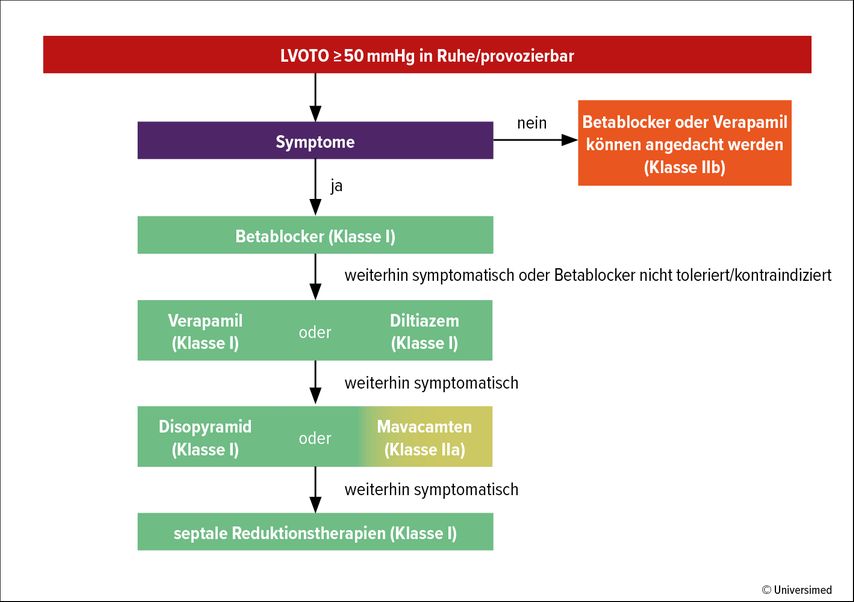
Bei Vorliegen einer relevanten Obstruktion im LVOT (>50mmHg) soll eine medikamentöse Therapie eingeleitet werden (Abb. 2). Therapeutisch wird der Einsatz von Betablocker oder Verapamil/Diltiazem empfohlen. Neuerdings ist Mavacamten, ein reversibler Kardiomyosin-Inhibitor, verfügbar. Diese Therapien können singulär oder auch in Kombination verabreicht werden. Als invasive Therapien stehen die Myektomie oder Alkoholablation zur Verfügung. Der Großteil der asymptomatischen Patient:innen mit LVOTO benötigt keine Therapie.
Therapie bei nicht obstruktiver HCM
Praxistipp
Bei einer Myokarddicke von ≥ 15 mm sollte man an das Vorliegen einer hypertrophen Kardiomyopathie denken. Die Identifizierung, ob eine Obstruktion im linksventrikulären Ausflusstrakt vorliegt, ist hinsichtlich der Therapie wichtig.Die Therapie bei symptomatischen Patient:innen ohne LVOTO (nichtobstruktive HCM) konzentriert sich auf die Behandlung von Arrhythmien, Senkung des LV Füllungsdrucks und die Behandlung von Angina pectoris. Dabei sollen Betablocker oder Ca-Antagonisten (Verapamil/Diltiazem) in Erwägung gezogen werden.1 Die Behandlung der Herzinsuffizienz bei der nichtobstruktiven HCM wird entsprechend den „2021 ESC Guidelines zur Diagnose und Behandlung der akuten und chronischen Herzinsuffizienz“ empfohlen, bei reduzierter EF mit den „fantastic four“ (Betablocker, ACE-Hemmer bzw. ARNI, Mineralokortikoid-Rezeptor-Antagonisten, SGLT2-Hemmer).
Evaluierung eines implantierbaren kardioverten Defibrillator
Bezüglich des Risikos für maligne Herzrhythmusstörungen muss eine Evaluation bezüglich Notwendigkeit eines implantierbaren kardioverten Defibrillators (ICD) erfolgen. Hier spielen unter anderem das Alter, die maximale Wanddicke, der maximale Gradient im LVOT, die Familienanamnese für einen SCD, Synkopen sowie Rhythmusstörungen eine Rolle. Als nützliches Tool im klinischen Alltag kann der HCM Risk-SCD Calculator der ESC verwendet werden.1
Literatur:
1 Arbelo E et al.: 2023 ESC Guidelines for management of cardiomyopathies. European Heart Journal 2023; 44(37): 3503-3626 2 Semsarian C et al.: New perspectives on the prevalence of hypertrophic cardiomyopathy. Journal of the American College of Cardiology 2015; 65(12): 1249-54 3 Maron BJ et al.: Global burden of hypertrophic cardiomyopathy. JACC Heart Failure 2018; 6(5): 376-8 4 Maron BJ: Clinical course and management of hypertrophic cardiomyopathy. New England Journal of Medicine 2018; 379(7): 655-68 5 Ho CY et al.: Genotype and lifetime burden of disease in hypertrophic cardiomyopathy: insights from the Sarcomeric Human Cardiomyopathy Registry (SHaRe). Circulation 2018; 138(14): 1387-98 6 Rowin EJ, Maron BJ et al.: Interaction of adverse disease-related path-ways in hypertrophic cardiomyopathy. American Journal of Cardiol 2017; 120(12): 2256-64 7 Lorenzini M et al.: Mortality among referral patients with hypertrophic cardiomyopathy vs the general European population. JAMA Cardiology 2020; 5(1): 73-80 8 Fumagalli C et al.: Association of obesity with adverse long-term outcomes in hypertrophic cardiomyopathy. JAMA Cardiol 2020; 5(1): 65-72 9 Elliott P et al.: 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. European Heart J 2014; 35(39): 2733-79 10 Maron MS et al.: Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation 2006; 114(21): 2232-9 11 Olivotto I et al.: Assessment and significance of left ventricular mass by cardiovascular magnetic resonance in hypertrophic cardiomyopathy. Journal of American College of Cardiology 2008; 52(7): 559-66 12 Yang K et al.: Apical hypertrophic cardiomyopathy with left ventricular apical aneurysm: prevalence, cardiac magnetic resonance characteristics, and prognosis. Eur Heart J Cardiovasc Imaging 2020; 21(12): 1341-50 13 Tower-Rader A et al.: Prognostic value of global longitudinal strain in hypertrophic cardiomyopathy: A systematic review of existing literature. JACC Cardiovasc Imaging 2019; 12(10): 1930-42 14 Debonnaire P et al.: Left atrial size and function in hypertrophic cardiomyopathy patients and risk of new-onset atrial fibrillation. Circ Arrhythm Electrophysiol 2017; 10(2): e004052
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Neue Wege in der Diagnostik des Vorhofflimmerns
Vorhofflimmern ist die häufigste Rhythmusstörung unserer Zeit. Die Folgen reichen von eingeschränkter Lebensqualität und Belastbarkeit bis zu schwerwiegenden Komplikationen wie ...