Morbus Fabry: wichtige Differenzialdiagnose der hypertrophen Kardiomyopathie
Autoren:
Dr. Christoph C. Kaufmann1
OA Dr. Heda Kvakan1
Prim. Univ.-Prof. Dr. Kurt Huber1,2
PD Dr. Bernhard Jäger1
13. Medizinische Abteilung mit Kardiologie und internistischer Intensivmedizin, Klinik Ottakring
2Medizinische Fakultät der Sigmund-Freud-Privat-Universität, Wien
E-Mail: Christoph.C.Kaufmann@gmail.com
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Morbus Fabry ist eine X-chromosomal vererbte lysosomale Speichererkrankung, die durch einen Multiorganbefall gekennzeichnet ist. Da eine frühe Diagnosestellung mit einer besseren Prognose assoziiert ist, ist das Erkennen von Symptomen und Zeichen eines Morbus Fabry im Frühstadium essenziell. Aktuell stehen mit der Enzymersatztherapie sowie der Chaperontherapie zwei klinisch validierte Behandlungsmöglichkeiten zur Verfügung.
Keypoints
-
Bei typischen extrakardialen und kardialen „Red flags“ an die Diagnose Morbus Fabry denken.
-
Die Diagnose Morbus Fabry kann durch Messung der Enzymaktivität und genetische Sequenzierung gestellt werden.
-
An kausalen Therapieoptionen stehen beim Morbus Fabry die Enzymersatztherapie sowie die Chaperon-Therapie zur Verfügung.
-
Das klinische Management eines Morbus-Fabry-Patienten sollte an einem geeigneten Zentrum erfolgen, beispielsweise bei Überwiegen der kardialen Beschwerden an einer kardiologischen Abteilung mit Herzinsuffzienz-Ambulanz.
Pathophysiologie & Genetik
Morbus Fabry ist eine X-chromosomal vererbte lysosomale Speichererkrankung, die durch den Befall multipler Organe im Sinne einer Multisystemerkrankung gekennzeichnet ist. Mutationen des X-Chromosoms führen zu einer signifikanten Reduktion bis zum gänzlichen Entfall der Enzymaktivität der Alpha-Galactosidase A (GLA), was zur lysosomalen Akkumulation von Sphingolipiden, primär Globotriaosylceramid (Gb3), führt. Typischerweise kommt es zu einer Ablagerung in den Endothelzellen verschiedenster Organe, die je nach Ausmaß des Befalls typische Symptome und Zeichen eines Morbus Fabry verursacht.1
Der X-chromosomale Vererbungsgang beim Morbus Fabry ist durch eine vollständige Penetranz von betroffenen Männern auf Töchter gekennzeichnet (100% der Töchter und 0% der Söhne). Bei betroffenen Frauen kommt es zu einer 50%igen Penetranz unabhängig vom Geschlecht der Nachkommen (50% der Töchter und 50% der Söhne). Bislang wurden mehr als 1000 pathogene Mutationen beschrieben, die zur Manifestation der Multisystemerkrankung Morbus Fabry geführt haben. Männer mit vererbter Mutation werden als hemizygot bezeichnet und sind häufig von einem früheren Krankheitsbeginn betroffen. Der klinische Phänotyp von heterzygoten Frauen hingegen ist stark abhängig von der zufälligen Inaktivierung eines der beiden X-Chromosomen (Lyonisierung) und weist deshalb ein Mosaik aus mutierten und normalen Zellen in den einzelnen Organsystemen auf, die zu unterschiedlich ausgeprägten klinischen Manifestationen führen.2
Prävalenz
Der häufig unspezifische Krankheitsverlauf und das mangelnde allgemeine Bewusstsein zur Differenzialdiagnose Morbus Fabry führen zu einer hohen Dunkelziffer. Rezente Studiendaten aus dem kardiovaskulären Themenbereich weisen bei Patienten mit ungeklärter Linksventrikelhypertrophie eine Prävalenz von knapp 1% auf. Daten aus Fabry-Analysen im Rahmen von Neugeborenen-Screenings zeigen jedoch eine deutlich höhere Inzidenz an pathogenen Mutationen als bislang angenommen.3,4
Diagnosestellung
Bei klinischem Verdacht auf das Vorliegen eines Morbus Fabry ist eine zeitgerechte diagnostische Abklärung essenziell, da ein frühes Erkennen der Erkrankung, bedingt durch den damit gegebenen früheren Therapiestart, mit einer besseren Prognose einhergeht. Bei Männern ist die Bestimmung der GLA-Aktivität mittels einfachen Bluttests in der Regel ausreichend um die Diagnose Morbus Fabry zu sichern. Bei Frauen hingegen liegt aufgrund des heterozygoten Befalls häufig noch eine Enzymrestaktivität vor, sodass in manchen Fällen grenzwertig normale GLA-Spiegel trotz manifester Fabry-Erkrankung vorliegen können. Folglich ist zur Diagnosesicherung bei Frauen die genetische Analyse notwendig, wobei letztlich auch bei Männern die genetische Sequenzierung obligat geworden ist, da sich diverse prognostische und therapeutische Implikationen aus der Mutationsanalyse ergeben.5
Klinische Präsentation
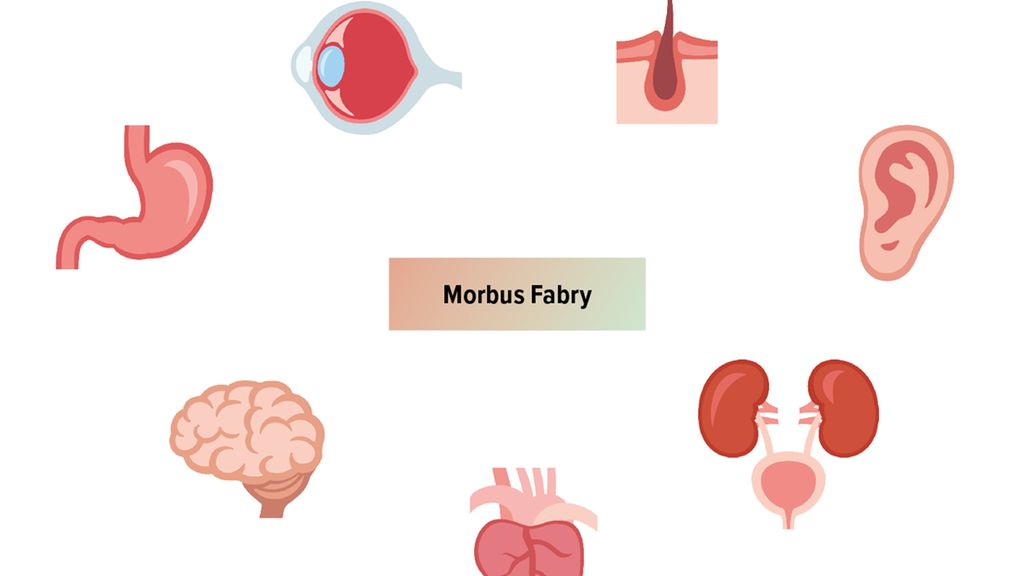
Abbildung 1 zeigt typische Symptome und Zeichen der Multisystemerkrankung Morbus Fabry. Bezüglich der klinischen Manifestationsformen des Morbus Fabry wird der klassische Phänotyp mit Symptombeginn im jungen Alter und typischer Multisystemerkrankung vom atypischen beziehungsweise später auftretenden Phänotyp unterschieden, der primär durch eine kardiale oder renale Beteiligung gekennzeichnet ist und im höheren Alter auftritt. Frauen sind aufgrund der höheren Enzymrestaktivitäthäufiger von einem späteren Krankheitsbeginn betroffen, wobei auch Frauen einen klassischen Phänotyp aufweisen können.6
Der typische Morbus-Fabry-Patient vom klassischen Phänotyp ist männlich, jung und klagt unter anderem über neuropathische Schmerzen, die sich häufig mit akuten Schmerzexazerbationen an den Händen oder Füßen manifestieren, Parästhesien, Hypohidrose, unspezifische gastrointestinale Störungen, gutartige erythematöse Hautveränderungen in der Gesäß- oder Leistenregion (Angiokeratome) sowie Hornhauttrübungen (Cornea verticillata) mit verstärkter vaskulärer Zeichnung der Bindehautgefäße. Typischerweise später auftretende Symptome des Morbus Fabry umfassen eine progrediente renale Schädigung, die sich als Albuminurie, Proteinurie und letztlich Reduktion der glomerulären Filtrationsrate manifestiert, eine kardiale Beteiligung mit progredienter linksventrikulärer Hypertrophie und zerebrovaskuläre Komplikationen, wie kryptogene Insulte oder transitorische ischämische Attacken.7
Kardiale Diagnostik bei Morbus Fabry
Im Elektrokardiogramm (EKG) können erste Hinweise auf das Vorliegen einer kardialen Mitbeteiligung bei Morbus Fabry gefunden werden, die jedoch durch eine niedrige Sensitivität und Spezifität limitiert sind. Im Gegensatz zur kardialen Amyloidose ist bei Fabry-Patienten in der Regel ein positiver Sokolow-Index als Ausdruck der Linksventrikelhypertrophie (LVH) mit sekundären Repolarisationsstörungen erkennbar. Weiters sind aufgrund einer Beteiligung des Reizleitungssystems gehäuft bradykarde Herzrhythmusstörungen (Sick-Sinus-Syndrom oder atrioventrikuläre Blockierungen) sowie eine Verkürzung der PQ-Zeit ohne Vorliegen eines akzessorischen Bündels anzutreffen.8
Die Echokardiografie zeigt bei Patienten mit fortgeschrittener Morbus-Fabry- Erkrankung zumeist eine konzentrische LVH unter Einbeziehung der Papillarmuskeln. Die konventionell erhobene systolische Linksventrikelfunktion ist üblicherweise normal, wobei in manchen Fällen bereits ein reduzierter globaler longitudinaler Strain als Ausdruck einer beginnenden kardialen Beteiligung des Morbus Fabry erhoben werden kann. Weiters werden geringgradige Verdickungen von Aorten- und Mitralklappe sowie eine leichtgradige Dilatation der Aortenwurzel bei Patienten mit Morbus Fabry beschrieben.9
Die kardiale Magnetresonanztomografie (MRT) gilt als Goldstandard in der Differenzialdiagnostik der LVH und trägt auch beim Morbus Fabry entscheidend zur Diagnosestellung bei. Die echokardiografisch beschriebene LVH kann anhand des MRT genauer quantifiziert werden, was insbesondere bei eingeschränkten Schallbedingungen von besonderer Relevanz ist. Weiters führt die myokardiale Gb3-Akkumulation zu einer signifikanten Reduktion der T1-Relaxationszeiten – ein Befund, der für das Vorliegen eines Morbus Fabry im Kontext einer LVH fast pathognomisch ist. Studien bei Morbus-Fabry-Patienten zeigten, dass auch bei noch normaler linksventrikulärer Wanddicke eine Reduktion der T1-Relaxationszeit vorliegen kann, sodass die T1-gewichteten Sequenzen insbesondere in der Frühdiagnostik einer kardialen Mitbeteiligung eine wichtige Rolle spielen. In späteren Stadien können typischerweise posterolaterale Kontrastmittelanreicherungen („late gadolinium enhancements“), als Ausdruck fibrotischer Veränderungen, im kardialen MRT festgestellt werden.10
Diese typischen kardialen Befunde im EKG, im Echokardiogramm und in der Magnetresonanztomografie sind in Tabelle 1 dargestellt.
Therapie und Management
Prinzipiell ist das Etablieren einer klassischen Herzinsuffizienztherapie bei Patienten mit Morbus Fabry sinnvoll, wobei auf die kardialen Besonderheiten der Speichererkrankung geachtet werden sollte. Die häufige renale Beteiligung kann die Erstverschreibung und Aufdosierung von Antagonisten des Renin-Angiotensin-Systems erschweren. Gb3-Akkumulationen im Reizleitungssystem sind mit einem erhöhten Risiko für bradykarde Herzrhythmusstörungen assoziiert, was bei Etablierung von Betablockern oder sonstigen antiarrhythmischen Therapien zu beachten ist.5
Aktuell stehen in der Klinik zwei medikamentöse Behandlungsmöglichkeiten für eine kausale Therapie des Morbus Fabry zur Verfügung: die Enzymersatztherapie (Agalsidase alpha und Agalsidase beta), die alle zwei Wochen in Form einer intravenösen Injektion verabreicht wird, sowie die Chaperon-Therapie (Migalastat), die jeden zweiten Tag als orale Formulierung eingenommen wird.
Bei der Enzymersatztherapie blickt man auf über 20 Jahre Erfahrung zurück und es konnte wiederholt gezeigt werden, dass es zu einer signifikanten Abnahme der Gb3-Akkumulation im kapillaren Endothel von Niere, Herz und Haut unter laufender Therapie kommt. Überdies konnte insbesondere bei Therapiebeginn in frühen Krankheitsstadien eine Besserung der LVH beobachtet werden. Seit wenigen Jahren besteht überdies die Möglichkeit der Chaperon-Therapie, die über eine Stabilisierung der fehlgefalteten Alpha-Galactosidase A zu einer signifikanten Reduktion der Gb3-Akkumulation führt. Anders als die Enzymersatztherapie ist die Chaperon-Therapie aber nur bei bestimmten Mutationen anwendbar (z.B. p.R112H, p.M248T, p.R301Q).
Weitere Therapiemöglichkeiten werden in klinischen Studien untersucht, wie beispielsweise die Ex-vivo- und In-vivo-Gentherapie sowie die Substratreduktionstherapie. Diese Substanzen sind jedoch noch nicht in der klinischen Routine einsetzbar und sind dementsprechend als experimentell anzusehen.6,11,12
Letztlich ist zu betonen, dass die Therapieerstverschreibung und das weitere „Follow-up“ der Patienten in einem spezialisierten Zentrum unter einem interdisziplinären Managementaspekt erfolgen sollten.
Literatur:
1 Tuttolomondo A et al.: Pathogenesis and molecular mechanisms of Anderson-Fabry disease and possible new molecular addressed therapeutic strategies. Int JMol Sci 2021; 22: 10088 2 Bernardes TP et al.: Fabry disease: genetics, pathology, and treatment. Rev Assoc Med Bras (1992) 2020; 66(Suppl 1): s10-s16 3 Doheny D et al.: Fabry disease: prevalence of affected males and heterozygotes with pathogenic GLA mutations identified by screening renal, cardiac and stroke clinics, 1995-2017. J Med Genet 2018; 55: 261-68 4 Sawada T et al.: Newborn screening for Fabry disease in the western region of Japan. Mol Genet Metab Rep 2020; 22: 100562 5 Linhart A et al.: An expert consensus document on the management of cardiovascular manifestations of Fabry disease. Eur J Heart Fail 2020; 22: 1076-96 6 Pieroni M et al.: Cardiac involvement in Fabry disease: JACC Review Topic of the Week. J Am Coll Cardiol 2021; 77: 922-36 7 Mehta A, Widmer U: Natural history of Fabry disease. In: Mehta A, Beck M, Sunder-Plassmann G, eds. Fabry disease: perspectives from 5 years of FOS Oxford: Oxford PharmaGenesis; 2006 8 Vitale G et al.: Standard ECG for differential diagnosis between Anderson-Fabry disease and hypertrophic cardiomyopathy. Heart 2021; heartjnl-2020-318271 9 Yeung DF et al.: Echocardiographic assessment of patients with Fabry disease. J Am Soc Echocardiogr 2018; 31: 639-49.e2 10 Burrage MK, Ferreira VM: Cardiovascular magnetic resonance for the differentiation of left ventricular hypertrophy. Curr Heart Fail Rep 2020; 17: 192-204 11 Germain DP et al.: Treatment of Fabry’s disease with the pharmacologic chaperone Migalastat. N Engl J Med 2016; 375: 545-55 12 Germain DP et al.: Sustained, long-term renal stabilization after 54 months of agalsidase beta therapy in patients with Fabry disease. J Am Soc Nephrol 2007; 18: 1547-57
Das könnte Sie auch interessieren:
Mechanische Kreislaufunterstützung im Infarkt-bedingten kardiogenen Schock
Der Infarkt-bedingte kardiogene Schock (AMI-CS) ist trotz der enormen Fortschritte in der interventionellen Versorgung des akuten Myokardinfarktes in den vergangenen Jahrzehnten ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...