Herzrhythmusstörungen
Autor:
Prim. Univ.-Doz. Dr. Franz Xaver Roithinger
Leiter Abteilung für Innere Medizin
Kardiologie und Nephrologie
Landesklinikum Wiener Neustadt
Herzrhythmusstörungen sind ein häufiges medizinisches Problem und aufgrund der vielfältigen klinischen Präsentation – von der asymptomatischen Extrasystole bis zum plötzlichen Herztod – in jeder internistischen Institution relevant. Eine exakte Anamnese, die Beurteilung, ob eine strukturelle Herzerkrankung vorliegt, und die EKG-Dokumentation der Rhythmusstörung sind entscheidend für die sinnvolle Einleitung spezifischer therapeutischer Maßnahmen.
Keypoints
-
Eine exakte Anamnese und die Dokumentation der Rhythmusstörung unter Zuhilfenahme aller modernen Speichermethoden sind essenziell.
-
Vor jeder Behandlung einer Rhythmusstörung stellt sich immer die Frage: Ist der Patient herzgesund oder strukturell krank?
-
Ist der Patient strukturell herzgesund, ist eine Herzrhythmusstörung in der Regel nicht gefährlich, und die Entscheidung über die gewählte Therapie ist abhängig vom Leidensdruck des Patienten.
-
Die Differenzialdiagnose von tachykarden Rhythmusstörungen ist immer spannend – die tägliche Praxis des Rhythmologen wird aber das Vorhofflimmern bestimmen.
Supraventrikuläre Tachykardien
Einleitung, Definition und Klassifikation
Supraventrikuläre Tachykardien treten häufig bei Patienten ohne strukturelle Herzerkrankung auf, dementsprechend ist bei der großen Mehrzahl dieser Patienten die Prognose günstig und die Therapieentscheidung von der Symptomatik abhängig. Von einer supraventrikulären Tachykardie (SVT) spricht man ab einer atrialen Frequenz >100/min. Die konventionelle Klassifikation findet sich in Tabelle 1. Vorhofflimmern, fokale und multifokale atriale Tachykardien oder Vorhofflattern mit wechselnder AV-Überleitung können arrhythmisch sein, die übrigen Tachykardien sind rhythmisch.
Differenzialdiagnosen
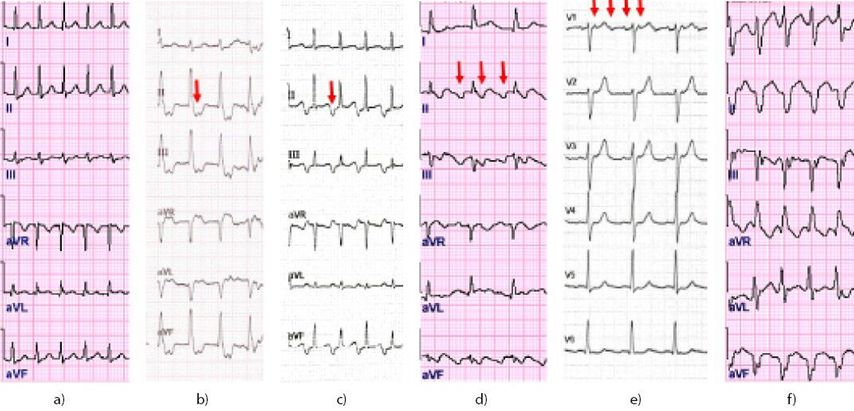
Ist in der rhythmischen Schmalkomplex-Tachykardie die P-Welle nicht sichtbar, liegt meist eine typische AV-Knoten-Reentry-Tachykardie (AVNRT; Abb. 1a) oder eine junktionale Tachykardie vor. Ist bei sichtbarer P-Welle die atriale Frequenz höher als die ventrikuläre, handelt es sich um Vorhofflattern oder eine fokale atriale Tachykardie (Abb. 1d, 1e). Liegt die P-Welle näher zum vorangegangenen QRS-Komplex, liegt meist eine AV-Reentry-Tachykardie vor (WPW; Abb 1b). Liegt die P-Welle näher zum folgenden QRS-Komplex („long RP“), handelt es sich um eine fokale atriale Tachykardie, eine atypische AVNRT oder eine permanente junktionale Tachykardie (Abb. 1c). Der Effekt von Adenosin kann in der Differenzialdiagnose hilfreich sein: Vorhofflattern und fokale Tachykardien zeigen meist eine persistierende atriale Tachykardie mit AV-Blockierung.
Akut-Management
Nach Registrierung eines 12-Ableitungs-EKGs sind bei einer Tachykardie mit schlanken Kammerkomplexen (QRS≤120ms) vagale Manöver indiziert. Am effektivsten sind diese bei der AVNRT: Carotis-Massage (einseitig, 5 Sekunden, außer bei Patienten mit Insultanamnese und Strömungsgeräusch) oder den Patienten in eine 10-ml-Spritze blasen lassen. Wenn sich die Manöver als ineffektiv erweisen, ist die Gabe von 6–18ml Adenosin im Bolus empfohlen. Bei Nichtansprechen oder Rezidiv nach Adenosin sind intravenös Verapamil, Diltiazem, Esmolol oder Metoprolol empfohlen.
Eine Tachykardie mit breiten Kammerkomplexen (QRS>120ms) ist differenzialdiagnostisch eine ventrikuläre Tachykardie (Abb. 1f), eine SVT mit aberranter Leitung (oder vorbestandenem Schenkelblock) oder eine antidrome AVRT bei WPW (sehr selten!). Empfohlen sind vagale Manöver und die Kardioversion bei instabilen Patienten oder Therapieversagen, Adenosin oder Amiodaron; Verapamil ist kontraindiziert.
Sinustachykardien
Bei appropriaten Sinustachykardien (positive P-Welle in I und II) gilt es, reversible Ursachen zu finden und zu behandeln. Bei der inappropriaten Sinustachykardie sind bei symptomatischen Patienten Betablocker und/oder Ivabradin empfohlen. Sinusknoten-Reentry-Tachykardien (sehr selten!) können mittels Katheterablation oder Verapamil oder Diltiazem behandelt werden. Beim „POTS-Syndrom“ (orthostatische Tachykardie) sind ein konsequentes Ausdauertraining, ausreichend Flüssigkeit und Salz, ein nicht kardioselektiver Betablocker oder Ivabradin empfohlen.
Fokale atriale Tachykardien
Definitionsgemäß handelt es sich um einen fokalen Ursprung der elektrischen Aktivität, mit zentrifugaler Ausbreitung (abnorme Automatie oder Mikro-Reentry), die P-Welle ist meist näher dem folgenden QRS-Komplex („long RP“). Akut ist die Gabe von Adenosin, Esmolol oder Metoprolol, Verapamil oder Diltiazem oder Ibutilid, Flecainid, Propafenon oder Amiodaron empfohlen, bei hämodynamischer Instabilität oder Therapieversagen die Kardioversion. Bei rezidivierenden Tachykardien sind die Katheterablation oder die oben angeführte Medikation empfohlen. Die multifokale atriale Tachykardie ist eine seltene Rhythmusstörung, definiert als schnelle, unregelmäßige Tachykardie mit zumindest 3 verschiedenen P-Wellen-Morphologien. Die Ursache ist meist eine dekompensierte Lungenerkrankung, die Behandlung der zugrunde liegenden Ursache ist erstes Ziel, medikamentös sind Betablocker, Verapamil und Diltiazem empfohlen.
Makroreentry-Tachykardien
Die häufigste rechtsatriale Makroreentry-Tachykardie ist das typische isthmusabhängige Vorhofflattern mit Erregungskreis rund um den Trikuspidalring, häufiger entgegen dem Uhrzeigersinn („counter-clockwise“; Abb 1d). Prinzipiell ist eine Antikoagulation empfehlenswert, die Frequenzkontrolle erfolgt mittels Betablocker, die Terminierung der Rhythmusstörung mittels i.v. Gabe von Ibutilid, elektrischer Kardioversion (<100J biphasisch) oder Überstimulation, wenn der Patient bereits einen Schrittmacher oder ICD implantiert hat. Nach der ersten Episode sollte, nach der zweiten Episode muss eine Katheterablation erfolgen. Atypisches Vorhofflattern basiert auf einem meist linksatrialen Erregungskreis, in Zeiten der Vorhofflimmerablation meist auf der Basis einer ambitionierten linksatrialen Ablation (Abb. 1e). Die Rhythmusstörung ist meist therapierefraktär, die Ablation in erfahrenen Zentren ist empfohlen, wenn die Frequenzkontrolle unbefriedigend bleibt. Auch die Schrittmacherimplantation und eine AV-Knoten-Ablation sollten überlegt werden („ablate and pace“).
Abb. 1: EKG-Beispiele für rhythmische Tachykardien (6 Ableitungen; Pfeile markieren retrograde P-Wellen [b, c] oder Flatter-Wellen [d, e]); a: AVNRT; b: orthodrome WPW-Tachykardie; c: PJRT; d: rechtsatriales Vorhofflattern; e: linksatriales Vorhofflattern; f: ventrikuläre Tachykardie
AV-Knoten-Reentry-Tachykardien (AVNRT)
Das Paradigma der SVT ist die typische AV-Knoten-Reentry-Tachykardie: häufiger bei Frauen, zunehmende Häufigkeit der Episoden mit steigendem Lebensalter. Vagale Manöver funktionieren meist, Adenosin muss zumindest kurzfristig effektiv sein, wenn es ausreichend dosiert und ausreichend rasch injiziert wird. Sowohl akut als auch chronisch können natürlich Betablocker, Verapamil oder Diltiazem gegeben werden, bei einer Erfolgsaussicht ≥90% und einer Komplikationsrate ≤1% ist die Ablation die Therapie der Wahl.
AV-Reentry-Tachykardien (AVRT)
Eine AVRT basiert auf einem Erregungskreis zwischen einer akzessorischen Leitungsbahn (Kent-Bündel, WPW) und dem AV-Knoten. In >95% der Fälle wird der AV-Knoten antegrad und die akzessorische Bahn retrograd erregt, somit zeigt das EKG eine Schmalkomplex-Tachykardie, die häufig auch von Kardiologen nicht von einer AVNRT unterschieden werden kann und in puncto akuter Therapieempfehlung auch nicht unterschieden werden muss: Akutes Ziel ist die Blockade der Erregung im AV-Knoten mit Vagusmanöver, Adenosin oder Betablocker, Verapamil oder Diltiazem. Die chronische Therapie der AVRT ist die Katheterablation, vor allem bei Patienten mit WPW und Vorhofflimmern (50% – potenziell bedrohlich).
Asymptomatisches WPW-Syndrom
Statistisch wird nur jeder 5. Patient mit einer Delta-Welle im Oberflächen-EKG eine Rhythmusstörung entwickeln: 80% davon eine AVRT, 20–30% Vorhofflimmern. Problematisch ist, dass tachykard übergeleitetes Vorhofflimmern in seltenen Fällen Kammerflimmern induzieren und einen plötzlichen Herztod zur Folge haben kann. Das statistische Risiko für eine lebensbedrohliche Rhythmusstörung wird mit 2,4 pro 1000 Patienten-Jahre angegeben. Das Risiko für einen asymptomatischen 30-Jährigen mit Delta-Welle im EKG, plötzlich am Kammerflimmern zu sterben, beträgt somit ungefähr 1:8000. Bei Menschen in einer Hochrisikosituation (kompetitive Athleten, berufliche Exposition) sollte eine elektrophysiologische Untersuchung durchgeführt werden, um die Leitungscharakteristika der akzessorischen Bahn zu beurteilen. Wenn die Bahn schnell leitet, sollte eine Ablation durchgeführt werden, wenn nicht, sollte eine Ablation erwogen werden. Auch bei Patienten ohne gefährliche Exposition sollte die Risikostratifizierung mit dem Patienten besprochen werden. Demgegenüber tritt in den rezenten Empfehlungen die nicht invasive Risikostratifizierung (Ergometrie) in den Hintergrund. Schwierig wird es in der Praxis, dem Patienten zu erklären, warum eine Niedrigrisikoablation einer akzessorischen Leitungsbahn (weit weg vom AV-Knoten) mit schlechten Leitungseigenschaften dann nicht in einer Sitzung durchgeführt wird.
Vorhofflimmern
Einleitung, Diagnose und Screening
In den ESC-Richtlinien zum Vorhofflimmern aus dem Jahr 2020 wird neben den Empfehlungen zu Antikoagulation und Verbesserung der Symptomatik durch Frequenzkontrolle und Rhythmuskontrolle sehr viel Augenmerk auf die Berücksichtigung der Komorbiditäten gelegt. Für die Diagnose von Vorhofflimmern ist explizit entweder ein 12-Ableitungs-EKG oder ein 30-Sekunden-EKG-Streifen einer Ableitung mit den bekannten Kriterien (absolute Arrhythmie der Kammerkomplexe, keine P-Wellen) erforderlich. Aus prognostischen Gründen sollte bei Menschen älter als 65 strukturiert nach asymptomatischem Vorhofflimmern gefahndet werden.
„CC – confirm and characterize“ im „4S-Schema”
Nach der Bestätigung des Vorhofflimmerns ist die individuelle Beurteilung des Vorhofflimmerpatienten vor Therapieeinleitung empfohlen.
-
S für „stroke risk“: unverändert der CHA2DS2VASc-Score
-
S für „symptom severity“: unverändert der EHRA-Score (I–IV)
-
S für „severity of AF burden“: Häufigkeit und Dauer der Episoden
S für „substrate severity“: Parameter, die für die Prognosebeurteilung und die Wahrscheinlichkeit des Erhaltes eines Sinusrhythmus von Bedeutung sind, wie Alter, Komorbiditäten, Vorhofgröße, Vorhoffibrose und viele andere.
„ABC“ – „Antikoagulation, bessere Symptomkontrolle, Co-Morbiditäten“: Antikoagulation
Die Empfehlungen zur Schlaganfall-Prophylaxe unter Verwendung des CHA2DS2VASc-Scores sind unverändert: 1 Punkt (Mann) oder 2 Punkte (Frau): Klasse-IIa-Indikation (sollte erwogen werden), 2 (Mann) oder 3 Punkte (Frau): Klasse-Ia-Indikation (muss gemacht werden). Risikofaktoren für Blutungen sollten wenn möglich modifiziert werden, ein Blutungs-Score oder die Art des Vorhofflimmerns (paroxysmal versus persistierend) sollte allerdings nicht zur Entscheidung für die Antikoagulation herangezogen werden. NOAKs („Nicht-Vitamin-K-Antagonisten“) sollte der Vorzug vor Vitamin-K-Antagonisten gegeben werden, bei schlechter Einstellung sollte ebenfalls eine Umstellung auf ein NOAK erfolgen.
Bessere Symptomkontrolle
Die Frequenzkontrolle sollte bevorzugt mit einem kardioselektiven Betablocker durchgeführt werden, alternativ Diltiazem, Verapamil oder Digitalis. Die Rhythmuskontrolle ist bei symptomatischen Patienten indiziert, mit dem Ziel, die Lebensqualität zu verbessern. Wenn zur Rhythmuskontrolle eine Kardioversion geplant ist, ist auf eine effektive Antikoagulation zu achten (3 Wochen vor bis mindestens 4 Wochen nach Kardioversion). Eine pharmakologische Kardioversion sollte nur bei hämodynamisch stabilen Patienten ohne QT-Verlängerung, Sinusknotenproblematik oder AV-Überleitungsstörungen durchgeführt werden.
Symptomkontrolle: Antiarrhythmika oder Katheterablation
Die Katheterablation ist indiziert bei Patienten, bei denen ein Antiarrhythmikum entweder ineffektiv ist oder nicht vertragen wird. Nur im Falle einer Herzinsuffizienz mit dem Verdacht auf eine „Tachy-Myopathie“ sollte die Ablation vor einer antiarrhythmischen Therapie durchgeführt werden, und nur bei ausgewählten Patienten mit reduzierter Linksventrikelfunktion sollte die Ablation zur Prognoseverbesserung empfohlen werden. Eine orale Antikoagulation sollte zumindest für 2 Monate nach Ablation empfohlen werden, unbegrenzt in Abhängigkeit vom CHA2DS2VASc-Score und nicht in Abhängigkeit vom Ablationsergebnis. Die Isolation aller Lungenvenen ist bei jeder Ablationsprozedur indiziert. Zusätzliche Ablationsläsionen (niedrigamplitudige Areale, Areale mit fragmentierten Signalen, ektope Foci, Rotoren und sonstige) können überlegt werden, der Nutzen ist nicht gut etabliert. Bei Patienten mit zusätzlich isthmusabhängigem Vorhofflattern kann eine empirische rechtsatriale Isthmusablation überlegt werden.
Komorbiditäten
Faktoren, die zu strukturellen Vorhof-Veränderungen (Fibrose) führen und damit auch die Wahrscheinlichkeit für einen stabilen Sinusrhythmus nach Ablation reduzieren, sollen berücksichtigt und idealerweise durch Lebensstilmodifikation günstig beeinflusst werden (Adipositas, Hypertonie, Rauchen, Schlafapnoe, Alkohol, Hyperlipidämie, Inaktivität).
Postoperatives Vorhofflimmern
Eine dauerhafte orale Antikoagulation zur Verhinderung thromboembolischer Ereignisse sollte nach postoperativem Vorhofflimmern bei nichtkardialen Operationen nach einer sorgfältigen Nutzen-Risiko-Analyse und gemäß Präferenz des informierten Patienten überlegt werden. Betablocker sollten nicht routinemäßig zur Vorhofflimmerprophylaxe bei nichtkardialen Operationen eingesetzt werden. Bei kardialen Operationen kann eine dauerhafte orale Antikoagulation überlegt werden, je nach Nutzen-Risiko-Analyse und Patientenpräferenz.
Ventrikuläre Extrasystolen, ventrikuläre Tachykardien
Ventrikuläre Tachykardien bei struktureller Herzerkrankung
Patienten mit struktureller Herzerkrankung (ischämische Kardiomyopathie, dilatative Kardiomyopathie) und dokumentierter ventrikulärer Tachykardie (bereits eine Salve mit 3 breiten Kammerkomplexen und einer Frequenz >100/M ist als solche definiert) haben ein beträchtliches Risiko, einen plötzlichen Herztod zu erleiden. Bei entsprechender Klinik (Herzinsuffizienz) und reduzierter Linksventrikelfunktion (Auswurffraktion <35%) ist daher die Indikation zur ICD-Implantation gegeben. Antiarrhythmika kommen nur zur Prävention häufiger Tachykardien zum Einsatz: Kein Medikament außer Betablocker ist geeignet, das Risiko für den plötzlichen Herztod zu reduzieren.
Ventrikuläre Arrhythmien ohne strukturelle Herzerkrankung
Prinzipiell gilt: Wenn kein Hinweis auf eine strukturelle Herzerkrankung besteht, ist die Prognose günstig und die weitere Strategie im Wesentlichen vom Leidensdruck des Patienten abhängig. Auch wenn eine ventrikuläre Arrhythmie als Bigeminus auftritt und bis zu 20% der Kammerkomplexe im Holter ventrikuläre Extrasystolen sind, gilt: Solange der Patient beschwerdefrei ist und solange keine Einschränkung der Linksventrikelfunktion besteht (wenn mehr als 30% der Kammerkomplexe im Holter ventrikuläre Extrasystolen sind, muss damit gerechnet werden), ist eine spezifische Therapie nicht erforderlich. Wenn Patienten ohne strukturelle Herzerkrankung aufgrund der ventrikulären Extrasystolie oder der ventrikulären Tachykardien symptomatisch sind, ist eine medikamentöse Therapie indiziert (Klasse-Ic-Antiarrhythmikum, z.B Propafenon). Wenn die medikamentöse Therapie ineffektiv ist oder nicht gewünscht ist oder nicht vertragen wird, ist die Indikation zur Katheterablation gegeben.
Ventrikuläre Arrhythmien und Ionenkanalerkrankungen
Bei Patienten mit meist seltenen Ionenkanalerkrankungen („long QT syndrome“, Brugada-Syndrom, „early repolarization“, „short QT syndrome“) geht es in erster Linie darum, die Gefährdung des Patienten und seiner nächsten Verwandten abzuschätzen. Dazu sind in den meisten Fällen nicht nur eine detaillierte Anamnese und eine umfassende kardiale Diagnostik, sondern auch eine gezielte genetische Analyse erforderlich. In zweiter Linie geht es darum, zu beurteilen, welche Maßnahmen zur Verbesserung der Prognose (Medikamente oder ICD) oder zur Verbesserung der Symptomatik (Medikamente) eingesetzt werden sollen.
Literatur:
• Brugada J et al. for the ESC Scientific Document Group: 2019 ESC Guidelines for the management of patients with supraventricular tachycardia. The Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC): Developed in collaboration with the Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2020; 41(5): 655-720 • Glikson M et al. for the ESC Scientific Document Group: 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy: Developed by the Task Force on cardiac pacing and cardiac resynchronization therapy of the European Society of Cardiology (ESC) With the special contribution of the European Heart Rhythm Association (EHRA). Eur Heart J 2022; 42(35): 3427-520 • Hindricks G et al. for the ESC Scientific Document Group: 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J 2021; 42(5): 373-498 • Silvia G Priori et al. for the ESC Scientific Document Group: 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J 2015; 36(41): 2793-867
Das könnte Sie auch interessieren:
Mechanische Kreislaufunterstützung im Infarkt-bedingten kardiogenen Schock
Der Infarkt-bedingte kardiogene Schock (AMI-CS) ist trotz der enormen Fortschritte in der interventionellen Versorgung des akuten Myokardinfarktes in den vergangenen Jahrzehnten ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...