Hypervolämie bei Herzinsuffizienz: therapeutisches Vorgehen im Jahr 2024
Autoren:
Dr. Moritz Messner, PhD
Dr. Valentin Bilgeri
Universitätsklinik für Innere Medizin III Kardiologie und Angiologie,
Interdisziplinäres Herzinsuffizienzzentrum Tirol, IHZ, Expertisezentrum für
seltene Herzmuskelerkrankungen
Medizinische Universität Innsbruck
E-Mail: moritz.messner@tirol-kliniken.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Trotz Behandlung halten Stauungszeichen bei einem erheblichen Anteil der Herzinsuffizienzpatient:innen an und gehen mit einer schlechten Prognose einher. Es liegen neue Daten für eine optimierte Dekongestion vor und es gilt, eine leitlininiengerechte Herzinsuffizienztherapie früh zu etablieren.
Keypoints
-
Hypervolämie und Kongestion sind die Hauptursache stationärer Aufnahmen bei Herzinsuffizienz.
-
Schleifendiuretika sind Mittel der ersten Wahl, um Stauung zu behandeln. Neue Daten zur sequenziellen Nephronblockade bei Diuretikaresistenz liegen vor.
-
Die Natriurese-gesteuerte Diuretikatherapie bietet trotz einer intensiveren Behandlung mehr Sicherheit.
-
Ziel vor der Entlassung sind eine Euvolämie und die Etablierung einer leitliniengerechten Medikation.
Die Notwendigkeit einer Hospitalisierung bzw. einer intravenösen (i.v.) Diuretikatherapie aufgrund von Herzinsuffizienz (HI) ist mit einer 3-fach erhöhten Mortalität und einer hohen Rehospitalisierungsrate assoziiert.1
Hypervolämie und Kongestion sind in den allermeisten Fällen die Ursache für stationäre Aufnahmen bei HI. Akut bedrohliche Auslöser wie Myokardinfarkt, Pulmonalembolie, mechanische Komplikationen wie Ventrikelperforation und Herzbeuteltamponaden sowie Rhythmusstörungen gilt es rasch zu identifizieren und zu therapieren. Ein inadäquates Herzminutenvolumen (HMV) mit Hypoperfusion, unzureichender Sauerstoffversorgung des Gewebes und Hyperlaktatämie kann zu lebensbedrohlichem Multiorganversagen führen. In weniger ausgeprägter Form ist ein niedriges HMV vergesellschaftet mit erhöhten kardialen Füllungsdrücken, welche zu pulmonaler Kongestion und pulmonalen Ödemen führen können. Erhöhte rechtskardiale und zentralvenöse Drücke führen zu Stauung in Nieren, Leber und Intestinum mit entsprechend einhergehender Organschädigung.
Häufig sind banale Infekte und eine nicht leitliniengerechte Therapie Trigger einer kardialen Dekompensation. In der Folge treten Kardinalsymptome wie Dyspnoe, Knöchelschwellung, nächtlicher Husten und Völlegefühl auf und es finden sich gestaute Jugularvenen, Rasselgeräusche, Pleuraergüsse und Aszites. Die initiale Diagnostik umfasst die Erhebung der Vitalparameter, EKG, Labor/Blutgase und Bildgebung inklusive Röntgen und Sonografie von Herz, Lunge und Abdomen. Als Zeichen eines erhöhten hydrostatischen Druckes (>12mmHg) in den Lungenkapillaren finden sich im Thoraxröntgen vergrößerte Lungengefäße und ein verbreitertesmediastinales Gefäßbündel. Bei einem Lungenödem sind die Septallinien akzentuiert, welche auch Kerley-B-Linien genannt werden. Insbesondere der Echokardiografie ist eine zentrale Rolle im Assessment zuzuschreiben. Diese gibt Auskunft über die systolische und diastolische Funktion sowie über Klappendysfunktionen.
Biomarker sind aussagekräftige Prädiktoren für Morbidität und Mortalität und verdeutlichen den progressiven Charakter der HI und die fortschreitende strukturelle und funktionelle Verschlechterung des Herzens. Da Patient:innen mit voranschreitender HI ihre Aktivität reduzieren, kann die Entwicklung offenkundiger Symptome maskiert werden. Bei unspezifischen Beschwerden kann das NT-proBNP die Diagnosesicherheit erhöhen und die Zeit bis zur Therapieentscheidung verkürzen.2 Auch erhöhte Troponinwerte ohne vorliegendes akutes Koronarsyndrom haben hier einen prognostischen Wert.1
Erster Schleifendiuretikabolus innerhalb der ersten Stunde
Durch ein reduziertes HMV wird das Renin-Angiotensin-Aldosteron-System (RAAS) aktiviert und es werden Natrium sowie in der Folge auch Flüssigkeit retiniert, was zu einer Volumenüberladung führt. Außerdem kann eine Sympathikusaktivierung Volumen aus den Kapazitätsgefäßen rekrutieren und zusätzlich die Vorlast erhöhen.
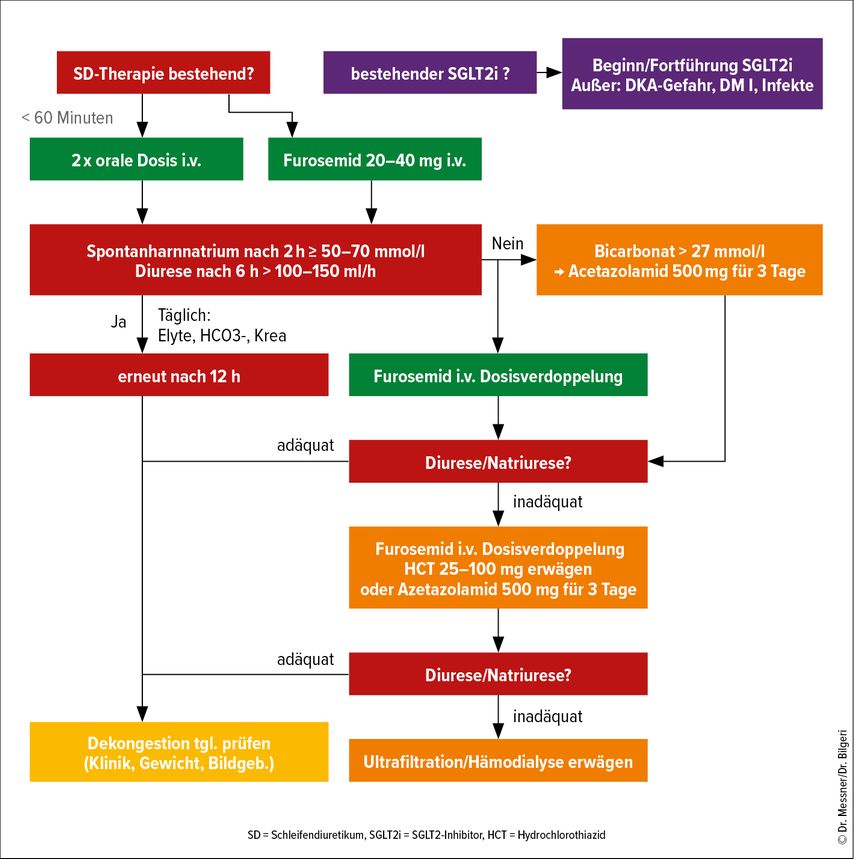
Ziel einer Behandlung ist die Wiederherstellung der Euvolämie mit adäquater Diurese, denn fortbestehende Kongestionszeichen bei Entlassung sind mit einer schlechten Prognose assoziiert.3 Wie diese Ziele erreicht werden können, war Gegenstand mehrerer randomisierter Studien in den letzten Jahren. Einen Versuch der Integration dieser Ergebnisse in einen Behandlungsalgorithmus zeigt Abbildung 1.4
Der erste i.v.Bolus von Schleifendiuretika (SD) soll binnen 60 Minuten nach ärztlicher Vorstellung bei Patient:innen mit akut dekompensierter HI erfolgen. Die Empfehlung eines raschen Beginns basiert dabei auf Registerdaten.5 Außerdem hat die i.v.Gabe den Vorteil, dass die Bioverfügbarkeit im Vergleich zur oralen Einnahme bei Kongestion konstant bleibt.6 Gestartet wird in der Regel mit 20–40mg Furosemid i.v. oder einer äquivalenten SD-Dosis in 12-stündigen Intervallen. Bei vorbestehender oraler SD-Therapie wird mit derselben Dosis i.v. fortgefahren und bei einer GFR unter 60ml/min/1,73 m2 eine Verdoppelung der Dosis vorgenommen.7
Eine vormals vermutete Überlegenheit der kontinuierlichen SD-Gabe (via Perfusor) konnte in der DOSE-Studie nicht belegt werden. Bezüglich Symptomverbesserung und Nierenfunktionsparameter konnte kein signifikanter Unterschied nachgewiesen werden. Letztere waren ebenso wie ein kombinierter Endpunkt aus Mortalität, Rehospitalisierung und der Notwendigkeit einer ambulanten Behandlung innerhalb von 60 Tagen in der Boluskohorte numerisch sogar besser.8
Evaluation der Natriurese und Diurese
Angesichts der häufigen Diuretikaresistenzen bei HI ist es wichtig, die Wirksamkeit der Therapie im Verlauf zu überprüfen. Die Resistenzentwicklung hat mehrere Ursachen, darunter einen verminderten renalen Blutfluss, Umbauvorgänge im Nephron und Effekte der RAAS-Aktivierung. Etwa 65–75% der Natriumrückresorption finden im proximalen Tubulus statt, während nur etwa 25% in der Henle-Schleife – das heißt am primären Ansatzpunkt von SD – resorbiert werden. Bei unzureichendem Ansprechen auf SD wird daher das Konzept einer sequenziellen Nephronblockade verfolgt. Neue Daten aus randomisierten Studien, auf die im Folgenden eingegangen wird, unterstützen dieses Konzept. Die ROSE-AHF-Studie zeigte eine Verbesserung durch natriuresegesteuerte Dekongestion im Vergleich zur traditionellen Überwachung von Körpergewicht, Harnmenge oder Flüssigkeitsbilanzierung.9 Basierend darauf empfehlen die aktuellen Leitlinien der ESC (European Society of Cardiology) die Bewertung der Natriurese im Spontanharn zwei Stunden sowie der Diurese sechs Stunden nach Beginn der Therapie mit SD, gefolgt von weiteren Kontrollen alle zwölf Stunden. Die kürzlich veröffentlichte PUSH-AHF-Studie unterstützt diesen Ansatz. Wenn der Natriumspiegel in einer Harnprobe unter 70mmol/l liegt oder die Diurese unter 100–150ml/Stunde bleibt (entspricht 600–900ml Ausscheidung nach sechs Stunden), sollte ein zusätzlicher SD-Bolus verabreicht sowie die Dosis von Furosemid schrittweise auf 400–600mg/Tag gesteigert werden. Sollten weiterhin eine unzureichende Natriurese und Diurese vorliegen, ist die Zugabe eines weiteren Diuretikums zu erwägen.10
Eskalationsstrategien bei unzureichendem Ansprechen auf SD
SGLT2-Hemmer
Mehrere aktuelle Studien liefern überzeugende Ergebnisse für den frühzeitigen Einsatz von SGLT2-Hemmern. Hierbei ist zu beachten, dass Patient:innen mit Typ-1-Diabetes, i.v. Inotropikatherapie oder früherer Ketoazidose in diesen Studien stets ausgeschlossen wurden. In der DICTATE-AHF-Studie begann die Behandlung mit Dapagliflozin bei Patient:innen mit akuter dekompensierter HI innerhalb von 24 Stunden. Dadurch wurden Diurese und Natriurese gesteigert, was mit einer verkürzten Krankenhausverweildauer einherging.11 Studien wie EMPULSE, EMPA-RESPONSE-AHF und EMPAG-HF haben für Empagliflozin die Sicherheit eines frühen Behandlungsbeginns und das Potenzial zur kurzfristigen Steigerung der Diurese gezeigt.12–14 Diese verstärkte Diurese wird unter anderem auf die osmotische Wirkung der Glukoseausscheidung und der Natriumausscheidung im proximalen Tubulus zurückgeführt. Darüber hinaus belegen harte Outcome-Daten mehrerer randomisierter Studien bei HI die kardioprotektive Wirkung dieser Medikamentenklasse.
Acetazolamid
In der ADVOR-Studie erhielten Patient:in-nen mit akuter HI (AHF) im Interventionsarm zusätzlich zur Standardtherapie drei Tage lang 500mg Acetazolamid. Dies führte im Vergleich zur Standardtherapie zu einer signifikant schnelleren Rekompensation. Acetazolamid ist ein Carboanhydrasehemmer, der die Protonensekretion im proximalen Tubulus verringert, die Bikarbonatrückresorption reduziert und die Natriumausscheidung über den Natriumionenantiporter (NHE3) fördert. Dabei gilt es vorbestehende Azidosen auszuschließen. Zu erwähnen ist, dass in dieser Studie die gleichzeitige Verabreichung von SGLT2-Hemmern nicht erlaubt war.15
Thiazide
Die Zugabe von Hydrochlorothiazid (HCT) zur Standardtherapie wurde in der CLOROTIC-Studie bei Patient:innen mit AHF untersucht. Nur die Verbesserung des Körpergewichts erreichte einen signifikanten Endpunkt, allerdings auf Kosten häufiger erhöhter Serumkreatinin- und niedrigerer Kaliumwerte.16
Aldosteronantagonisten
Bei der akuten Dekompensation zeigte die ATHENA-HF-Studie, dass eine höhere Dosis von Aldosteronantagonisten (MRA), nämlich 100mg,keinen klinischen Vorteil gegenüber einer Dosis von 25mg bietet. Dennoch werden MRA bei vorherrschender rechtskardialer Insuffizienz und aufgrund ihrer nachgewiesenen Wirksamkeit im chronischen Setting empfohlen. Zusätzliche Ergebnis- und Sicherheitsdaten sind für eine umfassendere Bewertung erforderlich.17
Zusammengefasst lässt sich sagen, dass sich bei unzureichendem Ansprechen auf SD Acetazolamid als Zweitliniendiuretikum für Patient:innen mit einem Ausgangsbikarbonatspiegel von ≥27mmol/l anbietet, während HCT als alternative Drittlinientherapie in Betracht gezogen werden kann. Wenn trotz allem keine Euvolämie erreicht wird, kann eine Ultrafiltration in Erwägung gezogen werden, obwohl in Studien ein früherer Beginn im Vergleich zur Standardtherapie mit mehr Nebenwirkungen wie z.B. Blutungen verbunden war.18
Maßnahmen vor Entlassung und Hospitalisierungssprävention
Anhaltende Stauungszeichen bei Entlassung sind mit einer schlechten Prognose und häufigen Wiederaufnahmen vergesellschaftet, weshalb die Sicherstellung der Dekongestion bedeutend ist.
Ein gewisses Maß an Incompliance bei Medikamenteneinnahme und der Einhaltung genereller Empfehlungen sind bei Patient:innen mit HI oder anderen chronischen Erkrankungen häufig zu beobachten, auch bei Patient:innen, die die Medikamente gut vertragen. Die Einbeziehung der Patient:innen in ein Nachsorge-/Heimüberwachungsprogramm erweist sich als ebenso vorteilhaft wie die Schulung durch eine auf HI spezialisierte Pflegekraft.19Solche Programme wurden in den letzten Jahren in verschiedenen Bundesländern etabliert (u.a. HerzMobilTirol). Die Empfehlungen für die Patient:innen umfassen die tägliche Gewichtskontrolle, die Selbstregulierung der Diuretikaeinnahme und das Erkennen der Symptome von Hypotonie und Hypovolämie.
Mittlerweile steht uns ein breites medikamentöses Armamentarium zur Behandlung der chronischen Herzinsuffizienz (HF) zur Verfügung, mit welcher die Notwendigkeit von Krankenhauseinweisungen vermieden werden kann. Vor allem die Ergebnisse der STRONG-HF-Studie, in der die Wirksamkeit und Sicherheit einer frühzeitig eingeleiteten und intensivierten HI-Therapie untersucht wurden, unterstreichen die Bedeutung dieser Medikamente.20
Die ESC-Leitlinie 2021 empfiehlt eine Flüssigkeits- und Salzrestriktion und die Vermeidung von nichtsteroidalen Antirheumatika (NSAR). Bei wiederkehrender Hypervolämie trotz optimierter HI-Therapie kommen Diuretika zur Anwendung, wobei wiederum primär SD verwendet werden sollen. Es gilt, eine Allopurinolprophylaxe und bei Neigung zur Hyponatriämie die Umstellung von einem Thiazid auf ein SD zu erwägen.
Bei unzureichendem Ansprechen auf Furosemid wird eine Umstellung auf Torasemid vorgeschlagen. Allerdings wurde in der kürzlich veröffentlichten TRANSFORM-HF-Studie während eines 30-monatigen Nachbeobachtungszeitraumskein Unterschied in der Gesamtmortalität und den Krankenhausaufenthaltsraten zwischen diesen beiden Wirkstoffen festgestellt.
In ausgewählten Fällen kann ein CardioMEMS-HF-System in die Lungenarterie implantiert werden, das kabellos den pulmonalarteriellen Druck, einen wichtigen Indikator für Herzversagen, misst. Die Patient:innen übermitteln die Messwerte zur proaktiven Überwachung aus der Ferne, was eine rechtzeitige Anpassung der Behandlung, insbesondere der diuretischen, ermöglicht. Dieser personalisierte Ansatz verringert die Anzahl der Krankenhausaufenthalte und verbessert die Ergebnisse für die Patient:innen, wodurch die Belastung durch die HI verringert wird.21
Literatur:
1 Greene SJ et al.: Pre-discharge and early post-discharge Troponin elevation among patients hospitalized for heart failure with reduced ejection fraction: findings from the ASTRONAUT trial. Eur J Heart Fail 2018; 20(2): 281-91 2 Martens P et al.: Current approach to decongestive therapy in acute heart failure. Curr Heart Fail Rep 2015; 12(6): 367-78 3 Chioncel O et al.: Acute heart failure congestion and perfusion status - impact of the clinical classification on in-hospital and long-term outcomes; insights from the ESC-EORP-HFA Heart Failure Long-Term Registry. Eur J Heart Fail 2019; 21(11): 1338-52 4 Bilgeri V et al.: Decongestion in acute heart failure-time to rethink and standardize current clinical practice? J Clin Med 2024; 13(2): 311 5 Matsue Y et al.: Time-to-Furosemide treatment and mortality in patients hospitalized with acute heart failure. J Am Coll Cardiol 2017; 69(25): 3042-51 6 Testani JM et al.: Loop diuretic efficiency: a metric of diuretic responsiveness with prognostic importance in acute decompensated heart failure. Circ Heart Fail 2014; 7(2): 261-70 7 McDonagh TA et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42(36): 3599-726 8 Felker GM et al.: Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med 2011; 364(9): 797-805 9 Hodson DZ et al.: Natriuretic response is highly variable and associated with 6-month survival: insights from the ROSE-AHF trial. JACC Heart Fail 2019; 7(5): 383-91 10 Ter Maaten JM et al.: Natriuresis-guided diuretic therapy in acute heart failure: a pragmatic randomized trial. Nat Med 2023; 29(10): 2625-32 11 Cox ZL et al.: Efficacy and safety of Dapagliflozin in acute heart failure: rationale and design of the DICTATE-AHF trial. Am Heart J 2021; 232: 116-24 12 Voors AA et al.: The SGLT2 inhibitor Empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med 2022; 28(3): 568-74 13 Damman K et al.: Randomized, double-blind, placebo-controlled, multicentre pilot study on the effects of Empagliflozin on clinical outcomes in patients with acute decompensated heart failure (EMPA-RESPONSE-AHF). Eur J Heart Fail 2020; 22(4): 713-22 14 Schulze PC et al.: Effects of early Empagliflozin initiation on diuresis and kidney function in patients with acute decompensated heart failure (EMPAG-HF). Circulation 2022; 146(4): 289-98 15 Martens P et al.: Pre-treatment bicarbonate levels and decongestion by Acetazolamide: the ADVOR trial. Eur Heart J 2023; 44(22): 1995-2005 16 Trullas JC et al.: Combining loop with Thiazide diuretics for decompensated heart failure: the CLOROTIC trial. Eur Heart J 2023; 44(5): 411-21 17 Butler J et al.: Efficacy and safety of Spironolactone in acute heart failure: The ATHENA-HF randomized clinical trial. JAMA Cardiol 2017; 2(9): 950-8 18 Bart BA et al.: Ultrafiltration in decompensated heart failure with cardiorenal syndrome. N Engl J Med 2012; 367(24): 2296-304 19 Brennan EJ: Chronic heart failure nursing: integrated multidisciplinary care. Br J Nurs 2018; 27(12): 681-8 20 Mebazaa A et al.: Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial. Lancet 2022; 400(10367): 1938-52 21 Abraham WT et al.: Wireless pulmonary artery haemodynamic monitoring in chronic heart failure: a randomised controlled trial. Lancet 2011; 377(9766): 658-66
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Neue Wege in der Diagnostik des Vorhofflimmerns
Vorhofflimmern ist die häufigste Rhythmusstörung unserer Zeit. Die Folgen reichen von eingeschränkter Lebensqualität und Belastbarkeit bis zu schwerwiegenden Komplikationen wie ...