Interventionelle Therapie bei Herzrhythmusstörungen
Autorin:
OÄ Dr. Alexandra Schratter
Abteilung für Kardiologie
Klinik Floridsdorf, Wien
Die Katheter-basierte Therapie von Herzrhythmusstörungen ist aufgrund der geringen Invasivität und der hochspezialisierten Verfahren eine etablierte Behandlungsoption mit klarer Verankerung in den Leitlinien der europäischen und internationalen Fachgesellschaften. Im Folgenden werden interventionelle Therapiestandards bei häufigen Herzrhythmusstörungen präsentiert.
Keypoints
-
Katheterablation ist angezeigt bei symptomatischem paroxysmalem Vorhofflimmern bzw. bei Tachykardie-induzierter Kardiomyopathie als First-Line-Therapie, bei persistierendem Vorhofflimmern nach vorangegangener medikamentöser Therapie.
-
Katheterablation ist außerdem indiziert bei ventrikulärer Extrasystolie zur Symptomreduktion und/oder Verbesserung der systolischen Linksventrikelfunktion.
-
Baldige Katheterablation ist angebracht bei monomorphen ventrikulären Tachykardien unter ischämischer Kardiomyopathie zur Vermeidung von ICD-Therapien und Verbesserung der Prognose.
-
Leadless-Pacemaker-Implantation ist sinnvoll bei hohem Infektionsrisiko oder fehlenden venösen Zugängen zur oberen Körperhälfte – nunmehr ist auch atriale Leadless-Stimulation möglich.
Katheterablation von Vorhofflimmern
Vorhofflimmern ist die häufigste Herzrhythmusstörung im Erwachsenenalter. Eine von 3–5 Personen über 45 Jahre entwickelt im Laufe ihres weiteren Lebens Vorhofflimmern.1 Laut den aktuellen Leitlinien der European Society of Cardiology2 ist die Katheterablation bei paroxysmalem Vorhofflimmern als Erstlinientherapie oder bei persistierendem Vorhofflimmern nach frustraner medikamentöser Therapie indiziert (jeweils Klasse-IA-Indikation). Auch bei Patient:innen mit manifester Herzinsuffizienz oder Tachykardie-induzierter Kardiomyopathie hat die Katheterablationstherapie von Vorhofflimmern einen großen Stellenwert in den aktuellen Leitlinien.2
Ablationsverfahren mit thermischer Energie (Punkt-für-Punkt-Ablation mittels Hochfrequenzstrom oder Kryoablation mittels Ballonkatheter als Single-Shot-Verfahren) sind in zahlreichen Studien hinsichtlich Effizienz und Sicherheit hinlänglich untersucht worden und weisen mittlerweile jahrzehntelange Erfahrungswerte auf.3
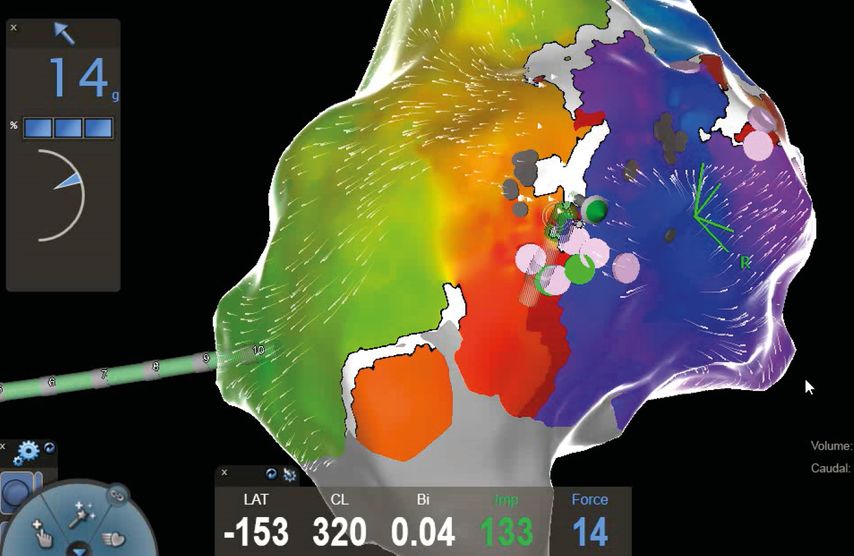
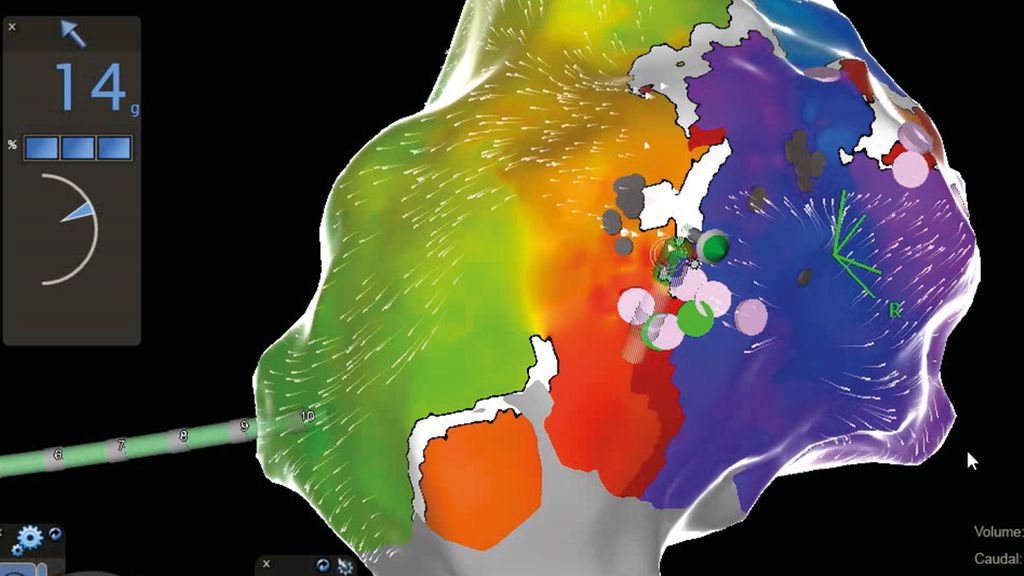
Der große Vorteil von Punkt-für-Punkt-Ablationsverfahren mittels Hochfrequenzstrom ist die Möglichkeit, auch komplexe linksatriale Rhythmusstörungen abseits der Pulmonalvenenisolation – wie z.B. atypisches linksatriales Vorhofflattern nach vorangegangenen Ablationen oder Herzoperationen –zu behandeln. Hierbei kommen 3D-Mappingsysteme sowie hochauflösende multipolare Mappingkatheter zum Einsatz, welche es ermöglichen, innerhalb weniger Minuten zehntausende Mappingpunkte zu erfassen und somit eine extrem akkurate Diagnostik und Therapie der Rhythmusstörung zu gewährleisten (Abb. 1).
Abb. 1: Hochauflösende 3D-Map des rechten Vorhofs mit farbcodierter Visualisierung der atrialen Tachykardie und Darstellung der undichten Stelle (rosa Punkte) im Bereich der vorbestehenden Ablationsläsion (weiße Linie). Erfolgreiche Ablation an der mittels Map genau definierten Stelle anhand eines „Contact force“-Katheters (14 g Anpressdruck)
In den letzten Jahren hat eine neue Energieform zur Behandlung von Vorhofflimmern zunehmend an Bedeutung gewonnen: die sogenannte „pulsed-field ablation“, welche mittels Elektroporation Myokardzellen zerstört.4 Diese Energieform soll sehr selektiv Myozyten schädigen und umliegende Strukturen (Ösophagus, Nervus phrenicus) schonen. Nachdem initial nur multipolare „single-shot devices“ verfügbar waren, gibt es nunmehr auch die Möglichkeit, mit dieser Energieform eine Punkt-für-Punkt-Ablation vorzunehmen und somit auch Rhythmusstörungen abseits der Pulmonalvenenisolation zu behandeln.5
Katheterablation von ventrikulären Rhythmusstörungen
Die Ablationstherapie bei ventrikulären Rhythmusstörungen ist laut aktuellen ESC-Leitlinien insbesondere bei idiopathischen ventrikulären Tachykardien bei strukturell herzgesunden Patient:innen sowie bei anhaltenden ventrikulären Tachykardien aufgrund von myokardialen Narben unterischämischer Kardiomyopathie zur Vermeidung von ICD-Therapieabgaben und zur Verbesserung der Lebensqualität und des Outcomes indiziert.6
Auch nicht anhaltende ventrikuläre Arrhythmien im Sinne von isolierten Extrasystolen oder kurzen ventrikulären Runs, wie sie insbesondere bei Ausflusstrakt-Extrasystolie auftreten, können die Lebensqualität der Betroffenen aufgrund der ausgeprägten Symptomatik (Palpitationen, Bradykardie und Schwindel bei Pulsdefizit) stark beeinträchtigen beziehungsweise bei hoher Arrhythmielast zu einer Extrasystolie-induzierten Kardiomyopathie führen.
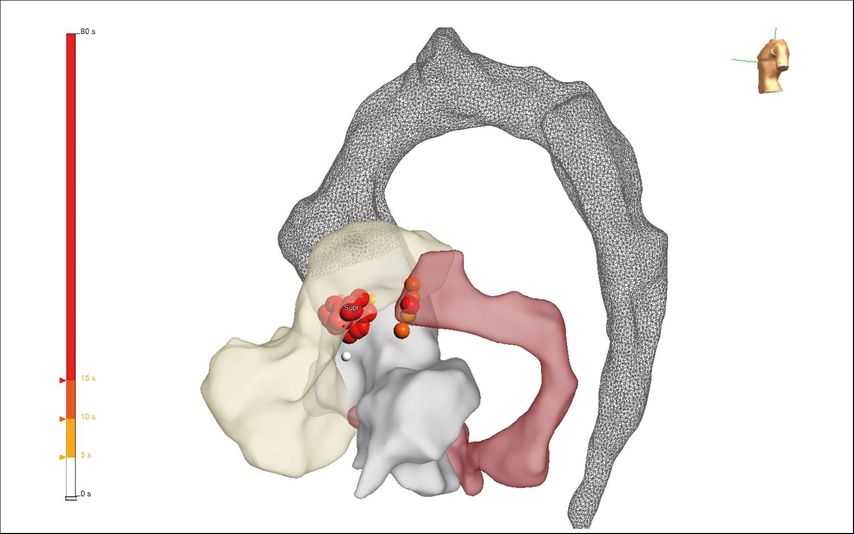
Die Katheterablation von symptomatischen ventrikulären Extrasystolen (VES) oder monomorphen ventrikulären Tachykardien (VT) ohne zugrunde liegende strukturelle Herzerkrankung stellt laut aktuellen ESC-Leitlinien6 im Falle von aus dem rechtsventrikulären Ausflusstrakt (RVOT) kommenden Arrhythmien oder faszikulären Tachykardien eine Klasse-I-Indikation dar. Bei anderen idiopathischen VES/VT-Lokalisationen, z.B. aus dem linksventrikulären Ausflusstrakt (LVOT) entspringenden ventrikulären Arrhythmien, ist zunächst ein medikamentöser Therapieversuch mit Betablockern oder Kalziumkanalblockern indiziert (Klasse-I-Empfehlung), bevor eine Katheterablation in Erwägung gezogen wird (Klasse-IIa-Empfehlung). Dies ist durch die doch komplexere Ablationsprozedur bedingt, da insbesondere LVOT-Arrhythmien oftmals einer Katheterablation schwerer zugänglich sind (Ablation im Aortensinus, im distalen Koronarsinus/„great cardiac vein“). Gegebenenfalls kann ein Ablationsverfahren von mehreren Herzhöhlen ausgehend notwendig sein, entweder konsekutiv (Abb. 2) oder mittels bipolarer Ablation, wo mithilfe eines speziellen Generators die gleichzeitige Energieabgabe über zwei Katheter simultan erfolgen kann.7
Abb. 2: Hochauflösende 3D-Map des rechtsventrikulären Ausflusstrakts (RVOT, beige), des linksventrikulären Ausflusstrakts/Aortensinus (hellgrau), des distalen Koronarsinus/„great cardiac vein“ (dunkelrot) und der thorakalen Aorta (dunkelgrau gesprenkelt). Konsekutive Ablation im RVOT, LVOT/Aortensinus und distalen Koronarsinus mit erfolgreicher Suppression der klinischen ventrikulären Extrasystolen (die roten Punkte stellen die Ablationsläsionen dar, die vertikale Leiste links skaliert die Dauer der Ablationsläsionen in Sekunden)
Die im Rahmen der Katheterablation von monomorphen Kammertachykardien bei struktureller Herzerkrankung gewählte Behandlungsstrategie richtet sich nach der zugrunde liegenden Pathologie.
Bei ventrikulären Tachykardien unter ischämischer Kardiomyopathie zeigt sich meistens ein klar begrenztes, überwiegend endokardiales Narbenareal, das der Ausdehnung des vorangegangenen Myokardinfarkts entspricht. Das Ventrikelendokard wird im Rahmen der Ablationsprozedur mittels hochauflösender multipolarer Mappingkatheter in Zusammenhang mit einem 3D-Mappingsystem kartografiert und es wird ein 3D-Modell des Herzens erstellt, das die vorhandenen Narbenareale in Bezug auf das Gesamtendokard visualisiert. Innerhalb der „Low voltage“-Zone des Narbenareals können zudem stark fraktionierte Potenziale und Spätpotenziale identifiziert werden, welche noch leitfähigen Myokardstraßen entsprechen, die zumeist kritische Isthmen der klinischen ventrikulären Tachykardien darstellen (Abb. 3). Ein Aktivierungsmapping im Sinusrhythmus oder während Stimulation vom rechten oder linken Ventrikel kann Dezelerationszonen der Erregungsfront identifizieren, die für die Entstehung und Aufrechterhaltung von ventrikulären Reentry-Kreisen verantwortlich sind.8,9
Abb. 3:Links elektroanatomische Rekonstruktion mit „voltage mapping“ des linken Ventrikels endokardial bei ischämischer Kardiomyopathie mit großer Narbe anteroseptal (grau). Spätpotenziale innerhalb der Narbe (braune Punkte). Gelbe Punkte: intrinsisches Reizleitungssystem (HIS-Region). Rechts Aktivierungsmapping der laufenden ventrikulären Tachykardie mit Darstellung des Reentry-Kreises anterior. Ein Teil der braunen Punkte befindet sich genau im kritischen Isthmus der Tachykardie (die gewellte Linie innerhalb der beiden geraden schwarzen Linien entspricht der „slow conduction“ durch den Isthmus). Die braunen Punkte werden später Teil des Ablationstargets sein
Bei der ischämischen Kardiomyopathie werden dann substratgesteuert wenn möglich alle abnormalen Potenziale an der Narbengrenze und innerhalb der Narbe sowie gegebenenfalls etwaige kritische Dezelerationszonen abliert. Ein Aktivierungsmapping der intraprozedural auslösbaren ventrikulären Tachykardien oder Stimulationsmanöver zur Lokalisation des laufenden Reentry-Kreises sind bei hämodynamischer Instabilität oftnur zeitlich sehr begrenzt oder nicht möglich bzw. muss auf die Kreislaufunterstützung mittels eines temporären„assist device“ (Impella, ECMO) zurückgegriffen werden.
Bei nichtischämischer Kardiomyopathie (z.B. nach Myokarditis, bei dilatativer Kardiomyopathie, arrhythmogener rechts- und/oder linksventrikulärer Kardiomyopathie, Sarkoidose oder anderen Systemerkrankungen mit myokardialer Beteiligung) sind die Narbenareale oft nicht von endokardial ausgehend, sondern es zeigt sich häufig eine mittmyokardiale bzw. epikardiale Beteiligung. Zur Prozedurplanung ist daher insbesondere bei nichtischämischer Kardiomyopathie eine vorangehende kardiale Magnetresonanztomografie empfehlenswert, um das Ablationstarget im Vorfeld zu definieren. Manche der bei nicht-ischämischer struktureller Herzerkrankung auftretenden klinischen Tachykardien können von endokardial abliert werden, bei anderen ist ein epikardialer Zugang (z.B. von subxiphoidal oder mittels eines kardiochirurgischen endoskopischen Eingriffs) notwendig. Hierbei werden die Mapping- und Ablationskatheter direkt in den Perikardraum eingebracht, wo Mapping und in weiterer Folge Ablation des epikardialen Substrats erfolgen.
Interventionelle sondenlose Herzschrittmacherimplantation
Bei bradykarden Herzrhythmusstörungen gibt es seit 2013 die Möglichkeit, einen sondenlosen Herzschrittmacher mittels Katheterverfahren in den rechten Ventrikel zu implantieren.10,11 Dies kann über die Femoralvene oder über die Jugularvene erfolgen. So können Patient:innen mit bradykardem Vorhofflimmern, aber auch z.B. mitseltenen Reflexsynkopen aufgrund von langen Pausen im VVI-Modus sowie Betroffene mit höhergradigen AV-Blockierungen im VDD-Modus interventionell behandelt werden. Das allerdings mit nur bedingter atrioventrikulärer Synchronität. Der große Vorteil der sondenlosen Herzschrittmachertherapie ist die Tatsache, dass auch Patient:innen mit fehlendem venösem Zugang zur oberen Körperhälfte oder bei deutlich erhöhtem Infektionsrisiko (z.B. vorangegangene Schrittmachersysteminfektion, chronische Hämodialyse) einer Schrittmachertherapie zugeführt werden können (Klasse-IIa-Indikation laut aktuellen ESC-Leitlinien).12
Seit Kurzem kann auch eine Schrittmacherkapsel in den Vorhof implantiert werden.13 Dies ermöglicht zusätzlich zur VVI/VDD-Stimulation nunmehr eine rein atriale bzw. eine DDD-Stimulation. Die sondenlose Herzschrittmachertherapie stellt somit für eine deutlich größere Bandbreite an zugrunde liegenden bradykarden Rhythmusstörungen eine therapeutische Option dar.
Literatur:
1 Linz D et al: Atrial fibrillation: epidemiology, screening and digital health. Lancet Reg Health Eur 2024; 37: 100786 2 Van Gelder IC et al.: 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2024; 45(36): 3314-414 3 Parameswaran R et al: Catheter ablation for atrial fibrillation: current indications and evolving technologies. Nat Rev Cardiol 2021; 18(3): 210-25 4 Verma A et al.: Pulsed field ablation for the treatment of atrial fibrillation: PULSED AF pivotal trial. Circulation 2023; 147(19): 1422-32 5 Wenzel JP et al.: Nonthermal point-by-point pulmonary vein isolation using a novel pulsed field ablation system circ arrhythm electrophysiol. 2023; 16(9): e012093 6 Zeppenfeld K et al.: 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J 2022 Oct; 43(40): 3997-4126 7 Futyma P et al.: Bipolar ablation of ventricular arrhythmias: Step-by-step. J Cardiovasc Electrophysiol 2023; 34(12): 2599-606 8 Irie T et al.: Relationship between sinus rhythm late activation zones and critical sites for scar-related ventricular tachycardia: systematic analysis of isochronal late activation mapping. Circ Arrhythm Electrophysiol 2015; 8(2): 390-9 9 Anter E et al.: Ablation of reentry-vulnerable zones determined by left ventricular activation from multiple directions: anovel approach for ventricular tachycardia ablation: amulticenter study (PHYSIO-VT). Circ Arrhythm Electrophysiol 2020; 13(6): e008625 10 Ritter P et al.: Early performance of a miniaturized leadless cardiac pacemaker: the Micra Transcatheter Pacing Study. Eur Heart J 2015; 36(37): 2510-9 11 Reynolds D et al.: A leadless intracardiac transcatheter pacing system. N Engl J Med 2016; 374(6): 533-41 12 Glikson et al.: 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Eur Heart J 2021; 42(35): 3427-20 13 Knops RE et al.: A dual-chamber leadless pacemaker. N Engl J Med 2023; 388(25): 2360-70
Das könnte Sie auch interessieren:
Mechanische Kreislaufunterstützung im Infarkt-bedingten kardiogenen Schock
Der Infarkt-bedingte kardiogene Schock (AMI-CS) ist trotz der enormen Fortschritte in der interventionellen Versorgung des akuten Myokardinfarktes in den vergangenen Jahrzehnten ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...