Kardioonkologie: bei Chemotherapie auf das Herz achten
Bericht:
Reno Barth
geprüft von:
A.o. Univ.-Prof. Dr. Jutta Bergler-Klein, FESC, FHFA, FEACVI
Leiterin der kardiologischen Ambulanzen
Universitätsklinik für Innere Medizin II
Abteilung für Kardiologie
Medizinische Universität Wien
Die aktuellen Entwicklungen in der Onkologie haben entscheidend dazu beigetragen, das Leben von Krebspatientinnen und -patienten zu verlängern. Die dabei eingesetzten Therapien können belastend sein und können insbesondere auch zu akuten und chronischen kardialen Schäden führen. Risikobewertung und eventuell notwendige Interventionen erfordern die enge Zusammenarbeit von Onkologie und Kardiologie.
Keypoints
-
Die häufigste kardiale Folgeerscheinung einer Krebserkrankung und -therapie ist die Herzinsuffizienz.
-
Auftreten können auch Arrhythmien, Bradykardie, resistente Hypertonie, akute Koronarsyndrome und Plaqueruptur, Long-QT-Syndrom oder Thromboembolien.
-
Bei Immuntherapien können Arrhythmien, akutes Koronarsyndrom, Perikarditis oder selten eine fulminante lymphozytäre Myokarditis auftreten.
-
Zur kardiologischen Basisuntersuchung werden ein EKG, der Herzultraschall sowie die Bestimmung von Biomarkern wie Troponin, BNP oder NT-proBNP, LDL-Cholesterin und HbA1c empfohlen.
-
Regelmäßige Kontrollen mit Echokardiografie, BNP- und Troponin-Bestimmung werden empfohlen, engmaschig vor allem bei vorbestehenden Herz-Kreislauf-Erkrankungen.
Für Österreich zeigen Daten der Statistik Austria, dass die relative 5-Jahres-Überlebensrate eines Krebspatienten nach Diagnosestellung in der Periode 1991–1995 bei 53,1% lag und mit der Diagnoseperiode 2011–2015 auf 60,7% anstieg. Bei Patientinnen und Patienten im Alter von unter 45 Jahren betrug die relative 5-Jahres-Überlebensrate in der Diagnoseperiode 2011–2015 bereits 83,4%.1 Allerdings hat die höhere Überlebenswahrscheinlichkeit auch dazu geführt, dass Langzeitfolgen von Chemotherapie oder Bestrahlung an Relevanz gewinnen, wie durch Univ.-Prof. Dr. Jutta Bergler-Klein von der Kardio-Onkologie-Ambulanz, Abteilung für Kardiologie, Medizinische Universität Wien, im Rahmen der „Österreichischen Kardiologie“(ÖKG)-Tagung berichtet wurde.
Nebenwirkungen onkologischer Therapien
Die Nebenwirkungen dieser Therapien können auch das Herz-Kreislauf-System betreffen. Hinzu kommt eine potenzielle Beeinträchtigung der Herzfunktion durch den Tumor selbst, die bereits vor Beginn einer Chemotherapie paraneoplastisch durch Ausschüttung von inflammatorischen Faktoren (z.B. Zytokine, Interleukin 6 usw.) mediiert werden kann. Im Gegenzug bedingt chronische Herzinsuffizienz einen subklinischen inflammatorischen Zustand, der die Entstehung von Tumoren begünstigen kann, wodurch die Gefahr eines Teufelskreises aus onkologischen und kardiovaskulären Erkrankungen entsteht. Beispielsweise sterben bis zu 10% der Brustkrebsüberlebenden in weiterer Folge an kardiovaskulären Erkrankungen, die mit der onkologischen Therapie in Verbindung stehen.2,3
Anthrazykline haben höchste Kardiotoxizität
Das Risiko bleibt über Jahrzehnte erhöht und ist nach einer Therapie mit Anthrazyklinen und Bestrahlung am höchsten. Daneben können jedoch auch andere onkologische Therapien zu kardialen Folgeschäden führen. So sind insbesondere Tyrosinkinase- bzw. VEGF-Inhibitoren kardiotoxisch durch Auslösung von teils herausfordernder Hypertonie, welche zu Ischämie oder Herzinsuffizienz führen kann. Fluoruracil kann Ischämie und koronare Syndrome auslösen. Die häufigste kardiale Folgeerscheinung einer Krebstherapie ist die Herzinsuffizienz. Daneben sind auch Arrhythmien, Bradykardie, Long-QT-Syndrom oder Thromboembolien mögliche kardiovaskuläre Folgeschäden onkologischer Therapien. Die neuen Immuntherapien (Checkpoint-Inhibitoren, z.B. Ipilimumab, Nivolumab, Pembrolizumab) weisen ein nicht zu unterschätzendes kardiovaskuläres Risiko auf. Bei den Immuntherapien treten häufig Autoimmunkomplikationen verschiedener Organsysteme auf, doch kann auch das Herz betroffen sein, was sich klinisch in Arrhythmien, akutem Koronarsyndrom, Perikarditis oder sogar in seltenen Fällen in einer fulminanten lymphozytären Myokarditis mit hoher Mortalität äußert. Die Inzidenz kardiovaskulärer Komplikationen unter onkologischen Immuntherapien wird in Studien mit 0,7–2% angegeben, in Real-Life-Daten, z.B. in einem aktuellen dänischen Register, sind jedoch bis zu 10% kardiale Ereignisse unter Checkpoint-Inhibitoren aufgetreten. Ebenfalls nicht unterschätzt werden dürfen die potenziellen kardiologischen Folgen einer Strahlentherapie. Hier sind nach mediastinaler Bestrahlung z.B. bei Brustkrebs oder Hodgkin-Lymphomen frühzeitige Atherosklerose und Verkalkungen an den Herzklappen zu nennen.
Studiendaten aus dem amerikanischen „Surveillance, Epidemiology, and End Results“(SEER)-Programm zeigen, dass bei einer Reihe von Tumoren die kardiale Langzeitmortalität höher ist als die Krebsmortalität. Dabei waren am stärksten Patienten betroffen, bei denen die onkologische Erkrankung im Alter unter 35 Jahren diagnostiziert wurde. Am höchsten war das kardiovaskuläre Risiko bei Brust-, Prostata- oder Blasenkrebs. Und die Autoren der Studie betonen, dass die Kardiologie früh ins Spiel kommen sollte, da beispielsweise beim Endometriumkarzinom das kardiovaskuläre Risiko im ersten Jahr nach der Diagnose besonders hoch ist. Damit wird die Kardioonkologie sowohl in den kardiologischen als auch den onkologischen medizinischen Fachgesellschaften zu einem immer wichtigeren Thema. Es wurden jüngst mehrere Positionspapiere von der European Society of Cardiology (ESC) und der Heart Failure Association der ESC veröffentlicht, bei denen Prof. Bergler-Klein als Co-Autorin mitwirkte.5,7 Im kommenden Jahr wird eine komplette ESC-Leitlinie zur Kardioonkologie erwartet.4
Risiko individuell bewerten
Neben unterschiedlichen Risiken durch unterschiedliche Therapien hat auch das individuelle Risikoprofil des Patienten eine große Bedeutung. Ein besonders erhöhtes Risiko für Kardiotoxizität bei onkologischen Behandlungen besteht bei bereits vorliegenden Herz-Kreislauf-Erkrankungen, insbesondere bei bereits bestehender Herzinsuffizienz oder Kardiomyopathie, bei Klappenerkrankungen, aber auch bei Hypertonie oder Diabetes mellitus. Das Risiko, Kardiotoxizität zu entwickeln, ist sowohl bei sehr jungen als auch bei älteren Personen besonders hoch.
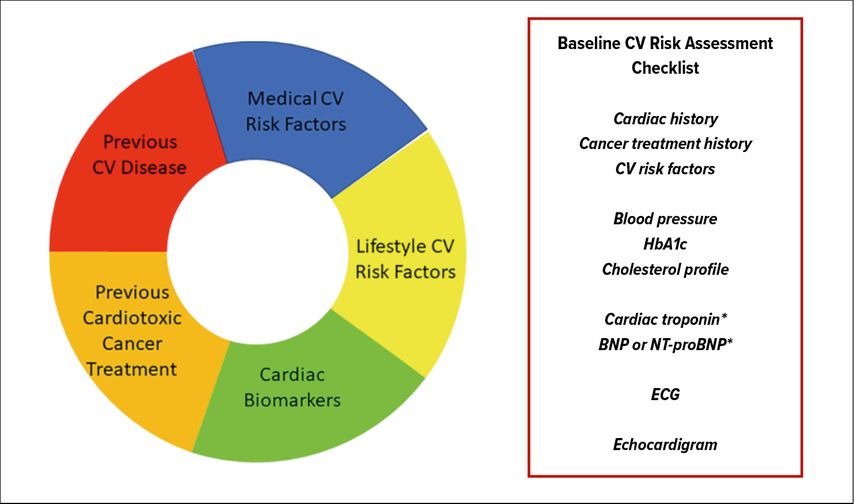
In den rezenten Positionspapieren wird daher die Wichtigkeit der Basisevaluation von Krebspatienten noch vor Beginn der onkologischen Therapie betont, um ein etwaiges kardiovaskuläres Risiko zu erfassen und rechtzeitig mit einer kardiovaskulären medikamentösen Therapie zu beginnen. Dazu werden in einem gemeinsamen Positionspapier der ESC und der International Cardio-Oncology Society detaillierte und auf sieben unterschiedliche Klassen onkologischer Therapien zugeschnittene Empfehlungen für eine Stratifizierung des kardiovaskulären Risikos gegeben.5 Diese orientieren sich an folgenden Faktoren (Abb. 1):
Abb. 1: The different risk factors which contribute to baseline cardiovascular (CV) risk in a cancer patient scheduled to receive a cardiotoxic cancer treatment, and a checklist of the clinical history and investigations required at baseline prior to starting a cardiotoxic cancer therapy. *Cardiac biomarkers (troponin and natriuretic peptides) should be measured where available. BNP, brain natriuretic peptide; ECG, electrocardiogram; HbA1c, glycated haemoglobin; NT-proBNP, N-terminal pro-brain natriuretic peptide. (Mit freundlicher Genehmigung)5
-
Primäre oder sekundäre Prävention?
-
Exposition gegenüber kardiotoxischen Substanzen in der Vergangenheit?
-
Bestehende kardiovaskuläre Erkrankung?
-
Kardiovaskuläre Risikofaktoren?
An Untersuchungen zur kardiologischen Abklärung werden neben der Anamnese ein EKG, der Herzultraschall sowie die Bestimmung von Biomarkern wie Troponin, BNP oder NT-proBNP, LDL-Cholesterin und HbA1c empfohlen. Auf Basis dieser Daten kann im Anschluss ein individuelles kardiovaskuläres Risikoprofil erstellt werden. Desgleichen wird anhand der geplanten onkologischen Therapie ein Risikoprofil erstellt. Dazu liefert das Positionspapier detaillierte Informationen nicht nur zu zytostatischen Chemotherapien, sondern auch zu Targeted Therapies mit potenzieller Kardiotoxizität. Betont wird, dass die onkologische Therapie durch die Risikostratifizierung nicht verzögert werden darf. Hypertonie, Diabetes, erhöhte Biomarker, Arrhythmien, Vorhofflimmern, eingeschränkte linksventrikuläre Funktion sowie eine bestehende KHK oder Herzinsuffizienz erhöhen das Risiko.
Herausfordernd ist die Kombination von hohem Risiko auf Patientenseite mit riskanten Therapien. Besteht ein hohes Risiko, kann und soll je nach Situation auf mehrfache Weise reagiert werden. Modifizierbare Risikofaktoren wie Hypertonie oder erhöhte Lipide sollen behandelt, wenn erforderlich sollten präventive Therapien begonnen werden. In Zusammenarbeit von Kardiologie und Onkologie sollen auch möglichst verträgliche onkologische Therapien gesucht werden. Bei hohem kardialem Risiko können eventuell die onkologischen Therapien angepasst oder Dosierungen bzw. Zyklusintervalle modifiziert werden. Auch die Formulierung von Zytostatika kann das Risiko reduzieren. Dies trifft beispielsweise auf die liposomale Formulierung von Doxorubicin zu. Ebenso wird die engmaschige Überwachung anhand von EKG, klinischer Untersuchung, Biomarkern, Ultraschall und Bildgebung empfohlen.6,7
Kontrollen während und nach der onkologischen Therapie
Das Follow-up anhand von Biomarkern soll sich an den Ausgangswerten vor Beginn der onkologischen Therapie orientieren. Dabei reflektiert Troponin myokardiale Nekrosen und ist damit ein guter Prädiktor für Kardiotoxizität. Der Herzultraschall dient primär dem Monitoring der linksventrikulären Auswurffraktion.
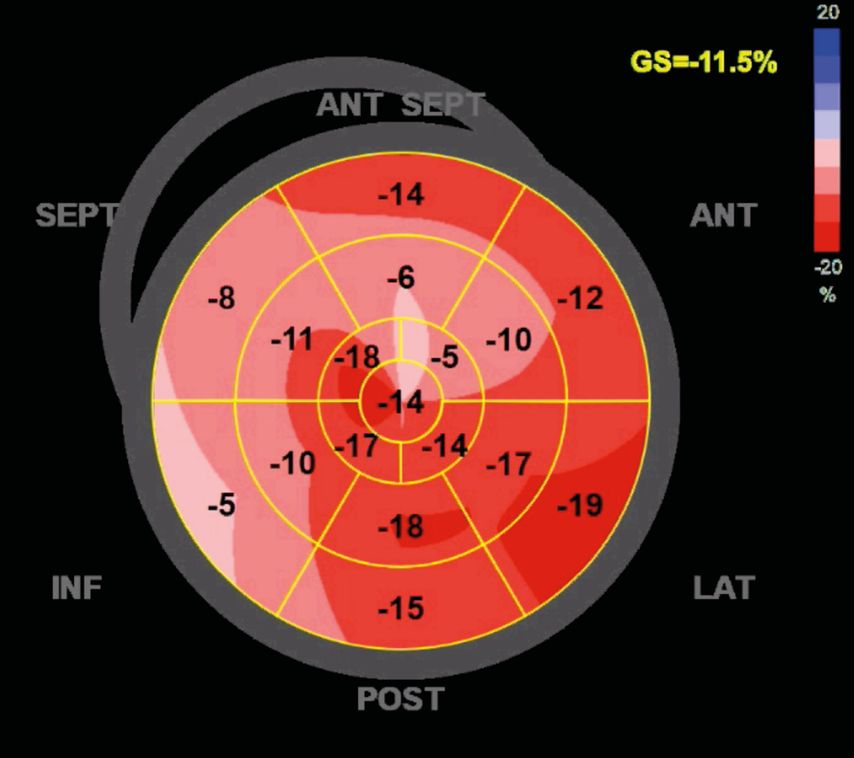
Zusätzlich hat sich die Strain-Analyse mit Speckle-Tracking-Echokardiografie zur Darstellung der regionalen sowie globalenFunktion des linken Ventrikels als früher Indikator einer Schädigung bewährt (Abb. 2). Kardiotoxizität wird angezeigt bei einem Abfall der Linksventrikelauswurffraktion (LVEF) um >10% unter EF <50%. Ein Abfall des Strains um >15% vom Ausgangswert gilt als Hinweis auf beginnende Kardiotoxizität, auch wenn die EF noch normal ist. Bei alleinigem Strainabfall bei noch normaler EF soll jedoch die onkologische Therapie nicht unterbrochen werden, sondern eine kardiale medikamentöse Behandlung eingeleitet werden. Dabei ist der globale longitudinale systolische Spitzenstrain (GLS) am besten validiert. Persistierend erhöhtes BNP ist assoziiert mit eingeschränktem GLS und reduzierter linksventrikulärer Funktion. Bei Anstieg der Biomarker (BNP/NT-proBNP, Troponin) und klinischen Hinweisen auf Herzinsuffizienz soll rasch eine medikamentöse Therapie mit ACE-Hemmer, Angiotensin-Rezeptorblocker, Betablocker usw. gestartet werden. In unklaren Fällen kann eine Herz-MRT hilfreich sein.8 Dabei sollte nicht vergessen werden, dass Chemotherapien neben der Herzinsuffizienz auch andere kardiologische Probleme und Ereignisse wie Plaqueruptur bei vorbestehender Atherosklerose mit folgendem akutem Koronarsyndrom, Rhythmusstörungen wie Vorhofflimmern oder Tachykardien, Thrombosen und Hypertonie verursachen können. Dabei treten therapieresistente Hypertonie und Ischämie vor allem in Zusammenhang mit Targeted Therapies wie Tyrosinkinase-Inhibitoren oder VEGF-Inhibitoren auf. Hier ist eine möglichst frühzeitige blutdrucksenkende Therapie indiziert. Auch bei Einsatz von Immuntherapien (Checkpoint-Inhibitoren) werden, insbesondere bei Vorliegen kardialer Risikofaktoren oder bei Kombinationstherapien, regelmäßige kardiologische Verlaufskontrollen empfohlen.
Abb. 2: „Speckle-tracking strain“, Bull‘s-Eye-Darstellung bei einer Patientin nach Bestrahlung und Chemotherapie mit reduziertem Strain (GS, normal um >18–20% mit einheitlich dunkelroter Färbung des Bull‘s Eye, die hellen Areale zeigen verminderten Strain mit regionaler Ausprägung an)
Regelmäßig anhand von BNP und Troponin kontrolliert sollen auch Langzeitüberlebende von Krebserkrankungen werden, was besonders auf Erwachsene nach kindlichen Tumoren zutrifft, da diese zumeist mit Anthrazyklinen behandelt wurden. Diese Kontrollen sollen Echokardiografie, EKG, Blutdruck und Lipide umfassen. Ebenfalls zu berücksichtigen sind die kardiologischen Risiken längerfristiger Antihormontherapien in der Behandlung von Brustkrebs oder Prostatakarzinom. Bewegung und Sport können die Prognose verbessern.
Literatur:
1 https://www.statistik.at 2 Shapiro LC: N Engl J Med 2018; 379(25): 2438-50 3 Ameri P et al.: Eur J Heart Fail 2018; 20(5): 879-87 4 Sturgeon K et al.: Eur Heart J 2019; 40(48): 3889-97 5 Lyon AR et al.: Eur J Heart Fail 2020; 22(11): 1945-60 6 Zamorano JL, Minotti G: Eur J Heart Fail 2020; 22: 2290-309 7 Gyöngyösi M, Bergler-Klein J et al.: Cardiovasc Res 2020; 116(5): 970-82 8 Pudil R et al.: Eur J Heart Fail 2020; 22(11): 1966-83
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Antibiotika bei Endokarditis: ambulante Fortsetzung der stationären Therapie
Nach einer erfolgreichen initialen stationären, parenteralen Antibiotikatherapie besteht bei vielen Patient:innen mit bakterieller Endokarditis die Option einer ambulanten ...