Lipidsenkung über die Statintherapie hinaus: innovative und experimentelle Ansätze
Bericht:
Reno Barth
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Statine sind aus der kardiovaskulären Prävention nicht mehr wegzudenken und könnten bei besserer Adhärenz einen großen Teil der gefährdeten Population in den LDL-Zielbereich bringen. Bei sehr niedrigen Zielwerten oder bei Statinintoleranz sind innovative Ansätze gefragt. Mehrere solcher Therapien, teilweise auch mit alternativen Zielen, befinden sich bereits im klinischen Einsatz oder in fortgeschrittenen Entwicklungsstadien. Das Spektrum reicht bis zur Gentherapie für die einmalige Anwendung.
Keypoints
-
Durch radikale Senkung des LDL-C ist im Bereich der Stenosen Plaqueregression von bis zu 10% pro Jahr erreichbar.
-
Erste Studien zur Gentherapie mit dem Ziel der Senkung von LDL-Cholesterin haben begonnen.
-
Mehrere Strategien, den Risikofaktor Lipoprotein(a) zu reduzieren, werden in klinischen Studien untersucht.
-
Die Datenlage zur Senkung der Triglyzeride mittels Fibraten ist uneinheitlich.
-
Bempedoinsäure in Kombination mit Ezetimib für statinintolerante Patienten hat Eingang in die ESC-Guidelines gefunden.
Studien zu Gain-of-Function- und Loss-of-Function-Mutationen führten zu einer Reihe neuer Entwicklungen im Bereich der lipidsenkenden Therapien, so Prof. Dr. Lorenz Räber, Universitätsspital Bern.Monoklonale Antikörper gegen das Molekül PCSK9 befinden sich seit einigen Jahren im klinischen Einsatz. Ebenso ist mit Inclisiran eine „small interfering (si)RNA“ zugelassen, die die Transkription des für PCSK9 codierenden Gens unterbindet. In Entwicklung befinden sich Small Molecules, die oral eingenommen werden können und die Interaktion von PCSK9 mit dem hepatischen LDL-Rezeptor unterbinden sollen. Darüber hinaus gibt es Überlegungen, die PCSK9-Produktion durch Gen-Editing mittels CRISPR-Cas9 dauerhaft auszuschalten. Bislang erhielten zehn Patienten mit familiärer Hypercholesterinämie diese genetische Therapie. Die Studie ist noch im Laufen, so Räber.
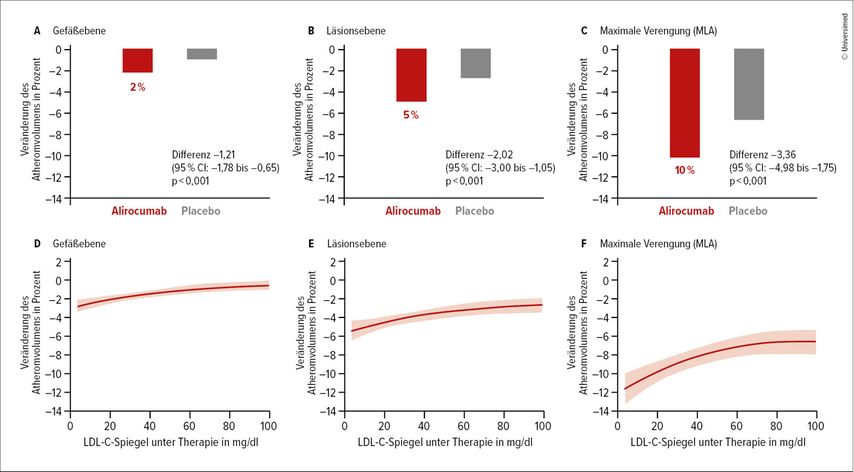
Für die genannten Therapien wurden Senkungen des LDL-Cholesterins zwischen 45 und 60% nachgewiesen oder werden aus noch laufenden Studien zumindest erwartet. Für die beiden zugelassenen PCSK9-Inhibitoren Evolocumab und Alirocumab konnten bereits direkte Effekte auf atherosklerotische Plaques demonstriert werden. Sie führen zu einer Plaqueregression von 2% pro Jahr. Allerdings betont Räber, dass die tatsächliche Wirkung deutlicher ist, zumal sich die 2% auf das gesamte Gefäßsystem beziehen. Auf dem Niveau der Läsionen können hingegen 5% erreicht werden und an den am stärksten verengten Stellen wurden 10% Plaqueregression nachgewiesen, wie im Rahmen des ESC 2024 vorgestellte Daten zeigen (Abb. 1).1 Aus diesem Grund empfehlen die ESC-Guidelines, nach einem akuten Koronarsyndrom sofort mit dem Einsatz eines PCSK9-Inhibitors zusätzlich zu einem Statin und Ezetimib zu beginnen, sofern das LDL-C über 55mg/dl liegt.2
Abb. 1: Effekte der LDL-C-Senkung mit Alirocumab auf Gefäßebene, Läsionsebene sowie an der Stelle der maximalen Verengung („minimal lumen area“ – MLA) (modifiziert nach Biccirè FG et al. 2024)1
PCSK9-Inhibition beeinflusst das gesamte Apolipoproteom
PACMAN-AMI-Studie
In der Studie PACMAN-AMI mit 300 Patienten wurde die Wirkung des PCSK9-Inhibitors Alirocumab auf koronare Plaques untersucht. Die für diese Studie entnommenen longitudinalen Blutproben ermöglichen auch eine Analyse der Wirkung von Alirocumab auf das Apolipoproteom. Die Analyse zeigte zunächst einen raschen, kompensatorischen Anstieg von PCSK9, deren Plasmaspiegel innerhalb eines Jahres um fast 1500% anstieg. Gleichzeitig kam es zu einer Abnahme von ApoB um 75% unter Alirocumab im Vergleich zu 43% unter Placebo. LDL-Cholesterin ging unter Alirocumab um 88% und unter Placebo um 54% zurück. Darüber hinaus kam es unter Alirocumab im Vergleich zu Placebo zu signifikant ausgeprägteren Rückgängen von ApoC2, ApoC3 und ApoE. Im Gegensatz dazu veränderte sich der Apo(a)-Spiegel unter Alirocumab nicht. Die Autoren sehen in der Abnahme der Apolipoproteine einen Hinweis auf einen günstigen Effekt von Alirocumab über die Senkung von LDL-C hinaus. Im Rahmen der Diskussion betonte Univ.-Prof. Dr. Heinz Drexel, Landeskrankenhaus Feldkirch, die sehr schnell einsetzende Wirkung der PCSK9-Inhibitoren auf den LDL-Cholesterinspiegel.3 Die Sicherheit der PCSK9-Inhibitoren ist gut durch Langzeitstudien dokumentiert.
Neues zu Inclisiran
Auch für Inclisiran liegen mittlerweile Sicherheitsdaten über ein dreijähriges Follow-up vor, die keinen Anlass zu Sicherheitsbedenken geben.4,5
Darüber hinaus wurden spannende Daten zur Plaqueregression unter Therapie mit Inclisiran im Rahmen des diesjährigen ESC-Kongresses vorgestellt. Für die Studie wurden bei 36 Patienten mit stabiler KHK und einer Stenose von 20 bis 50% in einem proximalen oder mittleren Abschnitt einer Koronararterie mittels Nahinfrarotspektroskopie (NIRS) lipidreiche Plaques über 15 Monate beobachtet. Die NIRS erlaubt die Quantifizierung des Fettgehalts koronarer Läsionen, der mit dem maxLCBI4mm (Maximum Lipid-Core Burden Index [MaxLCBI] within 4mm) angegeben wird. Der maxLCBI4mm gibt den Lipidgehalt in einem bestimmten Bereich einer Plaque an und wird in klinischen Studien als Maß für Plaqueregression verwendet.
Die Studienteilnehmer nahmen über vier bis sechs Wochen ein hochpotentes Statin (Atorvastatin 40 oder 80mg bzw. Rosuvastatin 20 oder 40mg) – u.U. kombiniert mit Ezetimib. Wurde damit das LDL-C-Ziel von weniger als 70mg/dl nicht erreicht, wurde zusätzlich Inclisiran verabreicht. Unter diesem Regime nahm der Lipidgehalt der atherosklerotischen Plaques innerhalb von 15 Monaten signifikant ab. Bei 15 Patienten waren Plaques detektiert worden, die mittels NIRS als lipidreich einzustufen waren. Bei diesen Patienten kam es zu einer Regression der lipidreichen Plaques um rund 35%. Wurde das LDL-C-Ziel von 70mg/dl erreicht, war die Abnahme des Lipidgehalts der Plaques mit fast 50% noch deutlicher. Wurde der Zielwert nicht erreicht, so fand sich eine numerische Plaqueregression, die jedoch Signifikanz verfehlte.6
Nächstes Ziel: der genetische Risikofaktor Lipoprotein(a)
Der Risikofaktor Lipoprotein(a) – kurz Lp(a) – ist das nächste Ziel im Kampf gegen kardiovaskuläre Erkrankungen, so Univ.-Prof. Dr. Florian Kronenberg, Medizinische Universität Innsbruck. Lp(a) ist dem LDL-Partikel sehr ähnlich, trägt jedoch eine zusätzliche Apolipoprotein(a)-Kette sowie oxidierte Phospholipide. Rund 20% der Bevölkerung weisen erhöhte Lp(a)-Spiegel auf, wobei Lp(a) allenfalls minimal mit anderen Plasmalipiden korreliert. Sein Plasmaspiegel ist weitgehend genetisch determiniert, womit Lp(a) einen der wichtigsten genetischen Risikofaktoren für kardiovaskuläre Erkrankungen darstellt. Mit steigenden Lp(a)-Werten steigt das kardiovaskuläre Risiko linear an. Dies bedeutet letztlich, dass das individuelle Risiko deutlich unterschätzt werden kann, wenn das Lp(a) nicht gemessen wird.7
Leider sind die therapeutischen Optionen aktuell noch begrenzt. Derzeit ist ausschließlich die Lipidapherese verfügbar. Das Verfahren ist aufwendig, teuer, muss häufig durchgeführt werden und die Evidenzlage ist schlecht. Da Apherese die Plasmaspiegel verschiedener Lipide beeinflusst, lässt sich der klinische Effekt der Lp(a)-Senkung nur schwer herausarbeiten, führte Kronenberg aus. In Studien untersucht wird der Einsatz von Antisense-Oligonukleotiden. Eine Phase-III-Studie mit Pelacarsen in einer Population von mehr als 8000 Patienten läuft derzeit. Auch mehrere siRNAs befinden sich in klinischen Studien. Für Olpasiran konnte eine Lp(a)-Senkung von mehr als 90% demonstriert werden. Ergebnisse einer Phase-III-Studie werden Ende 2026 erwartet. Auch mit der siRNA Lepodisiran hat kürzlich eine Phase-III-Studie begonnen. Mit Zerlasiran soll eine weitere siRNA demnächst in die Phase III gehen. Auch ein oraler Small-Molecule-Inhibitor wird entwickelt. Muvalaplin soll die Bindung von Apo(a) an LDL und damit die Bildung von Lp(a) verhindern. In der Phase I wurden Lp(a)-Senkungen in der Größenordnung von 65% erzielt, wobei mit unterschiedlichen Dosierungen vergleichbare Effekte erreicht wurden. Möglicherweise könnten hier Probleme mit der Bestimmung der Plasmaspiegel von Lp(a) im Spiel sein, so Kronenberg.8
Triglyzeride: Widersprüchliches und offene Fragen
Innovative medikamentöse Ansätze werden auch zur Senkung der Triglyzeridspiegel studiert. Seit vielen Jahren sind Triglyzeride als kardiovaskulärer Risikofaktor im Gespräch und in der Tat zeigen epidemiologische Studien signifikante Assoziationen zwischen Plasmatriglyzeriden und kardiovaskulärem Risiko, so Prof. Dr. Giovanna Liuzzo, Università Cattolica del Sacro Cuore, Rom. Triglyzeride sind dabei als Marker für die Präsenz atherogener triglyzeridreicher Lipoproteine (TGRLs) zu sehen. Dazu gehören Chylomikronen, VLDL sowie Remnants (Überreste von Chylomikronen oder VLDL, die durch den Abbau ihrer Triglyzeride entstehen). TGRLs durchdringen die Gefäßwände und tragen zur Bildung von Schaumzellen und atherosklerotischen Plaques bei.
Fibrate
Im Hinblick auf einen kardiovaskulären Benefit der aktuell verfügbaren triglyzeridsenkenden Therapien sind die Studienergebnisse allerdings widersprüchlich. Beispielsweise konnte in der PROMINENT-Studie keine Senkung des kardiovaskulären Risikos gezeigt werden. Dies könne allerdings daran liegen, dass es unter dem untersuchten Pemafibrat zwar zu einem Rückgang der Triglyzeride, dafür jedoch zu einem Anstieg des LDL-Cholesterins kam.9 In anderen Fibratstudien wurden hingegen signifikante Reduktionen des kardiovaskulären Risikos beobachtet.10 Liuzzo: „Um einen günstigen Effekt auf kardiovaskuläre Endpunkte zu erreichen, werden Therapien benötigt, die die Clearance verbessern und Remnants entfernen, statt Triglyzeride in LDL-Cholesterin umzuwandeln.“
Omega-3-Fettsäuren
Uneinheitlich ist auch die Datenlage zu Omega-3-Fettsäuren. Während in der Studie REDUCE-IT 2g Eicosapentaensäure (EPA) das kardiovaskuläre Risiko reduzierten, kam es in der STRENGTH-Studie in der Kombination von EPA und Docosahexaensäure trotz vergleichbarer Senkung der Triglyzeride zu keinen positiven Effekten auf klinische Endpunkte. Es dürfte also entscheidend sein, welche Omega-3-Fettsäure zum Einsatz kommt.11
Inhibition von Apolipoprotein C-III
Aktuell befinden sich mehrere Therapien, die über eine Inhibition von Apolipoprotein C-III (ApoC3) oder ANGPTL3 die Triglyzeridspiegel senken sollen, in Entwicklung. In klinischen Studien werden das Antisense-Oligonukleotid Olezarsen, die „interfering“ RNA Plozasiran (beide gegen ApoC3) sowie die gegen ANGPTL3 gerichtete „interfering“ RNA Zodasiran erprobt. Sie alle reduzieren Triglyzeride, unterscheiden sich jedoch hinsichtlich der Wirkung auf andere Lipide. Daten zu klinischen Endpunkten liegen noch nicht vor.
Bempedoinsäure: stärkere Empfehlung in den Guidelines
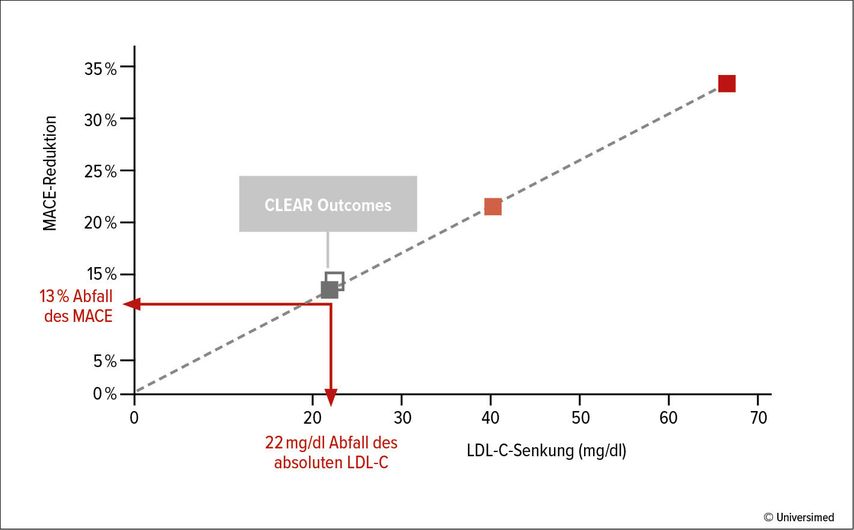
Während Statine über eine Hemmung der HMG-CoA-Reduktase in die hepatische Cholesterinsynthese eingreifen, besteht auch die Möglichkeit, weiter „upstream“ in diesen Prozess einzugreifen und bei der ATP-Citrat-Lyase (ACL) anzusetzen. Mit Bempedoinsäure ist eine Substanz mit diesem Wirkmechanismus bereits zugelassen und im klinischen Einsatz. Entscheidend für die Verträglichkeit ist der Umstand, dass Bempedoinsäure eine Prodrug ist und erst in der Leber, nicht jedoch im Muskel in ihre aktive Thioesterform umgewandelt wird, erläuterte Prof. Dr. Ulf Landmesser vom Deutschen Herzzentrum der Charité in Berlin. Damit biete sich Bempedoinsäure für statinintolerante Patienten an. Dies solle man im Patientengespräch auch betonen, um einen Nocebo-Effekt bei Personen, die schlechte Erfahrungen mit Statinen gemacht haben, auszuschließen, so Landmesser. Mit CLEAROutcomes liegt mittlerweile auch eine Outcome-Studie vor, die in einer statinintoleranten Population über fünf Jahre eine signifikante Reduktion kardiovaskulärer Ereignisse (MACE) zeigt, die in ihrem Ausmaß der erreichten LDL-C-Senkung entspricht (Abb. 2).12,13
Abb. 2: Bempedoinsäure reduziert das kardiovaskuläre Risiko in dem Ausmaß, das angesichts der LDL-Senkung zu erwarten ist (modifiziert nach Nissen SE et al. 2024, HPS3/TIMI55–REVEAL Collaborative Group 2017)12,13
Bempedoinsäure kann auch als Add-on zu Statinen eingesetzt werden, um eine über die Statinwirkung hinausgehende LDL-C-Senkung zu erreichen, wie die Studie CLEARHarmony zeigte.14 In dieser Population reduzierte Bempedoinsäure nach 12 Wochen das mittlere LDL-C im Vergleich zu Placebo um 18,1%, was einer mittleren Reduktion vom Ausgangswert um 19,2mg/dl entspricht. Auf Basis dieser Daten bestehen in den aktuellen ESC-Guidelines nun eine I/B-Empfehlung für den Einsatz von Bempedoinsäure in Kombination mit Ezetimib bei statinintoleranten Patienten sowie eine IIa/C-Empfehlung („should be considered) als Add-on zu einer Statintherapie, falls mit einem Statin alleine die Zielwerte nicht erreicht werden.
Ebenfalls im Rahmen des ESC 2024 präsentiert wurde ein systematischer Review mit Metaanalyse zu kardiovaskulären Ereignissen unter Bempedoinsäure oder Placebo. In die Analyse aufgenommen waren alle verfügbaren randomisierten, placebokontrollierten Studien zur Bempedoinsäure. Primärer Endpunkt war der Drei-Punkte-MACE, bestehend aus Myokardinfarkt, Schlaganfall und kardiovaskulärem Tod. Insgesamt konnten zehn Arbeiten mit 18200 Studienpatienten identifiziert werden. Die Auswertung ergab eine signifikante Reduktion von MACE unter Bempedoinsäure im Vergleich zu Placebo (OR: 0,84 [95% CI: 0,76–0,96]; p<0,001; I2=0%). Treiber dieses Resultats war eine signifikante Reduktion nicht tödlicher Herzinfarkte, während keine signifikante Wirkung auf Schlaganfälle oder Gesamtmortalität festgestellt wurde.15
Quelle:
ESC 2024, Sessions „Targeting lipids above and beyond statins: key new players“ am 1. September, „Lipid-lowering therapies: new findings“ und „Lipid-lowering treatment: impact on the atherosclerotic plaque and outcomes“ am 30. August sowie „Lipids: new pathophysiological and therapeutic insights“ am 2. September, London
Literatur:
1 Biccirè FG et al.: JAMA Cardiol 2024; e243200 2 Byrne RA et al.: 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J 2023; 44(38): 3720-3826 3 Schmidt L et al.: Beyond LDL-cholesterol: effects of alirocumab on the human apolipoproteome. Presented at ESC 2024 4 Wright RS et al.: Cardiovasc Res 2024 May 16:cvae109. Online ahead of print 5 Wright RS et al.: Safety and tolerability of inclisiran for treatment of hypercholesterolemia in 7 clinical trials. J Am Coll Cardiol 2023; 82(24): 2251-61 6 Kokina B et al.: Inclisiran-containing low-density lipoprotein cholesterol reduction effectively stabilizes atherosclerotic plaques. Presented at ESC 2024 7 Kronenberg F: Lipoprotein(a): from causality to treatment. Curr Atheroscler Rep 2024; 26(3): 75-82 8 Nicholls SJ et al.: Muvalaplin, an oral small molecule inhibitor of lipoprotein(a) formation: arandomized clinical trial. JAMA 2023; 330(11): 1042-53 9 Das Pradhan A et al.: Triglyceride lowering with pemafibrate to reduce cardiovascular risk. N Engl J Med 2022; 387(21): 1923-34 10 Nordestgaard BG, Varbo A: Triglycerides and cardiovascular disease. Lancet 2014; 384(9943): 626-35 11 Tybjærg-Hansen A et al.: Triglyceride-rich remnant lipoproteins are more atherogenic than LDL per particle: is this important? Eur Heart J 2023; 44(39): 4196-8 12 Nissen SE et al.: Bempedoic acid and cardiovascular outcomes in statin-intolerant patients. N Engl J Med 2023; 388(15): 1353-64 13 HPS3/TIMI55–REVEAL Collaborative Group: Effects of anacetrapib in patients with atherosclerotic vascular disease. N Engl J Med 2017; 377(13): 1217-27 14 Ray KK et al.: Safety and efficacy of bempedoic acid to reduce LDL cholesterol. N Engl J Med 2019; 380(11): 1022-32 15 Mutschlechner D et al.: Cardiovascular events in patients treated with bempedoic acid vs. placebo: systematic review and meta-analysis. Presented at ESC 2024
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Neue Wege in der Diagnostik des Vorhofflimmerns
Vorhofflimmern ist die häufigste Rhythmusstörung unserer Zeit. Die Folgen reichen von eingeschränkter Lebensqualität und Belastbarkeit bis zu schwerwiegenden Komplikationen wie ...