Mavacamten langfristig wirksam bei hypertropher obstruktiver Kardiomyopathie
Bericht:
Mag. Nicole Bachler
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der selektive kardiale Myosininhibitor Mavacamten zeigte bei stark symptomatischen Patienten mit hypertropher obstruktiver Kardiomyopathie (HOCM) nicht nur eine Verbesserung des LVOT-Gradienten und der NYHA-Klasse, sondern auch eine Reduktion der SRT-Notwendigkeit im Langzeitsetting über 128 Wochen.
Die hypertrophe Kardiomyopathie (HCM) geht mit Hyperkontraktilität und diastolischer Dysfunktion einher und führt häufig zu einer Verschlechterung der Dyspnoe und verminderter körperlicher Leistungsfähigkeit aufgrundeiner Obstruktion des linksventrikulären Ausflusstrakts(LVOT) sowie Mitralklappeninsuffizienz. Patienten mit schwerer HCM haben ein erhöhtes Risiko für Herzinsuffizienz, Vorhofflimmern und plötzlichen Herztod. Bei stark symptomatischen HOCM-Patienten zeigte die VALOR-HCM-Studie, dass Mavacamten zusätzlich zur maximaltolerierten HCM-Therapie die Symptomlast und die Lebensqualität verbessert und in der großen Mehrzahl eine Septumreduktionstherapie (SRT) vermieden werden konnte.1–4
Der Follow-up-Zeitraum der VALORHCM-Studie war 56 Wochen.4In einer weiterführenden rezent publizierten Studie5 wurde nun auch der Langzeiteffekt der Therapie mit Mavacamten über einen Zeitraum von 128 Wochen untersucht.
Studiendesign
In die doppelblinde, randomisierte, placebokontrollierte Studie von Desai et al.5 an 19 kardiologischen Zentren in den USA wurden symptomatische Patienten mit HOCM im Zeitraum Juli 2020 bis Oktober 2021 eingeschlossen (n=108), die für eine SRT infrage kamen. Das Durchschnittsalter lag bei 60,3 Jahren und 50% waren Männer.5
Patienten im Mavacamten-Arm erhielten die Therapie für 128 Wochen (5mg/Tag), die Patienten im Placebo-Mavacamten-Arm erhielten zunächst Placebo und anschließend Mavacamten von Woche 16 bis 128 (112 Wochen lang). Die Dosistitration erfolgte anhand des echokardiografischen linksventrikulären Ausflusstrakt- (LVOT)-Gradienten sowie der Messung der linksventrikulären Auswurffraktion (LVEF). Der primäre Wirksamkeitsendpunkt war die Kombination aus einer Entscheidung, mit der SRT fortzufahren, oder weiterhin der Eignung für die SRT gemäß den AHA/ACC-Richtlinien von 2011.5
Nach 128 Wochen: nur noch 15,7% erfüllen den primären Endpunkt
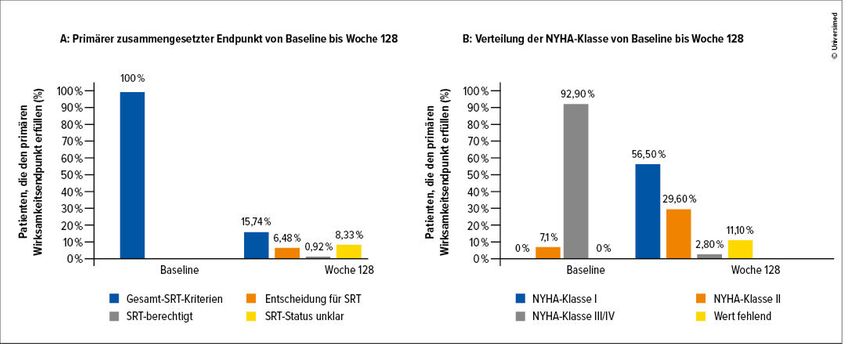
Nach 128 Wochen erfüllten 15,7% der Patienten den primären Endpunkt der Studie, wobei sich nur 6,4% der Patienten aus dem initialen Mavacamten-Arm auch wirklich einer SRT unterziehen mussten (vs. 7,7% der Patienten aus dem Placebo-Mavacamten-Arm; Abb.).5
Abb.: VALOR-HCM-Studie: primäre und Schlüssel-Wirksamkeitsparameter von der Baseline bis Woche 128 (modifiziert nach Desai MY et al. 2024)5
80,5% der Patienten zeigten eine Verbesserung um mindestens eine NYHA-Klasse in der Woche 128 und 48,1% der Patienten hatten sogar eine Verbesserung um mindestens zwei NYHA-Klassen mit einer anhaltenden Reduktion des LVOT-Gradienten in Ruhe und nach Valsalva-Provokation um 38,2mmHg bzw. 59,4mmHg.
88% der Patienten wurden auf die kommerziell erhältliche Mavacamten-Therapie umgestellt. Im initialen Mavacamten-Arm zeigten 85,7% der Patienten eine Verbesserung der NYHA-Klasse ≥1 sowie 53,6% der Patienten eine Verbesserung der NYHA-Klasse ≥2 (versus 75,0% und 42,3% der Patienten im Placebo-Mavacamten-Arm).5
Mavacamten gut verträglich
Bei 15 von 108 (13,8%) Patienten (5,41/100 Patientenjahre) fiel die linksventrikuläre Ejektionsfraktion <50%, 2 mit linksventrikulärer Ejektionsfraktion ≤30%. Von diesen Patienten setzten 12 von 15 (80%) die Behandlung fort. Neu aufgetretenes Vorhofflimmern trat bei 11 (10,2%) Patienten auf (4,55/100 Patientenjahre). Im Studienzeitraum kam es auch zu einem Fall von plötzlichem Herztod.
Fazit
Bei schwer symptomatischen Patienten mit HOCM, die mit Mavacamten behandelt wurden, war in der großen Mehrzahl der Fälle auch bis zur Woche 128 keine SRT erforderlich. Rund 90 % der Patienten setzten die Langzeittherapie mit Mavacamten fort.5 Die Studie zeigt zudem, dass Mavacamten eine wirksame langfristige Alternative zur SRT darstellt und zu einer nachhaltigen Verbesserung der Symptome und der Lebensqualität bei Patienten mit HOCM führt.5
Quelle:
Desai MY et al.: Mavacamten in patients with hypertrophic cardiomyopathy referred for septal reduction: week 128 results from VALOR-HCM. Circulation 2024. doi: 10.1161/CIRCULATIONAHA.124.072445. Online ahead of print
Literatur:
1 Desai MY et al.: Myosin inhibition in patients with obstructive hypertrophic cardiomyopathy referred for septal reduction therapy. J Am Coll Cardiol 2022; 80: 95-108 2 Desai MY et al.: Dose-blinded myosin inhibition in patients with obstructive hypertrophic cardiomyopathy referred for septal reduction therapy: outcomes through 32 weeks. Circulation 2023; 147: 850-63 3 Desai MY et al.: Mavacamten in patients with hypertrophic cardiomyopathy referred for septal reduction: week 56 results from the VALOR-HCM randomized clinical trial. JAMA Cardiol 2023; 8: 968-77 4 Desai MY et al.: VALOR-HCM Investigators. Mavacamten in obstructive hypertrophic cardiomyopathy patients referred for septal reduction: health status analysis through week 56 in VALOR-HCM trial. J Am Coll Cardiol 2024; 84: 1041-5 5 Desai MY et al.: Mavacamten in patients with hypertrophic cardiomyopathy referred for septal reduction: week 128 results from VALOR-HCM. Circulation 2024; doi: 10.1161/CIRCULATIONAHA.124.072445. Online ahead of print
Entgeltliche Einschaltung
Mit freundlicher Unterstützung durch Bristol-Myers Squibb GesmbH
Fachkurzinformation
| 3500-AT-2500001