Pulmonalvenenisolation und linksatriale Ablationen bei Vorhofflimmern
Autoren:
OA Dr. Alexandra Schratter
OA Dr. Reinhard Achleitner
Abteilung für Kardiologie,
Klinik Floridsdorf, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Vorhofflimmern stellt mit seiner zunehmenden Inzidenz und Prävalenz in der industrialisierten Welt und den erheblichen gesundheitlichen Folgen eine massive Belastung für die Betroffenen und folglich auch für die Gesundheitssysteme dar.1 Das Auftreten von gravierenden physischen und psychischen Folgeschäden dieser Rhythmusstörung (Tod, zerebrale Insulte, Herzinsuffizienz, Angstzustände, verminderte Lebensqualität) ist bis zu 40% im Vergleich zur Gesamtbevölkerung erhöht.1
Keypoints
-
Katheter-interventionelle Vorhofflimmerablation als State-of-the-Art-Therapie bei symptomatischem paroxysmalem und persistierendem Vorhofflimmern
-
Bei paroxysmalem Vorhofflimmern laut aktuellen Leitlinien Katheterablation auch als First-Line-Therapie auf Wunsch der Patienten möglich
-
Bei Erstablation von Vorhofflimmern lediglich zirkumferentielle Pulmonalvenenisolation – keine zusätzlichen linearen Läsionen unabhängig von vorhandenen Vorhofnarben!
-
Ablationsstrategie bei atrialen Tachykardien richtet sich nach der zugrunde liegenden Pathologie – potente Ablationsläsionen zur Vermeidung von Rezidiven unbedingt erforderlich!
Mögliche Therapieoptionen umfassen einerseits eine adäquate, nach Risikoscore gerichtete Antikoagulation, andererseits entsprechende Lebensstilmodifikationen sowie eine optimale und individualisierte symptomatische und prognostische Behandlung in Form von Herzfrequenz- bzw. Rhythmuskontrolle (Abb. 1). Hinsichtlich Herzrhythmuskontrolle kann man in Anlehnung an die aktuellen Leitlinien der European Society of Cardiology1 sowie in Absprache mit den Patienten zwischen einer medikamentösen antiarrhythmischen Therapie und, als First-Line- bzw. Second-Line-Therapie, einer Katheterablation wählen.
Indikation zur Katheterablation und Patientenselektion
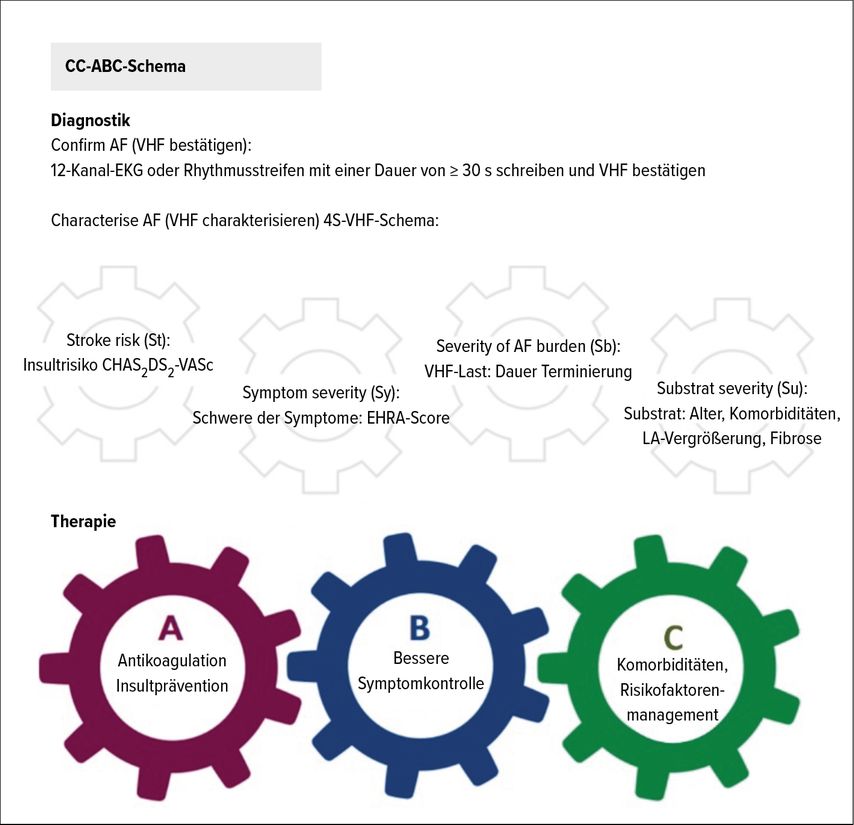
Bei Patienten mit symptomatischem paroxysmalem oder persistierendem Vorhofflimmern und frustraner medikamentöser antiarrhythmischer Therapie stellt die Katheterablation laut aktuellen ESC-Leitlinien erstmals eine Klasse-I-Indikation dar (Abb. 2), ebenso bei Betroffenen mit Tachykardie-induzierter Kardiomyopathie. Bei Patienten mit paroxysmalem Vorhofflimmern ist auf Wunsch der Betroffenen nunmehr auch eine First-Line-Ablationstherapie ohne vorangegangene medikamentöse Antiarrhythmikatherapie möglich (Klasse IIa-Indikation, 2020 ESC Guidelines).
Abb. 2: Indikation zur Katheterablation von Vorhofflimmern (VHF), HFrEF = heart failure with reduced ejection fraction.1
Die Ablationstherapie muss unabhängig von der Indikationslage in Zusammenschau des Alters der Patienten, des Allgemeinzustandes, der Komorbiditäten sowie des periprozeduralen Risikos hinsichtlich Nutzen und Risiko evaluiert werden.
Die Komplikationsrate bei Katheterinterventionellen Vorhofflimmerablationseingriffen liegt bei circa fünf Prozent (in erster Linie vaskuläre Komplikationen im Bereich der Punktionsstelle in der Leiste), davon circa ein Prozent lebensbedrohliche Komplikationen (z.B. Perikardtamponade).1
Ablationstechnik bei Vorhofflimmern
Den Goldstandard der katheterinterventionellen Ablation von Vorhofflimmern stellt die zirkumferentielle Pulmonalvenenisolation dar. Hierbei werden nach Punktion der Vena femoralis diagnostische multipolare Katheter sowie Ablationskatheter über lange Schleusen nach Punktion des intraatrialen Septums in den linken Vorhof eingebracht. In weiterer Folge werden die rechten und linken Lungenvenen, wo sich häufig Vorhofflimmertrigger befinden, elektrisch isoliert. Dies kann mittels Punkt-für-Punkt-Radiofrequenzablation (Abb. 3A) oder mittels „single-shot devices“ (Kryoballon, Laserballon) erfolgen. Ziel ist ein kompletter bidirektionaler Leitungsblock, sodass elektrische Aktivität weder aus der Lungenvene heraus- in den linken Vorhof noch in die Lungenvene hineingeleitet werden kann.
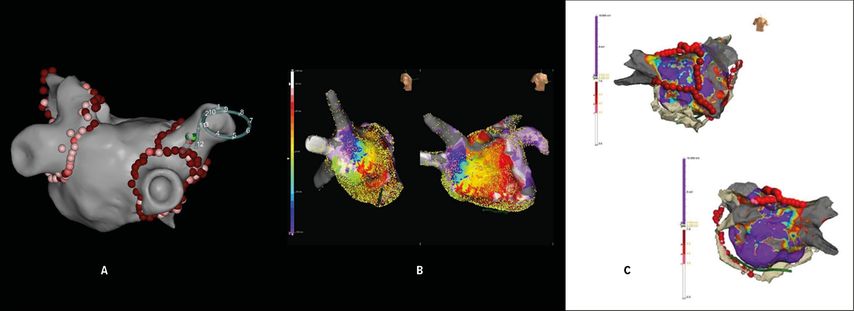
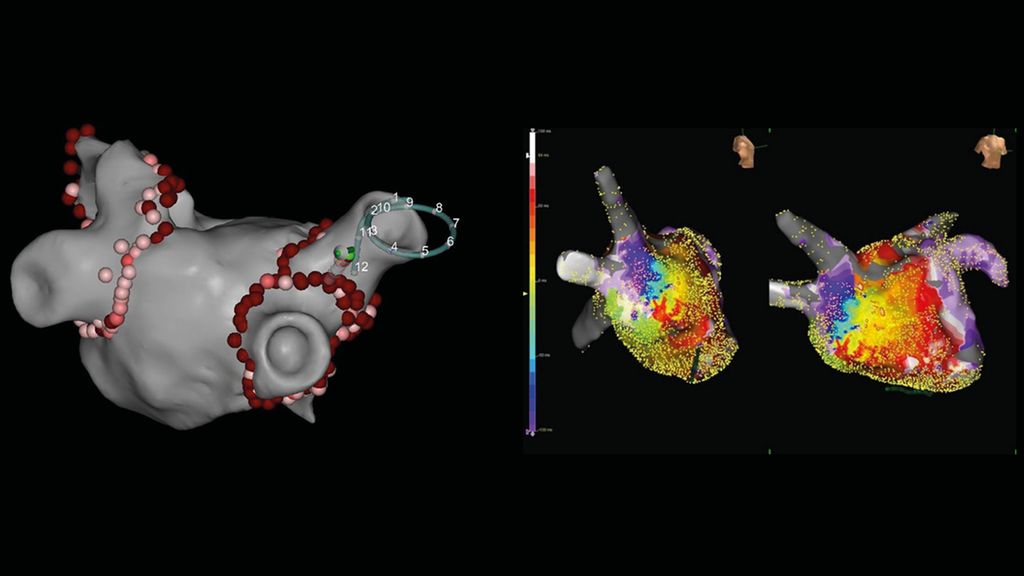
Abb. 3: A: zirkumferentielle Pulmonalvenenisolation mittels Punkt-für-Punkt-Radiofrequenzablation, Ansicht des linken Vorhofs von hinten. Multipolarer Mapping-Katheter und Ablationskatheter in der rechten oberen Lungenvene. Rosa und rote Punkte: Ablationsläsionen. B: hochauflösendes 3D-Map des linken Vorhofs (links von rechts lateral, rechts von schräg rechts vorne) mit farblich kodierter Darstellung einer laufenden linksatrialen Mikro-Reentry-Tachykardie (rot: früheste Aktivierung, blau: späteste Aktivierung). Die kleinen gelben Punkte sind Mapping-Punkte, die mit hochauflösendem multipolarem Katheter aufgenommen wurden. C: lineare Ablationsläsionen im linken Vorhof, Ansicht von vorne (links oben) und hinten (rechts unten). Die farbliche Kodierung stellt gesundes (violett) und krankes Vorhofmyokard (gelb bis rot) sowie die Narbe (grau) dar. Die roten Punkte repräsentieren die Ablationsläsionen (Dachlinie, vordere Mitralisthmuslinie, septale Linie, epikardiale Koronarsinuslinie)
Während der Prozedur kommen, außer bei der Kryo-Technik, 3D-Mapping-Systeme zur Anwendung, die mittels hochauflösender Katheter – Impedanz- und Magnetfeld-basiert – elektrische Signale des Vorhofmyokards ableiten. Auf diese Weise erfolgt eine elektroanatomische Rekonstruktion des linken Vorhofs, die die Erstellung eines präzisen Echtzeit-3D-Modells ermöglicht (Abb. 3A und 3B). In diesem 3D-Modell werden dann die diagnostischen Katheter sowie der Ablationskatheter visualisiert. Ein Echtzeit-Feedback des Anpressdrucks an der Vorhofwand mittels Drucksensor an der Ablationskatheterspitze garantiert maximale Sicherheit und Effizienz der Ablationsprozedur.
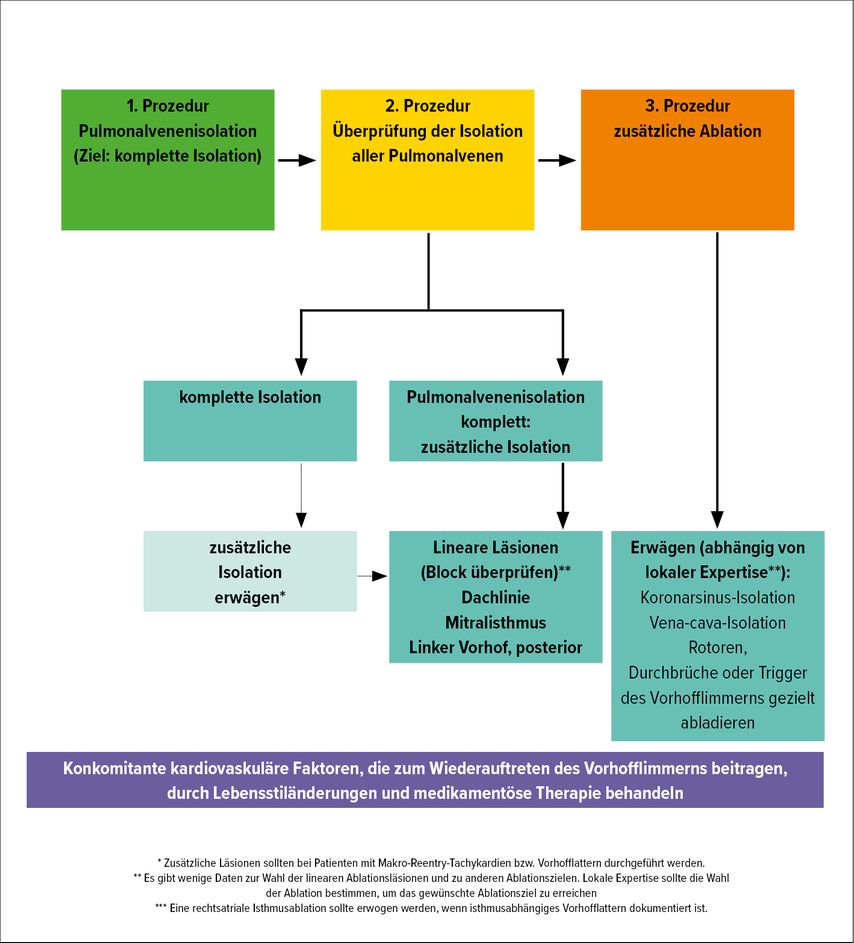
Auch bei persistierendem Vorhofflimmern ist bei der Erstprozedur laut aktueller Datenlage zunächst die alleinige zirkumferentielle Pulmonalvenenisolation empfohlen (Abb. 4), selbst wenn die elektroanatomische Darstellung des linken Vorhofs Narbenareale im Bereich des Vorhofmyokards zeigt.
Abb. 4: Ablationsstrategien bei Erst- und Rezidiveingriffen bei persistierendem Vorhofflimmern (nach Kirchhof P, Calkins H)3
Eine Studie mit knapp 600 Patienten mit persistierendem Vorhofflimmern hatte keinen Vorteil hinsichtlich der Rezidivrate von Vorhofflimmern bei zusätzlich zur zirkumferentiellen Pulmonalvenenisolation durchgeführten unterschiedlichen linksatrialen Substratmodifikationen gegenüber einer alleinigen zirkumferentiellen Pulmonalvenenisolation gezeigt.2 Zusätzliche lineare Läsionen im linken Vorhof erhöhen die Wahrscheinlichkeit des Auftretens von linksatrialen Tachykardien aufgrund von unvollständigen Ablationsläsionen und sind daher im Rahmen einer Erstprozedur bei persistierendem Vorhofflimmern eher nicht empfohlen (Klasse IIb-Indikation, 2020 ESC Guidelines).
Bei Rezidiveingriffen sollten im Falle von neuerlichem Vorhofflimmern wiederum zunächst die Lungenvenen getestet und gegebenenfalls reisoliert werden. Bei persistierendem Leitungsblock im Bereich der Lungenvenen und/oder dokumentierten linksatrialen Tachykardien können zusätzliche lineare Ablationsläsionen im linken Vorhof – je nach Narbenarealen des Vorhofmyokards (z.B. Dachlinie, vordere Mitralisthmuslinie, septale Linie, Hinterwand-Boxläsion, endo- oder epikardiale Koronarsinuslinie, Abb. 3C) – durchgeführt werden.3
Linksatriale Tachykardien
Insbesondere lineare Ablationsläsionen im linken Vorhof, aber auch inkomplette Läsionen bei vorangegangener zirkumferentieller Pulmonalvenenisolation begünstigen das Auftreten von Makro- oder Mikro-Reentry-Tachykardien (große oder kleine kreisförmige Erregungsausbreitung mit Beteiligung des Vorhofmyokards) bzw. von fokalen atrialen Tachykardien (Abb. 5).4
Abb. 5: Drei häufige Formen von atrialen Tachykardien nach linksatrialen Ablationen. A: fokale atriale Tachykardie im Bereich der Hinterwand des Ostiums der linken unteren Lungenvene, D: entsprechendes Aktivierungsmap (rot: früheste Aktivierung, blau: späteste Aktivierung). B: Makro-Reentry-Tachykardie mit kreisförmiger Erregung um die linken Lungenvenen mit entsprechendem Aktivierungsmap (E). C: Mikro-Reentry-Tachykardie im Bereich der Hinterwand der rechten Lungenvenen mit entsprechendem Aktivierungsmap (F). Fokale atriale Tachykardien (A und D) sowie Mikro-Reentry-Tachykardien (C und F) zeigen eine zentrifugale Erregungsausbreitung, wohingegen Makro-Reentry-Tachykardien (B und E) große Erregungskreise mit Beteiligung mehrerer atrialer Segmente aufweisen. LSPV: linke obere Lungenvene, LIPV: linke untere Lungenvene, RSPV: rechte obere Lungenvene, RIPV: rechte untere Lungenvene, LAA: linkes Herzohr, MV: Mitralklappe (aus Hung et al.)4
Dies kann durch Rekonnektion der Ablationsläsion bzw. durch initial unvollständige Läsionen verursacht sein. Die katheter-interventionelle Therapie richtet sich nach der Art der Tachykardie, sollte aber in jedem Fall die Verwendung eines 3D-Mapping-Systems inklusive hochauflösender Katheter zur präzisen elektroanatomischen Rekonstruktion und genauen Darstellung der Tachykardie beinhalten (Abb. 3B).
Je nach zugrunde liegendem Tachykardiemechanismus (fokal/Makro-/Mikro-Reentry) kann dann die entsprechende Ablationsstrategie (lineare bzw. punktuelle Ablation) gewählt werden (Abb. 5). Ziel ist das Setzen von vollständigen, durchgehenden Ablationsläsionen zur Durchbrechung des Tachykardie-Substrats und vollständigen elektrischen Isolation. Dies wird durch das präzise 3D-Map sowie Ablationskatheter mit Anpressdruck-Feedback ermöglicht.
Vorhofflimmerablation – what’s next?
Für zwei kürzlich publizierte Studien wurden Patienten mit symptomatischem paroxysmalem Vorhofflimmern entweder für eine medikamentöse antiarrhythmische Therapie oder für eine First-Line-Ablationstherapie mittels Kryoballon randomisiert. Es zeigte sich ein deutlicher Vorteil für die Ablationsgruppe hinsichtlich Freiheit von Vorhofflimmernrezidiven.5,6
Derzeit stellt die First-Line-Ablationstherapie bei Betroffenen mit symptomatischem paroxysmalem Vorhofflimmern laut aktuellen Leitlinien noch eine IIa-Indikation dar (2020 ESC Guidelines), dies könnte sich in Anbetracht der nicht unerheblichen Nebenwirkungen einer medikamentösen antiarrhythmischen Dauertherapie sowie deren häufiger Wirkungslosigkeit in Zukunft in Richtung Klasse-I-Indikation ändern.
Bisher wird laut aktuellen Leitlinien die Indikation zur Katheter-interventionellen Ablation von Vorhofflimmern lediglich bei symptomatischen Patienten bzw. bei Tachykardie-induzierter Kardiomyopathie gestellt. Eine rezente groß angelegte Studie7 bei Betroffenen mit paroxysmalem oder persistierendem Vorhofflimmern und kardialen Vorerkrankungen zeigte einen deutlichen Vorteil einer frühen Rhythmisierungsstrategie (medikamentös oder mittels Ablationstherapie) gegenüber einer Standardtherapie hinsichtlich eines kombinierten Endpunkts aus kardiovaskulärem Tod, Schlaganfall und Hospitalisierung bei Herzinsuffizienz bzw. akutem Koronarsyndrom. Immerhin 30% dieser Patienten waren asymptomatisch, bei 26% bestand persistierendes Vorhofflimmern und 38% wurden nach der ersten Episode von Vorhofflimmern inkludiert.
Zusammenfassung
Die Katheter-interventionelle Ablation von Vorhofflimmern stellt mittlerweile eine State-of-the-Art-Therapie bei Patienten mit symptomatischem paroxysmalem oder persistierendem Vorhofflimmern bzw. bei Tachykardie-induzierter Kardiomyopathie dar. Hochpräzise 3D-Mapping-Systeme sowie spezialisierte Kathetertechnologien ermöglichen maximale Sicherheit und Effizienz der Prozeduren. Eine kritische Patientenselektion ist entscheidend, und die Ablationsstrategien sollen sich nach der zugrunde liegenden Pathologie richten. Die Ablation von Vorhofflimmern und linksatrialen Tachykardien sollte in spezialisierten Zentren mit ausreichender Erfahrung, auch hinsichtlich des Komplikationsmanagements, erfolgen.
Aufgrund der gravierenden epidemiologischen Bedeutung von Vorhofflimmern und der mit dieser Rhythmusstörung verbundenen gesundheitlichen Folgen wird die Katheter-interventionelle Ablationstherapie in Zusammenschau der aktuellen Datenlage in Zukunft wahrscheinlich auch für asymptomatische Patienten mit kardialen Vorerkrankungen eine Therapieoption darstellen.
Literatur:
1 The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC): 2020 ESC guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020: 42; 373-98 2 Verma A et al.: Approaches to catheter ablation for persistent atrial fibrillation. N Engl J Med 2015; 372: 1812-22 3 Kirchhof P, Calkins H: Catheter ablation in patients with persistent atrial fibrillation. Eur Heart J 2017; 38: 20-6 4 Hung Y et al.: Atrial tachycardias after atrial fibrillation ablation: how to manage? Arrhythm Electrophysiol Rev 2020; 9(2): 54-60 5 Andrade JG et al.: Cryoablation or drug therapy for initial treatment of atrial fibrillation. N Engl J Med 2021; 384: 305-15 6 Wazni OM et al.: Cryoballoon ablation as intial therapy for atrial fibrillation. N Engl J Med 2021; 384: 316-24 7 Kirchhof P et al.: Early rhythm-control therapy in patients with atrial fibrillation. N Engl J Med 2020; 383: 1305-16
Das könnte Sie auch interessieren:
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
Labormedizinische Fallstricke bei kardialen Markern
Bei Schädigung oder Stress des Herzmuskels werden kardiale Marker in den Blutkreislauf freigesetzt. Ihre labormedizinische Bestimmung spielt eine Schlüsselrolle in der Diagnostik, ...
,%20HFrEF%20=%20heart%20failure%20with%20reduced%20ejection%20fraction..jpg)