Diuretikatherapie und Diuretikaresistenz
Autoren:
Dr. med. Patrick Hofmann1,2
Prof. Dr. med. Thomas Fehr1,3
1 Department für Innere Medizin
Kantonsspital Graubünden, Chur
2 Physiologisches Institut
Universität Zürich
3 Universität Zürich
E-Mail: patrick.hofmann@ksgr.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die durch eine Natrium- und Volumenüberladung bedingte Hypervolämie ist der zentrale klinische Befund der ödematösen Erkrankung bei Herz-, Nieren- und Leberinsuffizienz. Obwohl Diuretika seit Jahrzehnten zum klinischen Alltag gehören, haben neue Medikamentenklassen und kürzlich publizierte Studiendaten nun erst den Grundstein für eine pathophysiologisch basierte, gezielte Diuretikatherapie gelegt.
Keypoints
-
Das Verständnis der Dosis-Wirksamkeits-Kurve ist wichtig für die korrekte Dosierung und Dosisanpassung der Schleifendiuretika. Dosisanpassung bedeutet Dosisverdopplung.
-
Neben Diurese und Gewichtsverlauf ist das Urinnatrium ein einfacher und prognostisch relevanter Parameter zur Beurteilung der Diuretikaeffizienz.
-
Die Diuretikaresistenz kann durch extrarenale und renale Ursachen bedingt sein. Nebst einer parenteralen Verabreichung und korrekten Dosisanpassung ist die Wahl der Co-Diuretika in Abhängigkeit von Elektrolytwerten, Metabolik und Komorbiditäten entscheidend.
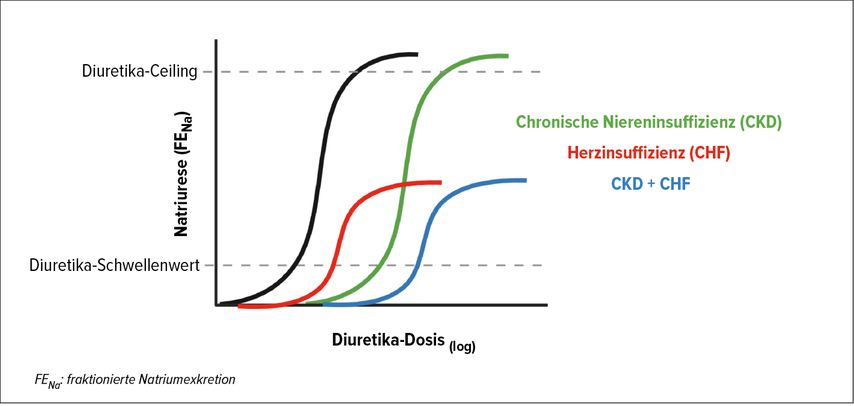
Schleifendiuretika bilden auch nach fast 50 Jahren klinischer Verwendung weiterhin einen wichtigen Pfeiler der Therapie ödematöser Erkrankungen. Sie wirken am luminal gelegenen Na+-K+-2Cl–-Cotransporter (NKCC2) im dicken aufsteigenden Teil der Henle-Schleife. Besonders wichtig für die korrekte Anwendung ist das Wissen darum, dass sich die Dosis-Wirksamkeits-Kurve logarithmisch-linear verhält. Dies bedeutet, dass nach dem Schwellenwert eine grosse zusätzliche Diuretikadosis notwendig ist, um eine geringe zusätzliche Natriurese zu induzieren (Abb. 1). Deshalb wird bei einer nicht adäquaten Diuretikawirkung eine Dosisverdopplung empfohlen. Weiter hängt der Verlauf dieser Dosis-Wirksamkeits-Kurve von einer etwaigen Grunderkrankung ab. So ist sie bei einer chronischen Niereninsuffizienz nach rechts verschoben und bei einer Herzinsuffizienz abgeflacht. Diuretika gehören somit zu den wenigen Medikamenten, die in der Dosis gesteigert werden müssen, wenn eine chronische Niereninsuffizenz vorliegt.1,2
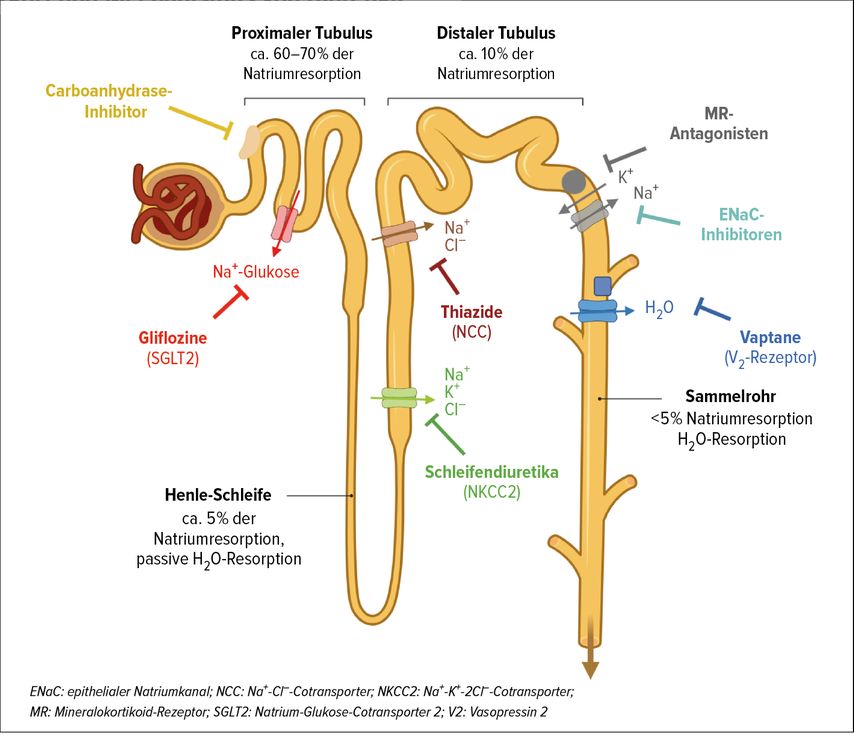
Wirkorte und -mechanismen der einzelnen Diuretikaklassen sind in Abbildung 2 dargestellt. Im proximalen Tubulus wirksame Diuretika sind Carboanhydraseinhibitoren (z.B. Acetazolamid), die zu einem renalen Bicarbonatverlust und einer milden Natriurese führen. Ebenfalls proximal wirken die Inhibitoren des Natrium-Glukose-Cotransporters 2 (SGLT2; Dapagliflozin, Empagliflozin, Canagliflozin), die sowohl eine Glukosurie mit osmotischer Diurese als auch eine milde Natriurese induzieren.
Beide proximal wirkenden Diuretika führen zu einem vermehrten Chloridangebot im distalen Tubulussystem und dadurch zu einer Aktivierung des tubuloglomerulären Feedbacks mit Vasokonstriktion des Vas afferens und einer verbesserten Effizienz der Schleifendiuretika.3
Thiaziddiuretika (Hydrochlorothiazid) und Thiazid-ähnliche Diuretika (z.B. Indapamid, Chlorthalidon, Metolazon) wirken im distalen Tubulus und führen im Vergleich zu Schleifendiuretika zu einer stärkeren Natriurese. Als kaliumsparende Diuretika gelten nebst Inhibitoren des epithelialen Natriumkanals (ENaC; z.B. Amilorid, Triamteren) die Mineralokortikoid-Rezeptorantagonisten. Letztere bilden die einzige Diuretikaklasse, die nicht luminal, sondern über einen nukleären Rezeptor wirkt und dadurch einen um 2 bis 3 Tage verzögerten Wirkeintritt hat.
Im Sammelrohr bewirken die Vaptane (z.B. Tolvaptan) via V2-Vasopressin-Rezeptoren eine Hemmung des Aquaporineinbaus und führen somit zu einer gesteigerten Aquarese.
Unerwünschte Wirkungen einer Diuretikatherapie
Die im klinischen Alltag am häufigsten anzutreffenden Nebenwirkungen von Diuretika sind Elektrolyt- und Säure-Basen-Verschiebungen (Tab. 1). Insbesondere bei der Wahl der Co-Diuretika ist es sinnvoll, ihren Einfluss auf Natrium, Kalium, Chlorid und Bikarbonat zu berücksichtigen.
Tab. 1: Elektrolytveränderungen der verschiedenen Diuretikaklassen. Die grossen Pfeile zeigen die durch die jeweilige Diuretikaklasse hervorgerufene Hauptelektrolytveränderung an
Eine akute Nierenschädigung tritt bei circa einem Drittel der mit einer Herzinsuffizienz hospitalisierten Patienten auf. Sie ist vordergründig durch eine venöse Kongestion und Hämokonzentration unter einer diuretischen Therapie bedingt und selten Ausdruck eines reellen strukturellen Nierenschadens.4–6
Weitere häufige Nebenwirkungen sind eine Hyperurikämie (die durch SGLT2-Inhibitoren aufgrund ihrer milden urikosurischen Wirkung günstig beeinflusst werden kann) und die Thiamindepletion durch hoch dosierte Schleifendiuretika.
Diuretikaeffizienz und -resistenz
Die Diuretikaresistenz kann zum einen qualitativ als ungenügende Dekongestion unter maximaler Diuretikadosis definiert werden und zum anderen quantitativ als Diurese <100ml/h in den ersten 6 Stunden, Gesamtdiurese <3l/24h oder Spot-Urinnatrium <50mmol/l.1,7 Insbesondere die Natriurese und die Natriumbilanz sind gute prognostische Parameter für eine Rehospitalisation und die kardiovaskuläre Mortalität.8–10 In der kürzlich publizierten PUSH-AHF-Studie wurde nun erstmals prospektiv randomisiert ein Urinnatrium-basiertes Diuretikatherapieprotokoll untersucht, für das eine gesteigerte Diurese und Natriurese bestätigt werden konnten.11
Die pathophysiologischen Mechanismen der Diuretikaresistenz sind vielfältig. Sie können in eine ungenügende Diuretikakonzentration/-absorption (durch viszerale Stauung, schwere Hypalbuminämie), eine eingeschränkte Diuretikasekretion in das Tubulussystem (z.B. durch nichtsteroidale Antirheumatika [NSAR]) und kompensatorische Mechanismen des Tubulussystems unterteilt werden. Einige Beispiele und mögliche therapeutische Optionen bei der Diuretikaresistenz sind in Tabelle 2 dargestellt.
Therapeutische Ansätze bestehen in der Dosissteigerung der Schleifendiuretika (Verdopplung) und einer Anpassung der Dosierungsintervalle. Furosemid hat eine Eliminationshalbwertszeit von circa 2 Stunden, sodass es aus physiologischer Sicht sinnvoll ist, das Medikament dreimal täglich anstatt wie häufig praktiziert zweimal täglich zu verabreichen.12 Insbesondere da es in der Zeit nach der Verabreichung zu einer kompensatorischen «Rebound-Natriumresorption» kommt.1
Bezüglich der «kontinuierlichen» Verabreichung von Schleifendiuretika versus Verabreichung als «Bolus» ist die Datenlage nicht konklusiv. Im berühmten DOSE-Trial konnte kein Unterschied zwischen den beiden Strategien festgestellt werden, jedoch gibt es Studien, die zeigen, dass insbesondere bei Personen mit einem hohen Risiko für eine Diuretikaresistenz, mit einer Niereninsuffizienz oder einer Hypotonie eine kontinuierliche Verabreichung einen besseren diuretischen Effekt aufweist.13,14
Ein häufig zu wenig beachteter Mechanismus der Diuretikaresistenz ist die Hypochlorämie, die durch Schleifendiuretika oder Thiazide begünstigt respektive aggraviert wird. Bereits eine milde Hypochlorämie führt zu einer Vervielfachung des Risikos für eine Diuretikaresistenz und ist ein ungünstiger prognostischer Marker hinsichtlich Rehospitalisation und Mortalität.15–19 Pathomechanismen sind eine Hochregulation von NKCC2 und NCC durch die Hypochlorämie und eine Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS).
Neue Aspekte der Diuretika bei kardiorenalen Erkrankungen
Mit ADVOR (Schleifendiuretika + Acetazolamid), EMPULSE (Schleifendiuretika + Empagliflozin) und CLOROTIC (Schleifendiuretika + Hydrochlorothiazid) sind drei der wegweisenden co-diuretischen Studien bei dekompensierter Herzinsuffizienz in diesem respektive dem vergangenen Jahr prominent publiziert worden.20–22 Zusammenfassend kann festgehalten werden, dass sämtliche Kombinationen wirksam sind und eine gesteigerte Diurese induzieren. Bezüglich der Sicherheitsendpunkte zeigten sich nur bei der Kombination mit Thiaziden vermehrt Elektrolytstörungen (Hypokaliämie) und akute Nierenschädigungen.
Besonders vielversprechend scheint Acetazolamid zu sein, da in Post-hoc-Analysen der ADVOR-Studie zusätzliche Vorteile bei Vorliegen einer metabolischen Alkalose (HCO3–>27mmol/l), einer Hypochlorämie oder einer eingeschränkten geschätzten glomerulären Filtrationsrate (eGFR) gezeigt werden konnten.
Die SGLT2-Inhibitoren werden in der Akuttherapie hinsichtlich ihres Stellenwerts zukünftig eher in den Hintergrund rücken und zum Grundpfeiler in der Therapie der chronischen Herzinsuffizienz unabhängig von der linksventrikulären Pumpfunktion werden. Während der Akutphase haben SGLT2-Inhibitoren diverse günstige Effekte wie die urikosurische und magnesiumsparende Wirkung, die Verbesserung der interstitiellen Drainage und Hämokonzentration sowie die Verbesserung von Erythropoiese und Eisenstoffwechsel.23 Basierend auf Studiendaten kann die Therapie mit SGLT2-Inhibitoren bei einer Hospitalisation aufgrund einer Herzinsuffizienz weitergeführt oder (falls noch keine Behandlung besteht) frühzeitig begonnen werden.
Pathophysiologisch basierte Diuretikatherapie
Mit den neuen Diuretikaklassen und basierend auf dem besseren pathophysiologischen Verständnis der Wirkweise sind die Voraussetzungen für eine individuellere Diuretikatherapie bei kardiorenal Erkrankten gegeben. Mit dem Urinnatrium liegt nun ein validierter Messparameter vor, der eine frühe individuelle Dosisanpassung der Schleifendiuretika erlaubt. SGLT2-Inhibitoren können früh co-diuretisch und in Hinblick auf die Prognoseeingesetzt werden. Der Stellenwert von Acetazolamid in der frühen Therapie in Kombination mit Schleifendiuretika und SGLT2-Inhibitoren ist noch unklar; künftige Studien werden hier hoffentlich Klarheit bringen. Liegt trotz korrekter Dosissteigerung eine Diuretikaresistenz vor, kann anhand der Elektrolytwerte (Natrium, Kalium, Chlorid), des pH-Werts und der Komorbiditäten die optimale co-diuretische Therapie ausgewählt werden. Häufige Elektrolytmuster und mögliche Therapieansätze inklusive der Angabe entsprechender Studien sind in Tabelle 3 abgebildet.
Disclosure:
Die Autoren deklarieren, keine finanziellen oder persönlichen Verbindungen im Zusammenhang mit diesem Beitrag zu haben.
Literatur:
1 Ellison DH, Felker GM: Diuretic treatment in heart failure. N Engl J Med 2017; 377: 1964-75 2 Novak JE, Ellison DH: Diuretics in states of volume overload: core curriculum 2022. Am J Kidney Dis 2022; 80: 264-76 3 Packer M et al.: Critical analysis of the effects of SGLT2 inhibitors on renal tubular sodium, water and chloride homeostasis and their role in influencing heart failure outcomes. Circulation 2023; 148: 354-72 4 Forman DE et al.: Incidence, predictors at admission, and impact of worsening renal function among patients hospitalized with heart failure. J Am Coll Cardiol 2004; 43: 61-7 5 Mullens W et al.: Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. J Am Coll Cardiol 2009; 53: 589-96 6 Ahmad T et al.: Worsening renal function in patients with acute heart failure undergoing aggressive diuresis is not associated with tubular injury. Circulation 2018; 137: 2016-28 7 Hoorn EJ, Ellison DH: Diuretic resistance. Am J Kidney Dis 2017; 69: 136-42 8 Hodson DZ et al.: Natriuretic response is highly variable and associated with 6-month survival insights from the ROSE-AHF trial. JACC: Heart Fail 2019; 7: 383-91 9 Martens P et al.: Assessing intrinsic renal sodium avidity in acute heart failure: implications in predicting and guiding decongestion. Eur J Heart Fail 2022; 24: 1978-87 10 Verbrugge FH et al.: Natriuretic response to acetazolamide in patients with acute heart failure and volume overload. J Am Coll Cardiol 2023; 81: 2013-24 11 ter Maaten JM et al.: Natriuresis-guided diuretic therapy in acute heart failure: a pragmatic randomized trial. Nat Med 2023; 29: 2625-32 12 Huang X et al.: Everything we always wanted to know about furosemide but were afraid to ask. Am J Physiol Renal 2016; 310: 958-71 13 Felker GM et al.: Diuretic strategies in patients with acute decompensated heart failure. N Engl J Med 2011; 364: 797-805 14 Frea S et al.: Diuretic treatment in high-risk acute decompensation of advanced chronic heart failure – bolus intermittent vs. continuous infusion of furosemide: a randomized controlled trial. Clin Res Cardiol 2020; 109: 417-25 15 Testani JM et al.: Hypochloraemia is strongly and independently associated with mortality in patients with chronic heart failure. Eur J Heart Fail 2016; 18: 660-8 16 ter Maaten JM et al.: Hypochloremia, diuretic resistance, and outcome in patients with acute heart failure. Circ Heart Fail 2018; 9: 003109 17 Hanberg JS et al.: Hypochloremia and diuretic resistance in heart failure. Circ Heart Fail 2018; 9: 003180 18 Grodin JL et al.: Importance of abnormal chloride homeostasis in stable chronic heart failure. Circ Heart Fail 2018; 9: 002453 19 Grodin JL et al.: Prognostic role of serum chloride levels in acute decompensated heart failure. J Am Coll Cardiol 2015; 66: 659-66 20 Mullens W et al.: Acetazolamide in acute decompensated heart failure with volume overload. N Engl J Med 2022; 387: 1185-95 21 Voors AA et al.: The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med 2022; 28: 568-74 22 Trullàs JC et al.: Combining loop with thiazide diuretics for decompensated heart failure: the CLOROTIC trial. Eur Heart J 2022; 44: 411-21 23 Biegus J et al.: Sodium–glucose cotransporter-2 inhibitors in heart failure: potential decongestive mechanisms and current clinical studies. Eur J Heart Fail 2023; 25: 1526-36
Das könnte Sie auch interessieren:
Therapie der ANCA-assoziierten Vaskulitis: Gibt es steroidfreie Alternativen?
Noch in den 1950er-Jahren verstarben rund 90% der Patient:innen, die an einer mit antineutrophilen zytoplasmatischen Antikörpern (ANCA) assoziierten Vaskulitis litten, im ersten Jahr ...
Die neue ADPKD-Guideline von KDIGO
Im Januar 2025 veröffentlichte KDIGO (Kidney Disease: Improving Global Outcomes) erstmals eine dezidierte Leitlinie zu Diagnostik und Therapie der autosomal-dominanten polyzystischen ...
Chloride in the spotlight – the hidden driver of acid-base homeostasis
Chloride is the most abundant extracellular anion and contributes fundamentally to osmolality, electroneutrality, and acid-base balance. Despite this central role, it has often received ...