Vom normalen Altern bis zur Antikörpertherapie
Bericht:
Torsten U. Banisch, PhD
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Prof. Elisabeth Stögmann von der Universitätsklinik für Neurologie in Wien gab einen tiefen Einblick in die neuesten Entwicklungen in der Diagnostik und Therapie der Alzheimerdemenz. Sie berichtete von Fortschritten mit Blut-Biomarkern und deren Anwendung bei der Risikoabschätzung in der Frühdiagnostik. Sie stellte zudem neue Antikörper-basierte Therapien vor und diskutierte, wie diese Fortschritte das Behandlungszeitfenster verschieben und den Patientenweg hin zur Therapie verändern werden.
Kontinuum der Alzheimererkrankung
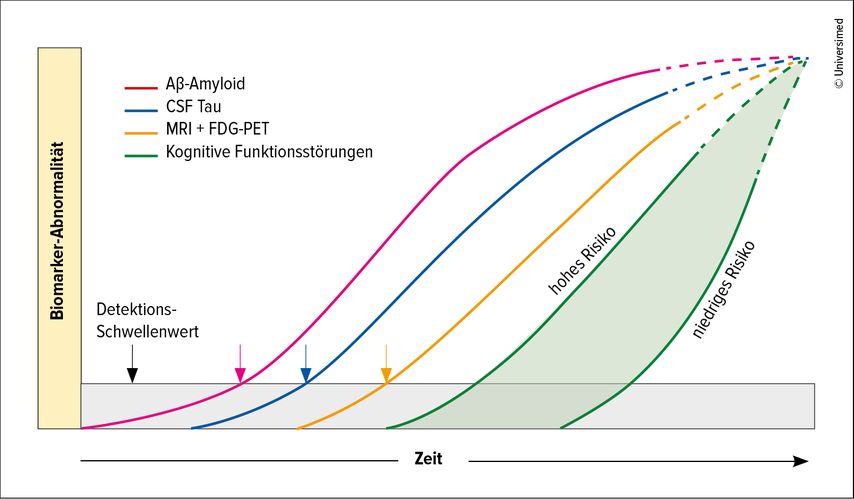
Anhand von Biomarkern konnte nachgewiesen werden, dass bereits 15–20 Jahre vor Auftreten erster kognitiver Symptome neuropathologische Veränderungen im Gehirn vorliegen: anfänglich eine Amyloid-Pathologie, gefolgt von Tau-Pathologie und einsetzender Neurodegeneration (Abb. 1). Diese lange Silent-Periode geht in die Risikovorstufe, die leichte kognitive Beeinträchtigung (MCI), und später die Alzheimerdemenz über.1–5 Dies macht die Aufnahme von Biomarkern in die Diagnostik unverzichtbar.
Diagnostik von MCI
Hochrechnungen für Österreich gehen von 300000 Personen mit MCI aus, also 10% der 55-Jährigen, wobei Menschen mit MCI und positivem Biomarkerbefund ein 90%iges Risiko haben, innerhalb der nächsten 5 Jahre Alzheimer zu entwickeln.6 MCI ist nur schwer zu diagnostizieren, da die zugrunde liegende Kognition aus mehreren Domänen besteht, die auch mit dem normalen Altern schlechter werden.7–10
Eine aufwendige Diagnostik umfasst eine gründliche Anamnese, Neuropsychologie und Magnetresonanztomografie, Biomarkerbestimmung mittels PET oder Liquoruntersuchungen und eine abschließende Beratung. Die Fehldiagnoserate ohne Biomarkerbefunde liegt selbst in spezialisierten Zentren bei 25–30%.
Blut-Biomarker als Zukunft der klinischen (Früh-)Diagnostik
Das Aufkommen von Blut-Biomarkern kann bei einer genauen Frühdiagnose, der Abschätzung von Prognosen und der Therapieoptimierung helfen, diese werden jedoch vermutlich erst in den nächsten 5 Jahren kommerziell verfügbar sein. Eine Risikoabschätzung durch Bluttest, kognitiven Kurztest und Imaging liegt ebenfalls in der nicht allzu fernen Zukunft. Erste Studien zeigen bereits, dass diese Kombinationsdiagnostik ähnlich gut wie CSF-basierte Methoden und besser als Experten-basierte klinische Diagnosen ist.11 Eine frühe Diagnose kann Patient:innen Klarheit verschaffen und ermöglicht ein frühzeitiges Risikomanagement.
Neue, krankheitsverlangsamende Therapieoptionen
Trotz der Fortschritte in der Diagnostik gab es seit 2002 keine neuen Therapien. Das änderte sich dieses Jahr mit 2 Studien zur Wirkung monoklonaler Antikörper: Lecanemab bindet an Amyloid-β-Protofibrillen und zeigte eine klinische Verbesserung, eine Verlangsamung des Fortschreitens der Erkrankung um 27% bei einem Beobachtungszeitraum von 18 Monaten.12 Dies ging mit einer Reduktion von Amyloid-PET und Tau-Biomarkern einher. Jedoch verursacht die Therapie „amyloid-related imaging abnormalities“ (ARIA). Das sind Hirnblutungen und Ödeme, welche je nach Risikogenetik 5,4%–32,6% der Patient:innen betrafen.12
Donanemab richtet sich gegen Amyloid-Plaques.13 Auch hier wurde eine Verlangsamung der Erkrankung nach 76 Wochen um 35% bei Patient:innen im frühen Krankheitsstadium und bei 22% im späteren Stadium ermittelt. Patient:innen, die während der Behandlung negative Amyloid-PETs entwickelten und auf Placebo gesetzt wurden, zeigten ebenfalls einen Behandlungserfolg. Auch hier entwickelten 24% der Patient:innen ARIA, davon 6% symptomatisch mit Kopfschmerzen, selten mit epileptischen Anfällen, und es gab 3 Todesfälle.13
Reform des Patientenweges
Die neuen Therapien werden 2024 zugelassen, aufgrund der Nebenwirkungen aber nur auf Grundlage gesicherter Biomarkerdiagnosen, einer Bestimmung des Risikogenotyps in Bezug auf Erkrankung und ARIA und genauester Aufklärung der Patient:innen. Durch die Verkleinerung des therapeutischen Zeitfensters muss auch der Patientenweg angepasst werden. Es wäre vorstellbar, dass Allgemeinmediziner die Anamnese und Screenings durchführen, Fachärzte die neuropsychologische Diagnostik und MRT und spezialisierte Gedächtniskliniken die Biomarkerdiagnostik und Einstellung auf Antikörpertherapien. Die Vereinheitlichung der Zuweisungswege und Triagierung der Kapazitäten würden gewährleisten, dass Patient:innen zum richtigen Zeitpunkt in die Therapien einsteigen können.
Quelle:
Prof. Elisabeth Stögmann: „Demenz – vom normalen Altern bis zur Antikörpertherapie“, präsentiert auf der Tagung der ÖGPB 2023
Literatur:
1 Jack CR et al.: Biomarker modeling of Alzheimer’s disease. Neuron 2013; 80(6): 1347-58 2 Bateman RJ et al.: Clinical and biomarker changes in dominantly inherited Alzheimer’s disease. N Engl J Med 2012; 367(9): 795-804 3 Dubois B et al.: Advancing research diagnostic criteria for Alzheimer’s disease: the IWG-2 criteria. Lancet Neurol 2014; (6): 614-29 4 McKhann GM et al.: The diagnosis of dementia due to Alzheimer‘s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer‘s disease. Alzheimers Dement 2011; 7(3): 263-9 5 Jack CR et al.: NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimer‘s Dement 2018; 14(4): 535-62 6 Galvin JE: Editorial: Screening for mild cognitive impairment: There is the will but is there a way? J Prev Alzheimers Dis 2020; 7(3): 144-5 7 Harvey PD: Domains of cognition and their assessment. Dialogues Clin Neuroscience 2019; 21(3): 227-37 8 Zilli EA et al.: Modeling the role of working memory and episodic memory in behavioral tasks. Hippocampus 2008; 18(2): 193-209 9 Ward M et al.: Assessment for apraxia in mild cognitive impairment and Alzheimer’s disease. Dement Neuropsychol 2015; 9(1): 71-5 10 Park DC et al.: The adaptive brain: aging and neurocognitive scaffolding. Annu Rev Psychol 2009; 60: 173-96 11 Palmqvist S et al.: Prediction of future Alzheimer’s disease dementia using plasma phospho-tau combined with other accessible measures. Nat Med 2021; 27(6): 1034-42 12 van Dyck CH et al.: Lecanemab in early Alzheimer’s disease. N Engl J Med 2023; 388(1): 9-21 13 Sims JR et al.: Donanemab in early symptomatic Alzheimer disease: The TRAILBLAZER-ALZ 2 randomized clinical trial. JAMA 2023; 330(6): 512-27
Das könnte Sie auch interessieren:
Neues und Unpubliziertes aus der psychiatrischen Forschung und Therapie
Von 7. bis 8. November 2024 fand die 26. Jahrestagung der Österreichischen Gesellschaft für Neuropsychopharmakologie und Biologische Psychiatrie (ÖGPB) in Wien statt. Im Festsaal der ...
Demenz, Depression und Schizophrenie
In den letzten Jahren konnten die Erkenntnisse über die molekularen Grundlagen neurologisch-psychiatrischer Leiden wie Alzheimerdemenz, Depression und Schizophrenien stark erweitert ...
Differenzialdiagnosen der Erschöpfungserkrankungen
Erschöpfung, Erschöpfbarkeit und Müdigkeit sind Symptome, die keiner bestimmten Erkrankung eindeutig zuordenbar sind. Zusätzlich macht die umgangssprachliche Verwendung der Begriffe ...