Die tiefe Hirnstimulation bei Epilepsie
Autoren:
PD Dr. med. Lukas Imbach1
PD Dr. med. Lennart Stieglitz2
1Schweizerisches Epilepsie-Zentrum
Klinik Lengg AG, Zürich
2 Department für Neurochirurgie
Universitätsspital und Universität Zurich
E-Mail: Lukas.Imbach@kliniklengg.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Mit der tiefen Hirnstimulation steht Behandlern eine neue Therapieoption für pharmakotherapierefraktäre Patientinnen und Patienten zur Verfügung. Dieser Beitrag gibt eine umfassende Übersicht über dieses Thema und fasst die Studienlage zur Therapie sowie aktuelle Forschungsbestrebungen zusammen.
Einführung
Epilepsie ist eine häufige neurologische Erkrankung und betrifft ca. 1% der Bevölkerung.1 Die initiale Behandlungsstrategie nach Diagnosestellung besteht in einer zielgerichteten und in gewissen Fällen kombinierten Pharmakotherapie mit einem oder mehreren antikonvulsiven Medikamenten.2 In ca. 70% der Fälle kann dadurch eine anhaltende Anfallsfreiheit erreicht werden.3 Bei ca. einem Drittel der Patienten können die Anfälle aber nicht medikamentös unterdrückt werden und es stellt sich ein sogenannter pharmakotherapierefraktärer Verlauf ein. Diese Patientinnen und Patienten werden an spezialisierten Epilepsiezentren hinsichtlich eines epilepsiechirurgischen Eingriffes abgeklärt. In erster Linie wird dabei versucht, einen führenden epileptogenen Fokus zu identifizieren und diesen in einem zweiten Schritt operativ zu entfernen.2
Diese Herangehensweise hat eine sehr hohe Effektivität und führt zu anhaltender Anfallsfreiheit bei 60–80% der operierten Patienten.4 Da nach einem resektiven Eingriff im weiteren Verlauf meist die Medikation auch signifikant reduziert oder sogar ausgeschlichen werden kann, kann dieses Verfahren eine Epilepsie im chronischen Verlauf sogar heilen. Bei vielen Patienten ist ein solcher chirurgischer Eingriff allerdings nicht möglich, z.B. weil die epileptischen Anfälle aus verschiedenen Hirnarealen (multifokale Epilepsie) kommen oder weil sich der epileptische Fokus in einem eloquenten Areal (z.B. der Sprachregion oder dem primär motorischen Cortex) befindet und bei einer Resektion nicht tolerierbare anhaltende Nebenwirkungen zu befürchten wären. Diese relevant grosse Gruppe von Patienten hat im weiteren Verlauf durch die kombinierte Pharmakotherapie relativ geringe Chancen auf Anfallsfreiheit und ist dringend auf weitere nichtmedikamentöse Therapieoptionen angewiesen. Die Neuromodulation zur Epilepsiebehandlung ist hierfür eine wirksame Therapieoption. Prinzipiell stehen hierfür die responsive Neurostimulation (RNS-Gerät, nur in den USA zugelassen), die extrakranielle Vagusnervstimulation und die tiefe Hirnstimulation («deep brain stimulation», DBS; Abb. 1) zur Verfügung. Aktuell wird zudem die chronische transkranielle Sub-Skalp-Stimulation experimentell untersucht. Vergleichende Studien zu diesen Verfahren gibt es keine, sodass diese Therapieentscheidungen anhand von potenziellen Nebenwirkungen, der klinischen Erfahrung und der Verfügbarkeit der Verfahren am jeweiligen Zentrum getroffen werden müssen. Dieser Artikel befasst sich ausschliesslich mit der tiefen Hirnstimulation als Epilepsietherapie und hat zum Ziel, eine Übersicht über die Studienlage zur Wirksamkeit der Therapieindikation und die aktuellen Forschungsrichtungen zu geben.
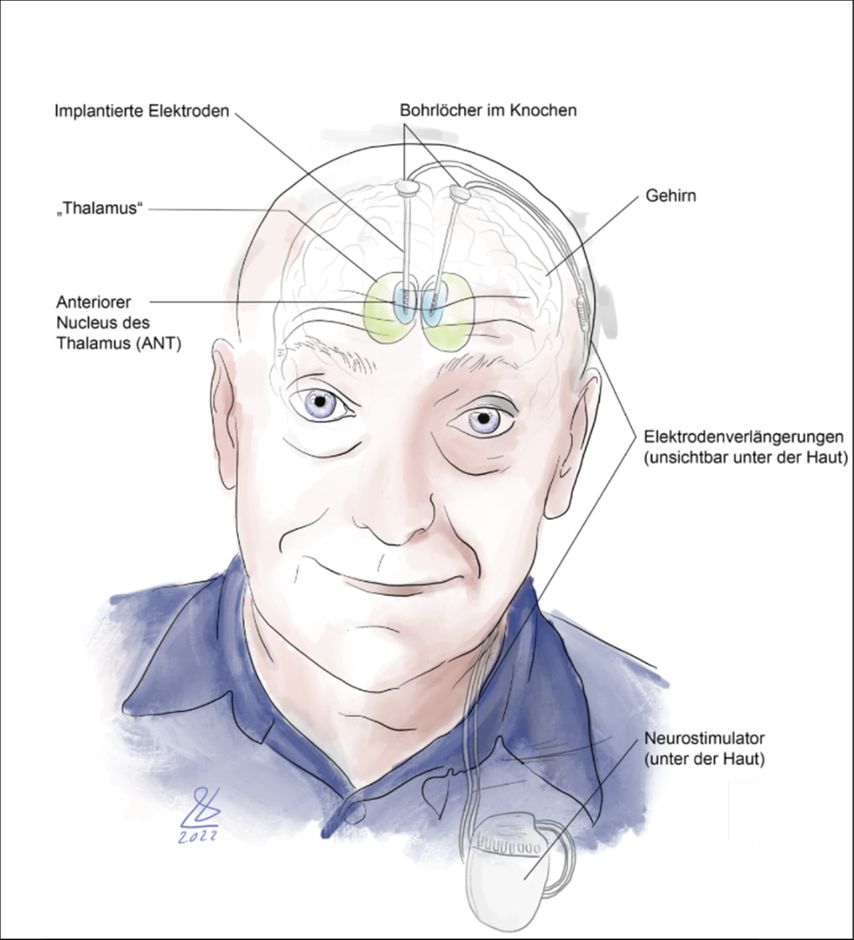
Abb. 1: Illustrative Übersicht über ein DBS-System mit Neurostimulator, Elektrodenverlängerungen und implantierten Elektroden im Thalamus
Aktuelle Datenlage
Erste Versuche, die tiefe Hirnstimulation bei Epilepsiepatienten in therapeutischer Hinsicht anzuwenden, erfolgten bereits in den 1970er-Jahren. Die frühesten Versuche wurden basierend auf der Hypothese der antikonvulsiven Wirksamkeit von zerebellärer Aktivität im Kleinhirn durchgeführt5 und später in weiteren Fallserien erforscht.6 Diese Verfahren blieben auch aufgrund der neurochirurgischen Herausforderungen bei der Elektrodenplatzierung im Cerebellum insgesamt nur gering wirksam. Im weiteren Verlauf wurden dann in den Jahren zwischen 1995 bis 2010 verschiedene weitere Targets in kleineren Fallserien untersucht. Insbesondere der zentromediane Thalamus,6,7 der Hippocampus8,9 sowie auch der subthalamische Nucleus10 wurden in diesem Zusammenhang für die chronische Stimulation erprobt. Die Anfallsreduktion in diesen Fallserien mit bis zu 20 Patienten pro Studie lagen zwischen 10 und 30%.11 Eine einzige Studie hat bislang in prospektiver und kontrollierter Art bei fokalen Epilepsien in einer grösseren Patientenkohorte die Wirksamkeit der tiefen Hirnstimulation in einem verblindeten Studiendesign untersucht. In der 2010 publizierten SANTE-Studie (Stimulation of the Anterior Nucleus of the Thalamus for Epilepsy) von Fischer und Mitarbeitern wurde in einer multizentrischen nordamerikanischen Studie bei 109 Patienten in einem kontrollierten Setting unter Sham-Stimulation und aktiver Stimulation in der Akutphase eine Anfallsreduktion von 40% dokumentiert.12 Im weiteren Verlauf zeigte sich in dieser Kohorte im Verlauf der nächsten 7 bis 10 Jahre eine signifikante und anhaltende und im Verlauf eher noch zunehmende Anfallsreduktion bis 70%, was den neuromodulativen Effekt der Methode untermauert.13,14 In dieser Studie eingeschlossen wurden ausschliesslich Patienten mit fokalen Epilepsien, d.h. Patienten mit fokalen Anfällen mit und ohne bewusstes Erleben sowie mit fokal zu bilateral tonisch-klonisch epileptischen Anfällen.12 Weitere Fallberichte unterstreichen die akute Wirksamkeit auch im Status epilepticus.15 Patienten mit genetischen generalisierten Epilepsien wurden nicht eingeschlossen, und bezüglich der Wirksamkeit der anterior-thalamischen Stimulation ist in dieser Gruppe demzufolge nichts bekannt. Recht gute Daten gibt es aktuell auch zur Stimulation im zentromedianen Thalamus. Hier wurden insbesondere Patienten mit frontalen Epilepsien, aber auch Patienten mit genetisch generalisierten Epilepsien (welche nicht in der SANTE-Studie eingeschlossen waren) durch die Gruppen von Velasco und Mitarbeitern sowie Patienten mit Lennox-Gastaut-Syndrom durch Dalic und Mitarbeiter in Australien in kleineren, aber gut kontrollierten Studien untersucht.7,16,17 Auch in dieser Kohorte zeigte sich eine relevante Anfallsreduktion durch chronische Stimulation in allen Anfallssemiologien.
Patienten und Indikation
Die SANTE-Studie hat ausschliesslich Patienten mit fokaler Epilepsie eingeschlossen, sodass die Wirksamkeit der tiefen Hirnstimulation und auch die Indikation dazu prinzipiell ausschliesslich für die fokalen Epilepsien mit und ohne sekundärer Generalisierung gelten.12 Aufgrund der Datenlage und Therapieindikation erlangte das DBS-System daher für die Indikation fokale Epilepsie europaweit im Jahr 2010 ein CE-Zertifikat und 2018 die FDA-Zulassung. Patienten mit primär generalisierten Epilepsien können hingegen basierend auf den oben aufgeführten kleineren Studien mit teilweise sehr gutem Ansprechen für eine Implantation im zentromedianen Thalamus abgeklärt werden.
Wirksamkeit und Nebenwirkungen
In der prospektiv kontrollierten und verblindeten Phase der SANTE-Studie zeigte sich eine Anfallsreduktion um 40 %. Im weiteren Verlauf wurde die Patientenkohorte über einen Zeitraum bis 7 Jahre nachkontrolliert und hinsichtlich anhaltender Wirksamkeit untersucht. Diese Langzeitdaten sind mit Vorsicht zu interpretieren, insbesondere weil nach Abschluss der Studie auch weitere Therapieumstellungen medikamentöser Art in der Patientenkohorte erlaubt waren. Dennoch ist es beachtlich, dass im Langzeitverlauf diese sehr schwierig zu behandelnde Patientenkohorte eine mediane Reduktion der Anfallsfrequenz bis 70 % aufwies. Weitere offene Behandlungsserien zeigten zudem positive Effekte auf die Anfallsschwere und die Lebensqualität unter chronischer tiefer Hirnstimulation. Wichtig ist, dass die signifikante Verbesserung der Lebensqualität gemäss QOLIE-31-Fragebogen über einen Zeitraum von 7 Jahren konstant bleibt.13 Als weiterer Ausdruck der Effektivität der anteriorthalamischen DBS war in der SANTE-Studie auch die Anzahl anfallsbedingter Verletzungen in der Stimulationsgruppe deutlich geringer: Es zeigten sich bei 7% der aktiv stimulierten Patientinnen und Patienten vs. 25% in der Kontrollgruppe relevante Verletzungen. Schliesslich war die SUDEP-Rate («sudden unexpected death in epilepsy») im Langzeitverlauf mit 2/1000 Patienten Jahren in dieser von der Epilepsie schwer betroffenen Patientenkohorte vergleichsweise gering.
Patientenselektion
Eine wichtige Erkenntnis dieser Zulassungsstudie war, dass die mediane Reduktion der Anfallsfrequenz im weiteren Verlauf der Stimulation bei der Mehrheit der Patienten zunimmt. Andererseits zeigt sich auch, dass die Variabilität des Therapieansprechens auf die anterior-thalamische Stimulation sehr gross ist. Während eine mediane Anfallsreduktion von 50–60% nach 1–2 Jahren im Mittel erwartet werden darf, gibt es auch eine kleine Patientengruppe von ca. 10%, welche einen anhaltend anfallsfreien Verlauf erreicht.13 Demgegenüber besteht aber auch bei 5 bis 10% der Patientinnen und Patienten ein komplettes Nichtansprechen, in Einzelfällen kann sogar eine Zunahme der epileptischen Aktivität auftreten. Wichtig für die Beratung der Patientinnen und Patienten und das Stellen einer guten Therapieindikation wäre es daher, das Therapieansprechen auf die tiefe Hirnstimulation im individuellen Fall vorhersagen zu können. Erste retrospektive Analysen aus der Kohorte der SANTE-Studie zeigten Hinweise darauf, dass Patientinnen und Patienten mit temporalem Anfallsursprung besonders gut auf die ANT-Stimulation ansprechen. Neuroanatomisch ist dies plausibel, da durch den Papez-Kreis der anteriore Thalamus, der Hippocampus und die Corpora mamillaria in einem Netzwerk verbunden sind und so die epileptische Aktivität z.B. aus dem Temporallappen auch im anterioren thalamischen Nucleus unterdrückt werden kann. Kleinere Fallserien konnten diesen Effekt teilweise bestätigen, wobei insgesamt die eingeschlossenen Kohorten hinsichtlich der Epilepsie, der Vorbehandlung, der Anfallsschwere, der Anfallsfrequenz oder der assoziierten Schlafstörungen sehr heterogen sind. Somit sind entsprechende retrospektive Subgruppenanalysen hinsichtlich des Therapieansprechens schwierig zu interpretieren; viele sich beeinflussende Variablen (z.B. die Medikation, der Anfallsursprung oder die Schwere der Epilepsie) müssten dafür multifaktoriell analysiert werden, was breit angelegte Patientenkohorten benötigen würde. Hinsichtlich der Patientenselektion kann auch die Anfallsschwere ein wichtiges Kriterium sein. In der Kohorte der an unserem Zentrum implantierten Patienten mit fokaler Epilepsie zeigt sich beispielsweise, dass nach der Implantation der tiefen Hirnstimulation generalisiert tonisch-klonische epileptische Anfälle und auch Status epileptici äusserst selten vorkommen. Prospektive kontrollierte Studien zu diesem Thema sind allerdings noch keine vorhanden.
Operative Aspekte und Sicherheit
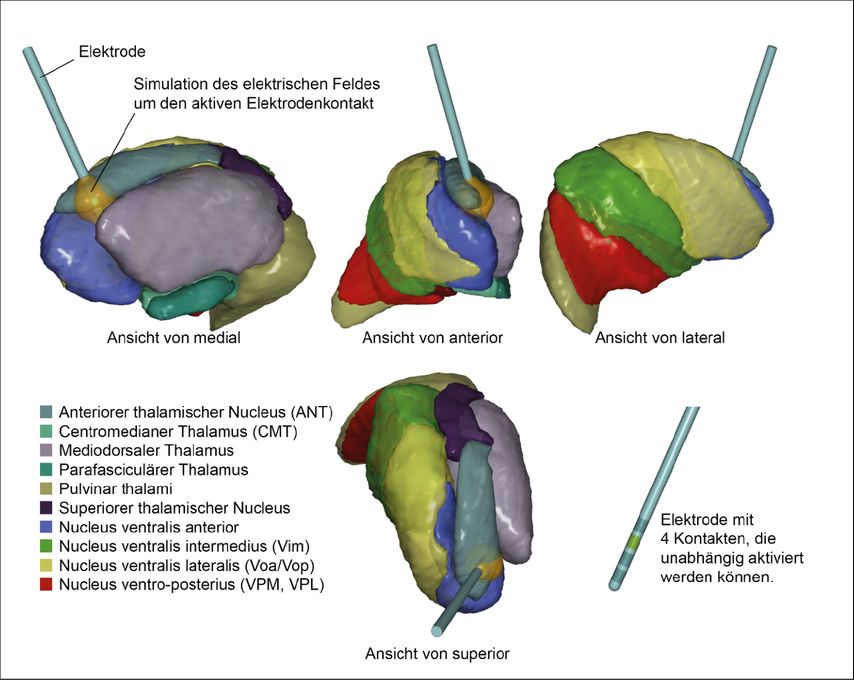
Der operative Eingriff wird bei Epilepsiepatienten in Narkose durchgeführt. Dazu werden in die Zielgebiete beider Hirnhälften Elektroden millimetergenau («stereotaktisch») implantiert. Da der anteriore thalamische Nucleus direkt unterhalb der Seitenventrikel liegt, ist er am besten durch den Ventrikel hindurch zu erreichen. Während der Operation kann ein EEG abgeleitet und die Wirksamkeit der Stimulation (mit Limitationen) direkt ausgetestet werden. Die Abbildung 2 zeigt die Lage einer implantierten Elektrode in Projektion auf den Thalamus.
Abb. 2: Im anterioren thalamischen Nucleus implantierte Elektrode. Das postoperativ angefertigte Computertomogramm wurde mit dem präoperativen MRT überlagert. Die verschiedenen Kerne des Thalamus wurden mit der Software Medtronic SureTune 4.0 segmentiert und dargestellt
Als relevante Sicherheitsaspekte der tiefen Hirnstimulation müssen einerseits die allgemeinen neurochirurgischen Risiken diskutiert werden, andererseits sind auch relevante Nebenwirkungen durch die anhaltende Stimulation möglich. Hinsichtlich der neurochirurgischen Risiken wurden in der SANTE-Studie bei bis zu 12 % der Patienten Infektionen berichtet, die in den meisten Fällen im Bereich der Stimulatortasche auftraten und bei weniger als 2% der Patienten in der Region des Bohrloches.12 In der Gesamtkohorte von 109 Patienten kam es in einem Fall zu einer Meningitis. Eine intrazerebrale Infektion trat nicht auf. Intrazerebrale Blutungen entlang der Implantationstrajektoren im Sinne einer Stichkanalblutung können auftreten und wurden in der SANTE-Studie bei 5 von 110 Patienten berichtet. Hierbei trat kein klinisches Korrelat auf. Eine intrazerebrale Massenblutung als Folge einer DBS-Implantation ist eine gravierende, aber äusserst seltene Nebenwirkung einer stereotaktischen Implantation. Dieses Risiko liegt in unserem Zentrum unter 1% (eigene, unpublizierte Fallserie aus dem Universitätsspital Zürich, Daten: Lennart Stieglitz. Zudem ist es wichtig für die Patientenberatung hinsichtlich eines operativen Eingriffs, dass die Komplikationsrate an erfahrenen Zentren deutlich geringer ist als in den multizentrischen Studien berichtet, da in den Zulassungsstudien teilweise Zentren mit eingeschlossen wurden, in denen nur sehr wenige Patienten operiert wurden.18–20
Stimulationsbedingte Nebenwirkungen
Hinsichtlich der stimulationsbedingten Nebenwirkungen nach der Implantation wurden in der SANTE-Studie Gedächtnisprobleme sowie auch Stimmungsschwankungen (depressive Stimmungslage) beschrieben.12,13,21 Diese Nebenwirkungen waren in allen Fällen stimulationsabhängig und durch eine Umstellung oder durch Ausschalten der Stimulation vollständig reversibel. In unserer klinischen Erfahrung zeigen sich unter niedrigamplitudiger Stimulation (< 3 mA) keine relevanten Nebenwirkungen im neuropsychologischen oder psychiatrischen Bereich. Als weitere mögliche unerwünschte Wirkung wurde in der SANTE-Studie eine Zunahme der Anfallsfrequenz bei ca. 10% der Patienten berichtet, welche ebenfalls stimulationsabhängig reversibel war.13 Eine post Zulassung erschienene Studie über den Effekt der anterior-thalamischen DBS auf den Schlaf zeigte ferner, dass bei zyklischer Stimulation eine stimulationsabhängige Fragmentierung des Nachtschlafs auftreten kann. Aufgrund der bekannten gegenseitigen Interaktion zwischen Epilepsie und Tiefschlaf kann eine Schlaffragmentierung mit konsekutiven relativem Schlafentzug das Therapieansprechen somit möglicherweise einschränken.22 Aktuelle Studiendaten aus unserem Zentrum zeigen allerdings, dass die Umstellung auf eine niedrigamplitudige kontinuierliche Hirnstimulation nicht zu einer Schlaffragmentierung führt, im Gegenteil sogar zu einer Konsolidierung des Tiefschlafs führen kann.23 Weitere Studien in diesem Bereich, insbesondere bei Patienten mit schlafassoziierten Epilepsien oder nächtlich unbemerkten Anfallsmustern, wären zur weiteren Untersuchung dieser Effekte notwendig.
Weitere Zielpunkte und aktuelle Studien
Für die fokale Epilepsie ist die Stimulation des anterioren Thalamus aufgrund der aktuellen Studienlage zu bevorzugen.11,19 In den Zulassungsstudien wie auch in der Erfahrung einzelner grösserer Zentren zeigt sich allerdings, dass bei frontalen Epilepsien das Ansprechen eher geringer ist und diesbezüglich allenfalls weitere Stimulationspunkte gefunden werden müssten. Eine kürzlich erschienene Studie zur tiefen Hirnstimulation im zentromedianen Thalamus bei Patienten mit frontalen Epilepsien zeigt, dass diese bei der fokalen frontalen Epilepsie einen positiven Effekt haben kann, aber ein eher geringes Ansprechen zeigt.16,24 Also bleibt die Wirksamkeit der DBS in dieser schwierig zu therapierenden Subkohorte insgesamt fraglich, wobei im Einzelfall Patienten mit refraktären frontalen Anfällen durchaus mit einer (anterior-thalamischen)-DBS probatorisch behandelt werden können. Weitere experimentelle Zielpunkte mit aktuell geplanten Studien beinhalten den Nucleus accumbens25 sowie den Pulvinar.26 Eine kürzlich erschienene kleinere, aber sehr gut kontrollierte Studie untersuchte die tiefe Hirnstimulation im zentromedianen Thalamus bei Patienten mit Lennox-Gastaut-Syndrom und zeigte in dieser sehr schwierig zu behandelnden Gruppe eine beachtliche Anfallsreduktion von bis zu 50%.17 Ähnlich dazu zeigten Velasco und Mitarbeiter bereits in früheren Fallserien, dass bei generalisierten (genetisch bedingten) Epilepsien ausserhalb des Lennox-Gastaut-Syndroms mit Absencen und generalisierten tonisch-klonischen epileptischen Anfällen die zentromediane Thalamusstimulation ebenfalls sehr wirksam sein kann.7Insgesamt zeigt sich also, dass für die heterogene Gruppe der Epilepsiepatienten mit verschiedenen fokalen Anfallsursprüngen und andererseits auch genetisch bedingten generalisierten Epilepsien in Zukunft verschiedene Stimulationspunkte auf individueller Basis geprüft werden müssen. Aufgrund der aktuellen Studienlage kann die Empfehlung gegeben werden, fokale Epilepsien primär für die anterior-thalamische Stimulation zu prüfen, während bei generalisierten Epilepsien sowie beim Lennox-Gastaut-Syndrom der zentromediane Thalamus als primärer Zielpunkt im Sinne eines individuellen Therapieversuchs infrage kommt. Ob im weiteren Verlauf z.B. parietal- und posterior-fokale Epilepsien durch eine Pulvinarstimulation besser beeinflusst werden können oder ob der Nucleus accumbens für die temporalen Epilepsien bessere Resultate bringt, wird sich zeigen müssen. Erstrebenswert wäre in der Zukunft jedenfalls eine individuelle Zielpunktplanung anhand der iktalen und interiktalen Befunde des jeweiligen Patienten zur Optimierung des Behandlungsansprechens.
Aktuelle Forschungsrichtungen
Neben den beschriebenen prospektiven Studien zur Erforschung neuer Stimulationspunkte gehen laufende Forschungsabsichten auch in die Richtung, die Implantationsgenauigkeit im anterioren Thalamus zu verbessern. Hier wurden insbesondere durch eine finnische Gruppe Daten publiziert, welche die Mikroelektrodensignale sowie die lokalen Feldpotenziale verwenden, um die effektivste Lage der implantierten DBS-Elektrode zu identifizieren.27,28 Weitere Studien untersuchen den Einfluss der DBS auf die Schlafqualität, deren psychiatrische Nebeneffekte sowie subkortikale und kortikale Biomarker zur Vorhersage und zur Optimierung des Ansprechens der tiefen Hirnstimulation.29–31 Im weiteren Verlauf wäre es analog zur responsiven Stimulation (RNS) denkbar, die tiefe Hirnstimulation auch in einem Sinne eines «closed loop» anzuwenden und sie nur bei Zuständen von erhöhter Anfallswahrscheinlichkeit einzuschalten. Eine solche «intelligente» On-demand-Stimulation hat sich z.B. bei der tiefen Hirnstimulation bei Patienten mit Parkinsonerkrankung in experimentellen Studien als sehr effektiv erwiesen. Hier wäre ein Zusammenspiel der aktuellen Forschung hinsichtlich der Anfallsvorhersage («seizure forecasting») in Zukunft sehr hilfreich.
Zusammenfassung
Mit der tiefen Hirnstimulation steht für pharmakotherapierefraktäre Epilepsiepatientinnen und -patienten, die nicht für ein resektives epilepsiechirurgisches Vorgehen in Betracht kommen, seit 10 Jahren in Europa ein neues und interessantes Therapieverfahren zur Verfügung. Die Zulassungsstudien und die klinischen Erfahrungen in hochspezialisierten Zentren zeigten, dass das Verfahren sicher angewendet werden kann und bei guter Indikationsstellung zu einer signifikanten Anfallsreduktion führen kann. Anfallsfreiheit tritt nur in Einzelfällen auf und darf nicht erwartet werden; insgesamt berichten die meisten Patientinnen und Patienten aber eine signifikante Reduktion der Anfallsschwere sowie auch der Anfallshäufigkeit. Grössere kontrollierte Daten liegen nur für die fokale Epilepsie vor und bei dieser Patientengruppe ist der anteriore thalamische Nucleus das aktuell am besten untersuchte Zielgebiet und sollte als Erster evaluiert werden. Die Datenlage für generalisierte Epilepsien oder syndromale Epilepsien wie das Lennox-Gastaut-Syndrom ist im Vergleich zwar deutlich dünner, es zeigen sich aber ebenfalls robuste Effekte, sodass in Einzelfällen auch bei generalisierten Epilepsien und beim Lennox-Gastaut-Syndrom entsprechende individuelle Therapieversuche durch eine Stimulation im zentromedianen Thalamus unternommen werden können. Sowohl die Wirksamkeit als auch die Nebenwirkungsrate hängt von der Anzahl Implantationen am jeweiligen Zentrum ab. Verbesserung der Wirksamkeit der tiefen Hirnstimulation ist im weiteren Verlauf möglich, einerseits durch Untersuchung von möglichen weiteren subkortikalen Zielgebieten und andererseits durch Optimierung der operativen Genauigkeit und Stimulationsoptimierung durch entsprechende epileptische Biomarker. Als Fernziel ist auch für die DBS eine responsive («closed loop») Stimulation basierend auf elektrophysiologischen Biomarkern der Epileptizität anzustreben. Abschliessend kann angefügt werden, dass die tiefe Hirnstimulation kein heilender Ansatz für die Epilepsie ist, aber bei refraktären Fällen zu einer signifikanten Anfallsreduktion und damit einer signifikanten Verbesserung der Lebensqualität bei Epilepsie führen kann.
Literatur:
1 Fiest KM et al.: Neurology 2017; 88: 296-303 2 Elger C, Berkenfeld R. S1-Leitlinie Erster epileptischer Anfall und Epilepsien im Erwachsenenalter. Dtsch Ges Für Neurol (Hrsg.): Leitlinien Für Diagn Ther Neurol. Online: www.dgn.org/leitlinien 3 Kwan P, Brodie MJ: N Engl J Med 2000; 342: 314-9 4 Ryvlin P, Rheims S: Curr Opin Neurol 2016; 29: 182-8 5 Van Buren JM et al.: J Neurosurg 1978; 48: 40716 6 Velasco F et al.: Neurochirurgie 2008; 54: 418-27 7 Velasco F et al.: Acta Neurochir Suppl [Internet] 2007 [zitiert 3. November 2022]; 97(Pt 2). Verfügbar unter: https://pubmed.ncbi.nlm.nih.gov/17691321 8 Boëx C et al.: Seizure 2011; 20: 485-90 9 Bondallaz P et al.: Seizure 2013; 22: 390-5 10 Yan H et al.: Acta Neurol Scand 2022 11 Sprengers M et al.: Cochrane Database Syst Rev 2017; 7: CD008497 12 Fisher R et al.: Epilepsia 2010; 51: 899-908 13 Salanova V et al.: Neurology 2015; 84: 1017-25 14 Salanova V et al.: Epilepsia 2021; 62: 1306-17 15 Imbach LL et al.: Seizure 2019; 71: 286-8 16 Valentín A et al.: Epilepsia 2013; 54: 1823-33 17 Dalic LJ et al.: Ann Neurol 2022; 91: 253-67 18 Kaufmann E et al.: J Neurosurg 2020; 1-10 19 Kaufmann E et al.: Seizure 2020; 81: 201-9 20 Kim SH et al.: Seizure 2017; 52: 154-61 21 Tröster AI et al.: Seizure 2017; 45: 133-41 22 Voges BR et al.: Epilepsia 2015; 56: e99–103 23 Bünzli J In: Abstracts of the 113th Annual Meeting of the Swiss Neurological Society, Congress Centre Kursaal Interlaken, Switzerland, November 18–19, 2021. Clin Transl Neurosci. Dezember 2021; 5: 22 24 Cukiert A et al.: Seizure 2020; 81: 304-9 25 Kowski AB et al.: Epilepsia 2015; 5: e78-82 26 Filipescu C et al.: Epilepsia 2019; 60: e25-30 27 Möttönen T et al.: Stereotact Funct Neurosurg 2016; 94: 86-92 28 Möttönen T et al.: NeuroImage Clin 2015; 7: 823-9 29 Järvenpää S et al.: Epilepsia Open 2020; 5: 406-17 30 Järvenpää S et al.: Epilepsy Behav 2018; 88: 373-9 31 Lehtimäki K et al.: Brain Stimulat 2016; 9: 268-75