Neue Entwicklungen in der neurologischen Biomarkerforschung
Autor:
Assoz. Prof. PD Dr. Michael Khalil, PhD
Klinische Abteilung für allgemeine Neurologie
Medizinische Universität Graz
E-Mail: michael.khalil@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der neurologischen Biomarkerforschung hat es in den letzten Jahren maßgebliche Fortschritte gegeben, die vor allem durch verbesserte Analysetechniken bedingt sind. Nach wie vor spielt die Analyse von Biomarkern im Liquor cerebrospinalis („cerebrospinal fluid“ – CSF) bei neurologischen Erkrankungen eine zentrale Rolle. Biomarker aus der Blutbahn könnten in naher Zukunft jedoch an Bedeutung gewinnen.
Für die klinische Anwendbarkeit von Biomarkern im CSF stellt die relativ invasive Prozedur zur Gewinnung des Liquors, nämlich mittels Durchführung einer Lumbalpunktion, eine wesentliche Limitation vor allem im Hinblick auf Verlaufsuntersuchungen dar. Aus diesem Grund gab es in den letzten Jahren verstärkte Bemühungen, neuronale Proteine als Biomarker auch im peripheren Blut zu messen. Dies gelang zuerst für die Neurofilamente, allen voran für die Neurofilament-Leichtkette (NfL), weshalb dieser Vortrag im Rahmen der Jahrestagung der Österreichischen Gesellschaft für Neurologie 2020 den Fokus auf diesen Biomarker legte.
Neurofilamente (Nf) sind zytoskelettale Proteine, die in allen Neuronen vorkommen. Bei einer Nervenzellschädigung werden unabhängig von deren Ursache diese intrazellulären Proteine in den extrazellulären Raum freigegeben.1,2 In weiterer Folge finden sich diese Neurofilamente, deren Konzentration vom Ausmaß der Nervenzellschädigung abhängt, im CSF und in geringen Mengen auch im peripheren Blut (Abb.1).
Erste Arbeiten zur NfL im Liquor wurden bereits Ende der 1990er-Jahre publiziert, in denen gezeigt werden konnte, dass bei Multipler Sklerose (MS) höhere Werte zu finden waren, wenn der Zeitabstand zwischen Lumbalpunktion und vorausgehendem Schubgeschehen kürzer war.3 Somit ergab sich ein biochemischer Hinweis auf eine rezente neuroaxonale Schädigung, die durch Krankheitsaktivität bei MS verursacht war.
In den darauffolgenden Jahren folgten weitere Untersuchungen zu NfL im CSF, unter anderem konnte gezeigt werden, dass NfL sogar in der frühesten Krankheitsphase der MS, nämlich bei klinisch isolierten Syndromen (CIS), im Vergleich zu einer Kontrollgruppe signifikant erhöht ist.4
Die Analyse von Nf im CSF erfolgte mittels Enzyme-linked Immunosorbent Assay (ELISA), für die weitaus geringeren Konzentrationen von NfL im peripheren Blut ist diese Analysemethode nicht ausreichend sensitiv.
Erst in den letzten Jahren gelang es durch technische Weiterentwicklungen, vor allem mit der Einführung der ultra-hochsensitiven Einzelmolekülanalyse (Single Molecule Array – Simoa),5 NfL im peripheren Blut valide zu quantifizieren. Dies führte dazu, dass dieser Marker in den letzten Jahren bei unterschiedlichen akuten und chronischen neurologischen Erkrankungen intensiv beforscht wurde. Durch die im Vergleich zu einer Lumbalpunktion relativ einfache Gewinnung von Blutproben konnte dieser Marker nicht nur bei neurologischen Erkrankungen untersucht werden, bei denen per se zu diagnostischen Tests eine Lumbalpunktion durchgeführt wird, zudem wurden dadurch Verlaufsuntersuchungen mit Messwiederholungen deutlich vereinfacht.
Voraussetzung für die Verwendung von blutbasierten Testverfahren zur Messung von NfL ist, dass die NfL-Werte im CSF und Blut eng miteinander korrelieren, was vielen Studien bereits belegen konnten.
Bei MS konnte gezeigt werden, dass sNfL mit Krankheitsaktivität, MRI-Parametern und Ansprechen auf effektive Immuntherapien korreliert. Darüber hinaus gibt es bereits viele Daten zu NfL bei neurogenerativen Erkrankungen wie Demenz, Schlaganfall, traumatischer Hirnschädigung, amyotropher Lateralsklerose und der Parkinsonerkrankung (Khalil et al. 2018). Die Konzentrationen von sNfL scheinen erst ein paar Tage nach einem Akutereignis im Blut anzusteigen. Dies konnte unter anderem in einer rezenten Studie zu kleinen subkortikalen Infarkten nachgewiesen werden. Höhere sNfL-Werte fanden sich demnach mit größerem zeitlichem Abstand zum Akutereignis (Median 4 Tage, Range 1–11 Tage).6
Interessante Ergebnisse gibt es auch bei der Alzheimererkrankung. In einer rezenten longitudinalen Studie wurde nachgewiesen, dass eine signifikante Zunahme von NfL dem klinischen Symptombeginn bis zu 16 Jahre vorausging.7
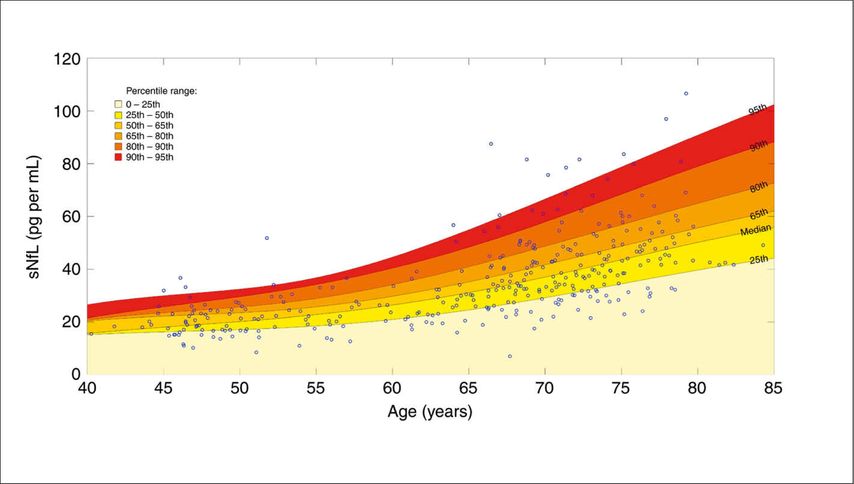
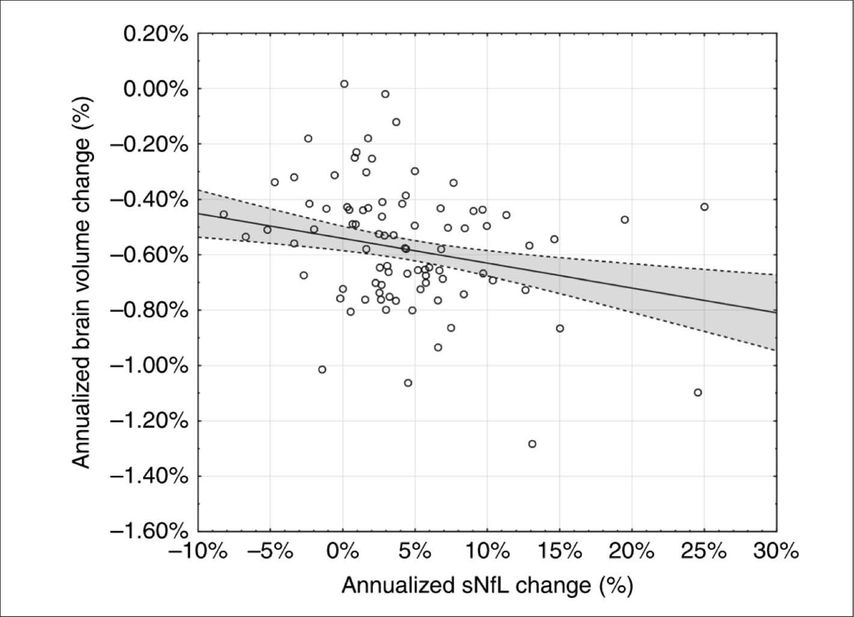
Obwohl sNfL bei unterschiedlichen neurologischen Erkrankungen derzeit als einer der vielversprechendsten Marker gilt, gab es bisher nur wenige Informationen dazu, wie sich NfL bei neurologisch unauffälligen Personen, vor allem mit zunehmendem Alter, verhält. Ein genaues Wissen darüber ist aber unabdingbar, um sNfL im klinischen Kontext korrekt zu interpretieren und pathologische von normalen Werten zu unterscheiden. Diese Lücke wurde mit einer rezenten Studie geschlossen. In dieser Studie wurden sNfL-Werte bei Personen, die an der österreichischen Schlaganfallvorsorgestudie teilgenommen hatten, analysiert. Insgesamt wurden 335 Personen untersucht, von denen bei 103 Personen eine Follow-up-Untersuchung nach im Mittel 5 Jahren vorgenommen worden war.8 Es zeigte sich, dass sNfL mit zunehmendem Alter in einer gesunden Population ansteigt und eine größere Variabilität aufweist. Der altersabhängige Anstieg und die Variabilität dieses Markers nahmen ab einem Alter von über 60 Jahren signifikant zu (Abb.2). Ein weiteres wichtiges Ergebnis dieser Studie ist, dass dieser Marker sensitiv genug ist, um selbst bei neurologisch unauffälligen Personen subklinische morphologische Hirnveränderungen, nämlich eine Hirnvolumenabnahme über die Zeit, vorhersagen zu können (Abb.3).
Abb. 3: Korrelation von Hirnatrophie und jährliche Änderung von sNfL in einer normal alternden Kohorte (rs = –0,290, p<0,01)8
Mittlerweile wurden für weitere ZNS-spezifische Marker, die bisher ausschließlich im Liquor messbar waren, blutbasierte Testsysteme entwickelt. Dazu gehört der astrogliale Marker „glial fibrillary acidic protein“ (GFAP), der vor allem bei der Neuromyelitis-optica-Spektrum-Erkrankung (NMOSD) diagnostische Bedeutung erlangen könnte.9 Ein weiterer Marker ist phosphoryliertes Tau 181 (pTau181), das für die Diskriminierung der Alzheimererkrankung von anderen Demenzformen Bedeutung hat.10 Erste Ergebnisse dazu sind sehr vielversprechend und wurden in hochrangigen Journalen publiziert.
Zusammenfassend kann gesagt werden, dass die Biomarkerforschung in der Neurologie vor allem durch technische Weiterentwicklung und mit der Verfügbarkeit von blutbasierten Analysemethoden starken Aufwind erhält. Vor allem sNfL könnte in naher Zukunft bei unterschiedlichen neurologischen Erkrankungen für die klinische Routine relevant werden. Allerdings sind bis dahin noch weitere Forschungsbemühungen notwendig. Dazu gehören unter anderem die Etablierung von altersabhängigen Cut-off-Werten und die Erfassung von weiteren Einflussfaktoren bei diesem Marker, wie zum Beispiel Erkrankungen des peripheren Nervensystems etc. In den nächsten Jahren ist jedenfalls mit weiteren spannenden Forschungsergebnissen zu rechnen.
Literatur:
1 Khalil M et al.: Neurofilaments as biomarkers in neurological disorders. Nat Rev Neurol 2018; 14(10): 577-89 2 Teunissen CE, Khalil M: Neurofilaments as biomarkers in multiple sclerosis. Mult Scler 2012; 18(5): 552-6 3 Lycke JN et al.: Neurofilament protein in cerebrospinal fluid: a potential marker of activity in multiple sclerosis. J Neurol Neurosurg Psychiatry 1998; 64(3): 402-4 4 Khalil M et al.: CSF neurofilament and N-acetylaspartate related brain changes in clinically isolated syndrome. Mult Scler 2013; 19(4): 436-42 5 Rissin DM et al.: Single-molecule enzyme-linked immunosorbent assay detects serum proteins at subfemtomolar concentrations. Nat Biotechnol 2010; 28(6): 595-9 6 Gattringer T et al.: Serum neurofilament light is sensitive to active cerebral small vessel disease. Neurology 2017; 89(20): 2108-14 7 Preische O et al.: Serum neurofilament dynamics predicts neurodegeneration and clinical progression in presymptomatic Alzheimer’s disease. Nat Med 2019; 25(2): 277-83 8 Khalil M et al.: Serum neurofilament light levels in normal aging and their association with morphologic brain changes. Nat Commun 2020; 11(1): 812 9 Watanabe M et al.: Serum GFAP and neurofilament light as biomarkers of disease activity and disability in NMOSD. Neurology 2019; 93(13): E1299-311 10 Thijssen EH et al.: Diagnostic value of plasma phosphorylated tau181 in Alzheimer’s disease and frontotemporal lobar degeneration. Nat Med 2020; 26(3): 387-97
Das könnte Sie auch interessieren:
Menschen mit Demenz: Was beeinflusst deren Überleben nach Diagnosestellung?
Verschiedenste Faktoren beeinflussen die Überlebenszeit nach einer Demenzdiagnose. Das Wissen um Risikofaktoren zum Zeitpunkt der Diagnose einer Demenzerkrankung oder in deren Verlauf ...
Alzheimer: Was gibt es Neues in der Biomarker-Entwicklung?
Schätzungen zufolge leben in Österreich 115000 bis 130000 Menschen mit einer Form der Demenz. Eine Zahl, die sich bis zum Jahr 2050 verdoppeln wird.1 Antikörper-Wirkstoffe könnten in der ...
Kappa-FLC zur Prognoseabschätzung
Der Kappa-freie-Leichtketten-Index korreliert nicht nur mit der kurzfristigen Krankheitsaktivität bei Multipler Sklerose, sodass er auch als Marker zur Langzeitprognose der ...