Was können strukturelle Verfahren zur Demenzdiagnostik beitragen?
Autor:
Prim. Univ.-Prof. Dr. Christian Nasel, MSc, PhD
Klinisches Institut für Radiologische Diagnostik und Intervention
Universitätsklinikum Tulln
Universitätsklinik für Radiologie und Nuklearmedizin
Medizinische Universität Wien
E-Mail: christian.nasel@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei der Bildgebung ist neben der adäquaten Bildakquisition vor allem die insgesamt sehr komplexe Beurteilung von Bedeutung. Dabei geht die neuroradiologische Expertise mittlerweile Hand in Hand mit computergestützter Bilddatenverarbeitung. Aber wie genau gelingen Differenzierung oder sogar Prognose?
Keypoints
-
Die Bildgebung sollte, insbesondere bei der häufig auftretenden Alzheimerdemenz (AD), jedenfalls mittels einer hochauflösenden MRT-Untersuchung durchgeführt werden.
-
Die alleinige visuelle neuroradiologische Beurteilung solcher Bilddatensätze dient der Abgrenzung verschiedener Ursachen einer Demenz, hat aber hinsichtlich der Beurteilung eher orientierenden Charakter.
-
Zur Beurteilung subtiler Veränderungen, insbesondere bei Verlaufsbeobachtung oder Prognoseabschätzung, sollte eine computergestützte Bilddatenverarbeitung zum Einsatz kommen. Deren Interpretation setzt ebenfalls ein bestimmtes Maß an neuroradiologischer Expertise voraus.
-
So kann bei der AD mittlerweile aufgrund histopathologischer Verteilungsmuster von Ablagerungsprodukten auf AD-Subtypen geschlossen werden. Zudem existieren vielversprechende Prognosemodelle, welche den Übergang eines MCI zum Vollbild einer AD vorhersagen können.
Eine demenzielle Erkrankung bedeutet für betroffene Personen eine fortschreitende Verschlechterung ihrer kognitiven Funktion. Neben der großen Gruppe der durch Gefäßerkrankungen hervorgerufenen Demenzen, den sog. vaskulären Demenzen, sind hauptsächlich neurodegenerative Erkrankungen für das Auftreten einer Demenz verantwortlich. Eine der häufigsten Demenzerkrankungen stellt die Alzheimerdemenz (AD), benannt nach ihrem Erstbeschreiber Dr. Alois Alzheimer, dar. Wie bei den meisten neurodegenerativen Erkrankungen sind auch bei der AD therapeutische Interventionen nur in sehr eingeschränktem Ausmaß möglich, eine Heilung kann derzeit nicht erreicht werden. Eine möglichst frühe verlässliche Diagnose und Therapie einer AD ist daher wichtig, um einen maximalen Effekt hinsichtlich der Krankheitsausprägung und der Verlaufsdynamik zu erzielen.
MRT in der Erstabklärung
Die neuroradiologische Bildgebung, insbesondere der Einsatz der Magnetresonanztomografie (MRT), spielt hier eine wesentliche Rolle, da sowohl vaskuläre als auch neurodegenerativ bedingte Demenzen teilweise typische morphologische Veränderungen am Gehirn hervorrufen. Die MRT hilft besonders, vaskuläre von neurodegenerativ bedingten Demenzen zu unterscheiden (Abb.1). Die Durchführung einer Computertomografie des Gehirns ist in diesem Kontext wenig sinnvoll.
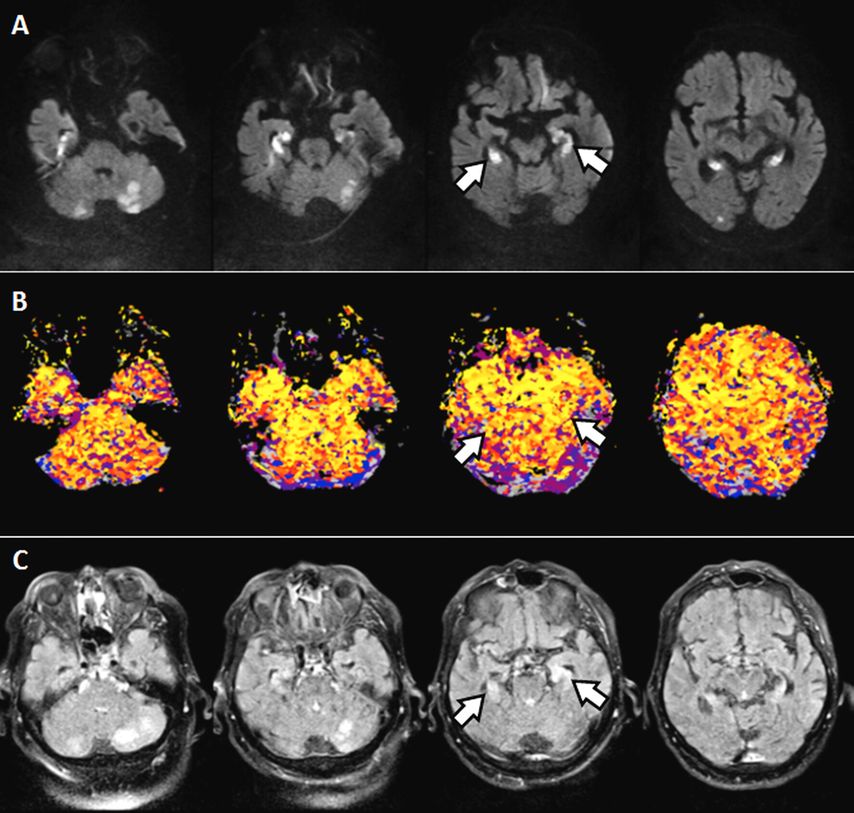
Abb. 1: Mithilfe der MRT können andere Ursachen eines mnestischen Defizits sicher von einer neurodegenerativen Erkrankung differenziert werden. Bei diesem Patienten waren Infarkte der Hippocampus-Formation bds. (weiße Pfeile) für die plötzliche rapide Verschlechterung der mnestischen Leistung verantwortlich. Die diffusionsgewichtete MRT zeigte eine typische Diffusionsrestriktion im Rahmen eines zytotoxischen Ödems im Hippocampus bds. sowie zerebellär und okzipital bds. (Abb. 1A: weiße Areale). Die Infarkte waren zu diesem Zeitpunkt vollständig rekanalisiert und ohne kritische Perfusion (Abb. 1B, gelb-orange-rote Farben zeigen regelrechte Perfusion an). Da das Ereignis schon mehrere Tage zurücklag, konnten die Infarkte auch bereits in der T2-Gewichtung nachgewiesen werden (Abb. 1C: weiße Areale)
Viele neurodegenerative Erkrankungen, so auch die AD, führen zu atrophen Veränderungen am Gehirn mit regional unterschiedlicher Ausprägung. Die hochauflösende MRT-Bildgebung (Voxelgröße zumeist ≤1×1×1mm), durchgeführt auf MR-Tomografen mit mindestens 1.5T, besser 3.0T, Feldstärke, stellt diese verlässlich dar und erlaubt auch eine Quantifizierung der Veränderungen. Einige neurodegenerative Erkrankungen führen auch zur verstärkten Einlagerung von krankheitsbedingten Zellabbauprodukten in bestimmten zerebralen Regionen, welche beispielsweise mittels der suszeptibilitätsgewichteten Bildgebung dargestellt werden können.1 Bei der Diagnostik der AD steht jedoch die Detektion regionaler Atrophiemuster im Vordergrund.
Die MR-Angiografie erlaubt eine exzellente Beurteilung der gehirnversorgenden Makrogefäße und mittels der MRT-Gehirnperfusionsmessung kann auch die Funktion der kapillären Gefäßstrukturen überprüft werden.2 Dies unterstützt die Abgrenzung von vaskulären gegenüber primär neurodegenerativ bedingten Demenzen wie der AD.
Die Diffusionstensorbildgebung in der MRT erlaubt Rückschlüsse auf bereits schwere Störungen im zerebralen Fasergeflecht, was auch bei der AD eingesetzt werden kann. Durch verschiedene Auswertungsverfahren können auch weitere Krankheitsbilder, wie der Normaldruckhydrocephalus, beurteilt werden, welcher ebenfalls zu einem demenziellen Abbau führen kann.3
Morphologische Veränderungen objektivieren
Bei der AD stehen die Diagnose und die Verlaufskontrolle regional atropher zerebraler Veränderungen, insbesondere in den temporomesialen und parietalen Gehirnregionen, im Vordergrund.4 Dabei wurde die mangelhafte Objektivität der rein visuellen Beurteilung der oft mehrere hundert Bilder umfassenden MRT-Untersuchungen bereits früh erkannt. So kann es besonders in den Frühstadien der AD schwierig sein, auch typische regionale Atrophiemuster zu erkennen und diese von altersphysiologischen Vorgängen abzugrenzen. Es wurden daher verschiedene Graduierungssysteme mit genauer Beurteilungsanweisung zur Objektivierung von Befunden vorgeschlagen. Dazu gehört insbesondere die Beurteilung der progredienten Volumsreduktion in der temporomesialen Region, vor allem der Hippocampus-Formation. In kontrollierten Studien konnte damit eine akzeptable Objektivierung erreicht werden.5 In der Routine erwiesen sich diese Scores jedoch als wenig praktikabel, da so erstellte Befunde oft wegen der fehlenden Abstimmung zwischen den einzelnen Befundern wenig vergleichbar waren. Die so induzierte Variabilität der Befundgraduierung reduzierte die diagnostische Sicherheit, besonders in den frühen Stadien der Erkrankung. Weiters blieb auch die Abgrenzung krankhaft neurodegenerativer Veränderungen von altersphysiologischen Vorgängen schwierig.
Eine deutlich objektivere Beurteilung regional atropher Veränderungen bei der Frage nach einer AD stellt die Volumetrie der Hippocampus-Formation dar.6 Hier ergibt sich in der Praxis allerdings das Problem, dass die manuelle Segmentierung und Volumetrie des Hippocampus einen erheblichen Arbeitsaufwand darstellt. Der Arbeitsaufwand der manuellen Volumetrie steigert sich noch, wenn ein Vergleich einzelner Personen mit Referenzgruppen mit vielen Messungen notwendig wird, z.B. um Frühveränderungen der AD erfassen zu können (Abb. 2). Dieses Verfahren findet bei der wichtigen Erstbegutachtung in der radiologischen Praxis daher weiterhin wenig Anwendung, obwohl mittlerweile Software zur automatisierten Segmentierung und Volumetrie zur Verfügung steht.
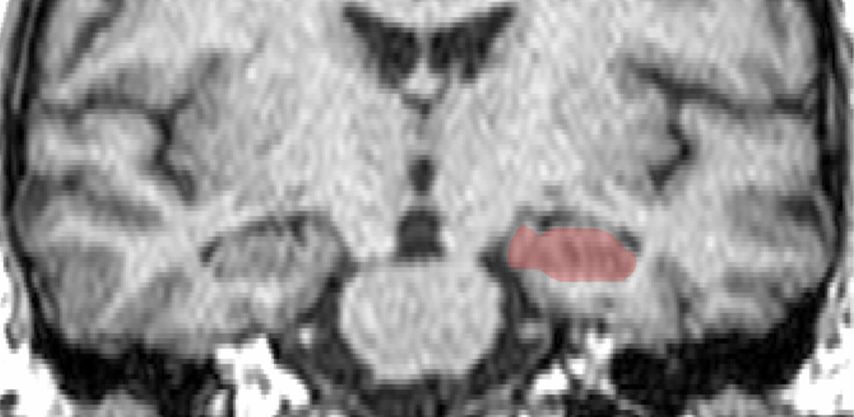
Abb. 2: Bei der Volumetrie der Hippocampus-Formation wird diese Struktur zumeist manuell segmentiert, indem eine „region of interest“ (ROI, rotes Areal links) eingezeichnet wird. Dies erfolgt auf allen Schnitten, welche diese Struktur abbilden. Da die Größe eines einzelnen Voxels bekannt ist, kann letztlich das Volumen durch Summation aller Voxel innerhalb zusammengehöriger ROI ermittelt werden. Dieses Verfahren ist, richtig ausgeführt, sehr genau, aber auch eher aufwendig. In kontrollierten Studien konnten damit jedoch wichtige Erkenntnisse über die AD gewonnen werden
Mithilfe der direkten Volumetrie konnten generell negativ alterskorrelierte Veränderungen des Volumens der Hippocampus-Formation gezeigt werden. Besonders die medialen und lateralen Partien des Hippocampus-Schwanz- und -Körperabschnitts, die der Hippocampus-Subregion CA1 (abgeleitet von lat. Cornu ammonis) zugerechnet werden, scheinen einem altersbedingten Abbau zu unterliegen. Bei AD-Patienten fanden sich in diesen Regionen jedoch im Vergleich zu gesunden Alterskontrollen um bis zu 35% stärkere Volumsabnahmen. Zusätzlich war bei AD-Patienten auch eine bedeutende Volumenreduktion in den dorsalen Hippocampus-Kopfabschnitten, in der Region CA1, zu finden, die bei gesunden Referenzpersonen nicht betroffen sind.7 Mithilfe einer subtilen Aufarbeitung von hochauflösenden MRT-Untersuchungen können so bereits auch frühe Veränderungen bei AD erfasst werden. Der erhebliche Aufwand dieser Auswertungen ist jedoch zumeist durch keinen Versicherungsträger gedeckt. Die direkte Volumetrie erfordert zudem profunde neuroradiologische Kenntnisse der analysierten MRT-Sequenzen und setzt auch ein vertieftes neuroanatomisches Wissen voraus.
Voxelbasierte automatisierte Verfahren
In Erweiterung des rein volumetrischen Ansatzes wurde eine automatisierte Analyse von gesamten Gehirndatensätzen, Voxel für Voxel, vorgeschlagen. Dabei werden in seiner einfachsten Form, im sogenannten Normalisierungsschritt, die hochauflösenden MRT-Bilddaten verschiedener Patienten mathematisch nicht linear in einen standardisierten, sog. stereotaktischen, Raum transformiert. Dadurch werden individuelle Gehirndatensätze verschiedener Personen geometrisch direkt vergleichbar. Anschließend werden die normalisierten Bilddaten in weiße und graue Substanz segmentiert und Voxel für Voxel statistisch ausgewertet.8 Da durch den Normalisierungsschritt die regionalen Volumina verändert werden, ist keine direkte Volumetrie mehr möglich, weswegen das Verfahren als voxelbasierte Morphometrie (VBM) bezeichnet wurde (Abb. 3).
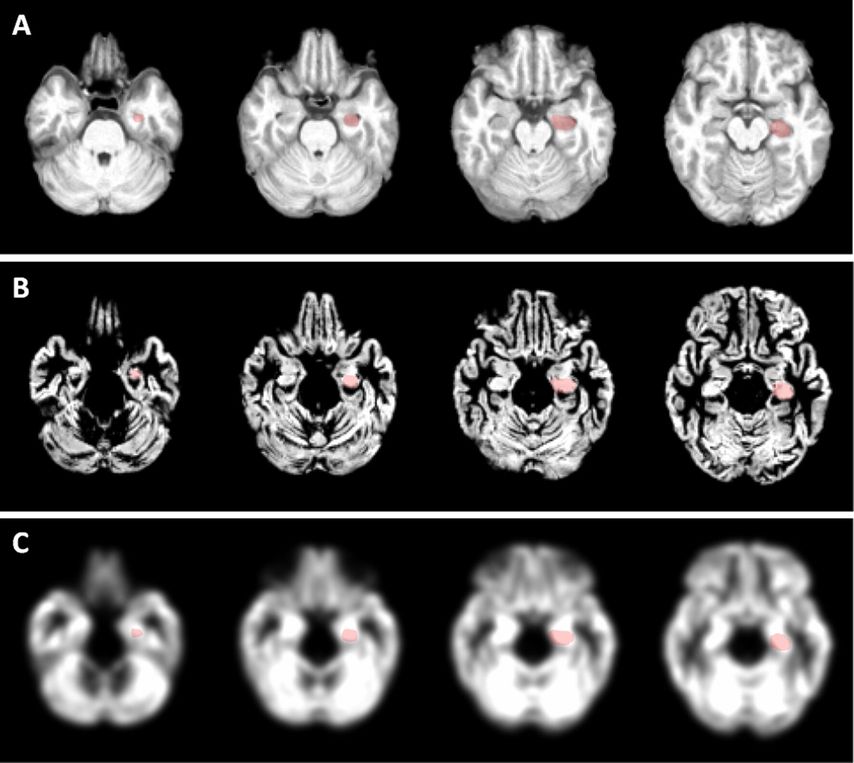
Abb. 3: Die VBM transformiert hochauflösende kontrastreiche MRT-Bilder in normalisierte Bilder (Abb. 3A). Bei diesem Schritt werden Gehirne mathematisch deformiert und aufeinander abbildbar in denselben Raum transformiert, sodass verschiedene Gehirne verglichen werden können. Bei neurodegenerativen Erkrankungen wird zumeist die graue Substanz analysiert, weswegen die normalisierten Bilder automatisch segmentiert werden (Abb. 3B: segmentierte graue Substanz). Um individuell bedingte Varianzen ohne Relevanz für die Auswertung auszugleichen, werden die segmentierten Bilder geglättet (Abb. 3C) und danach Voxel für Voxel verglichen. Areale von Interesse können leicht über Gehirnatlanten im normalisierten Raum aufgefunden und ausgewertet werden (Hippocampus links: rotes Areal)
Bei der statistischen Auswertung der segmentierten normalisierten Bilder der grauen Substanz wird so auch letztlich der Gehalt an grauer Substanz pro Voxel im gesamten Gehirn analysiert. Im Rahmen regional atrophischer Veränderungen nimmt die „Konzentration“ der grauen Substanz in den betroffenen Voxeln ab, was für eine vollautomatische Voxel-für-Voxel-Analyse selbst subtiler atrophischer Veränderungen mittels VBM genutzt werden kann. Zudem können vorgefertigte Gehirnatlanten zur automatischen Regionserkennung und -auswertung im stereotaktischen Raum eingesetzt werden.
Anders als die manuelle Volumetrie, die individuell gesetzte „regions of interest“ verwendet und daher immer nur auf eine Erkrankungsform fokussiert bleibt, analysiert die VBM immer das gesamte Gehirn und ermöglicht so eine automatische Differenzierung zwischen AD und anderen Demenzformen.4 Die VBM wurde vielfach verändert und verbessert, wobei mittlerweile neben der „Konzentration“ an grauer Substanz auch andere morphometrische Parameter wie etwa das Ausmaß der zur Normalisierung notwendigen Volumsmodulation etc. für Auswertungen herangezogen werden können. So konnten auch vergleichsweise subtile Unterschiede bei regional atrophen Veränderungen zwischen Patienten mit AD und Kontrollpersonen mit regulären altersbedingten Alterationen automatisch detektiert und quantifiziert werden.9
Ein Nachteil der VBM ergibt sich jedoch aus der starken Abhängigkeit der Ergebnisse vom jeweiligen angewandten Rechenverfahren. Dies gilt insbesondere für die Interpolationsschritte im Rahmen der Normalisierung. Bei der Interpretation von Ergebnissen von mittlerweile verfügbaren Software-Paketen zur vollautomatischen Auswertung von Gehirndatensätzen, die detektierte Veränderungen plakativ farbig darstellen, ist daher zunächst Vorsicht geboten. Der Umgang mit den morphometrischen Verfahren setzt immer ein bestimmtes Maß an neuroradiologischer Expertise voraus. Unbedingt anzuraten ist zudem vorab ein direktes Gespräch zwischen Zuweiser und Neuroradiologie zur Abstimmung des diagnostischen Vorgehens.
Die Möglichkeit, große Patienten- und Kontrollgruppen mittels VBM automatisch, auch wiederkehrend, zu analysieren, erlaubt eine Differenzierung verschiedener pathologischer Subtypen der AD. Zumeist zeigt die temporomesiale Region bei der AD die deutlichsten pathologischen Veränderungen, sowohl in Hinsicht auf die regionalen Atrophien als auch auf die Einlagerung krankheitsassoziierter Zerfallsprodukte wie des Tau-Proteins. Letzteres ist wesentlich an der Bildung der bei AD auftretenden „neurofibrillary tangles“ (NFT) im Gehirn beteiligt und war bisher nur post mortem in pathologischen Untersuchungen darstellbar. Da jedoch die Stärke der regionalen Atrophie mit der Menge an eingelagerten NFT korreliert, konnte in einer Studie mit 177 Personen mittels VBM ante mortem ein Rückschluss auf die Verteilung der NFT gezogen werden. Die VBM war dabei in der Lage, atypische AD-Verlaufsformen, welche ein besonderes Einlagerungsmuster der NFT zeigen, von der typischen AD-Form zu differenzieren.10
Solche Differenzierungen unterstützen einerseits die weitere Erforschung der AD, indem homogene Studiengruppen gebildet werden können, andererseits sind so auch individuell prognostische Faktoren ableitbar. Insbesondere die Abschätzung der Zeitspanne vom Auftreten erster Symptome einer AD bis zum Stadium der völligen Abhängigkeit bei allen Alltagsverrichtungen ist hier für die Planung pflegerischer Maßnahmen von gesundheitspolitischem Interesse. Obwohl die VBM zwar relativ genau das Ausmaß bereits bestehender Veränderungen erfassen kann, sind prognostische Aussagen, allein von der neuroradiologischen Bildgebung her, trotz allem weiterhin schwierig.
Datenaufarbeitung und Radiomics
Die im Rahmen der VBM notwendigen Interpolations- und Glättungsschritte können das Ergebnis von Analysen erheblich beeinflussen, sodass eine direkte Beurteilung regionaler Gehirnveränderungen wünschenswert ist. Um eine möglichst authentische Beurteilung der zerebralen morphologischen Veränderungen zu erreichen, ist es günstig, deformierende mathematische Transformationen des dreidimensionalen Gehirndatensatzes bei einem Minimum zu halten. Rechenleistung kann so bei der komplexen Datenaufarbeitung in die direkte Beurteilung regionaler morphologischer Veränderungen mittels einer Vielzahl von sogenannten Klassifikatoren investiert werden. Auswertungen erfolgen wiederum Voxel für Voxel, wodurch ein multidimensionaler Datensatz entsteht, der jedem Voxel mehrere sogenannte Features, die durch die Klassifikatoren beurteilt werden, zuordnet. Bei der Auswertung solcher multidimensionaler Datenstrukturen kann, abgesehen von einem Normalisierungsschritt zur automatischen Regionszuordnung, auf jede Art der mathematischen Veränderung der räumlichen Datenstruktur verzichtet werden. Diese multidimensionalen Datenstrukturen können zusätzlich um klinische, beispielsweise neuropsychologische, Testparameter erweitert werden, die den klinischen Zustand einer Person noch besser abbilden helfen.
Diese sehr großen und komplexen Datenmengen sind von einem einzelnen Untersucher nicht mehr einfach interpretierbar, weswegen zunehmend Implementierungen neuraler Netze und paralleles Rechnen am Computer zum Einsatz kommen, um typische Muster und Trends innerhalb dieser komplexen Datenstrukturen finden und nützen zu können. Ein Teil dieser Methoden kann mit dem Überbegriff der künstlichen Intelligenz beschrieben werden. Solche am Computer implementierten Verfahren können auf die Erkennung von zuvor durch die Klassifikatoren festgestellten Feature-Muster trainiert werden, um so, beispielsweise, eine automatische Differenzierung von krankhaften und altersphysiologischen Vorgängen und damit eine Prognosestellung zu erreichen (Abb. 4).
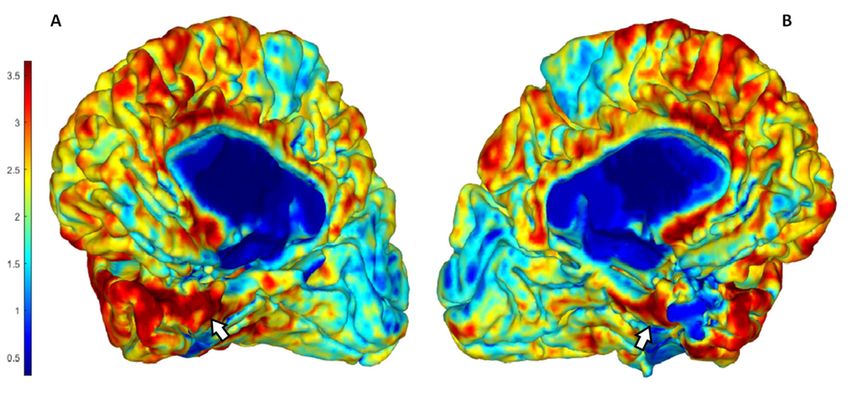
Abb. 4: Bei komplexen morphologischen Analysen werden regionale Features berechnet und klassifiziert. In diesem Beispiel wurde die Dicke der grauen Substanz bei einem Patienten berechnet und für die rechte (Abb. 4A) und linke (Abb. 4B) Großhirnhemisphäre dargestellt. In diesem Beispiel zeigt sich im Vergleich zur rechten Seite eine Reduktion dieses Features im Hippocampus (weiße Pfeile) links (reduzierter Anteil an Rotwerten). Durch Korrelation zahlreicher solcher automatisch aus den MRT-Bildern generierter Features kann die Relevanz derartiger Veränderungen bewertet und eine Diagnose gestellt werden [erstellt mittels SPM12-CAT12 toolbox]
Obwohl sehr aufwendig, sind solche Datenanalysen, dank immer höherer verfügbarer Rechenleistung, heute durchaus in der Lage, Trends innerhalb von hochkomplexen Datenstrukturen zu erkennen. So wurden bereits erste vielversprechende Prognosemodelle für die AD vorgestellt, die zeigten, dass der Zeitpunkt einer Konversion von einem milden kognitiven Defizit (engl.: MCD) zu einem AD-Vollbild mit bereits hoher Verlässlichkeit, zumindest im untersuchten Patientenkollektiv, vorhersagbar ist.11 Mit immer genaueren Modellen und Methoden der künstlichen Intelligenz könnte so künftig eine deutliche Verbesserung in der Versorgung und Betreuung von Patienten mit AD erreicht werden. Nicht zuletzt könnten solche Verfahren auch die Entwicklung neuer Medikamente gegen die AD unterstützen, da durch Therapien induzierte positive Trends schneller erkennbar wären.
Wie eine Analyse der Gewichtung einzelner Features innerhalb solcher Vorhersagemodelle ergab, kommt bei der Beurteilung der AD der Klassifikation der neuroradiologischen MRT-Bildgebung weiterhin die größte Bedeutung zu,11 weswegen der Beitrag neuroradiologischer struktureller Verfahren zur Demenzdiagnostik durchaus fundamentalen Charakter hat.
Resümee
Die neuroradiologische Bildgebung mittels MRT ist eine der wichtigsten Säulen bei der Diagnostik bei AD. Um die aus der MRT ableitbare Information vollständig nutzen zu können, sind jedoch meist sehr aufwendige Auswertungen notwendig, wie sie in der Praxis kaum angeboten und abgegolten werden können. Es empfiehlt sich daher, bereits im Vorfeld einer geplanten MRT-Untersuchung bei Verdacht auf eine Demenz mit dem Neuroradiologen Kontakt aufzunehmen, um die vorhandenen Ressourcen abzuklären und diese bestens im Sinne der Patienten nutzen zu können. Die alleinige visuelle Bildbetrachtung ist zumeist, insbesondere in der Frühphase einer neurodegenerativen Erkrankung, wenig zielführend. Die Abgrenzung anderer Demenzformen von neurodegenerativen Veränderungen ist jedoch mittels MRT gut möglich, die Computertomografie reicht hierfür zumeist nicht aus.
Erklärung:
Es bestehen keine Interessenkonflikte oder Zuwendungen Dritter. Alle Untersuchungen und Behandlungen werden am UK Tulln nach den gängigen medizinischen Standards durchgeführt. Als Universitätsspital ist das UK Tulln zur Einhaltung der WMA-Standards sowie der Richtlinie ICH Topic E 6 (European Medicines Agency) in der letztgültigen Fassung verpflichtet.
Literatur:
1 Chelban V et al.: An update on advances in magnetic resonance imaging of multiple system atrophy. J Neurol 2018; 266: 1036-45 2 Nasel C et al.: Normalised time-to-peak-distribution curves correlate with cerebral white matter hyperintensities - Could this improve early diagnosis? J Cereb Blood Flow Metab 2017; 37: 444-55 3 Nasel C et al.: Diffusion-weighted magnetic resonance imaging of cerebrospinal fluid in patients with and without communicating hydrocephalus. Acta Radiol 2007; 48: 768-73 4 Good CD et al.: Automatic differentiation of anatomical patterns in the human brain: validation with studies of degenerative dementias. Neuroimage 2002; 17: 29-46 5 Knoops AJG et al.: Visual rating of the hippocampus in non-demented elders: Does it measure hippocampal atrophy or other indices of brain atrophy? The SMART-MR study. Hippocampus 2009; 19: 1115-22 6 Persson K et al.: Comparison of automated volumetry of the hippocampus using NeuroQuant® and visual assessment of the medial temporal lobe in Alzheimer’s disease. Acta Radiol 2017; 59: 997-1001 7 Frisoni GB et al.: Mapping local hippocampal changes in Alzheimer’s disease and normal ageing with MRI at 3 Tesla. Brain 2008; 131: 3266-76 8 Ashburner J, Friston KJ: Voxel-based morphometry—the methods. Neuroimage 2000; 11: 805-21 9 Good CD et al.: A voxel-based morphometric study of ageing in 465 normal adult human brains. Neuroimage 2001; 14: 21-36 10 Whitwell JL et al.: Neuroimaging correlates of pathologically defined subtypes of Alzheimer’s disease: a case-control study. Lancet Neurol 2012; 11: 868-77 11 Tang L et al.: Individualized prediction of early Alzheimer’s disease based on magnetic resonance imaging radiomics, clinical, and laboratory examinations: a 60-month follow-up study. J Magn Reson Imaging 2021; 54: 1647-57
Das könnte Sie auch interessieren:
Optische Kohärenztomografie bei Multipler Sklerose – wie viel ist genetisch?
Mit der optischen Kohärenztomographie kann durch die Messung retinaler Schichtatrophie die neuroaxonale Schädigung bei Multipler Sklerose erfasst werden. Eine neue Studie gibt Einblick ...
APOE und Anti-Amyloid-Therapien: Genetik im klinischen Alltag
Mit der Zulassung der ersten krankheitsmodifizierenden Therapien hat ein Paradigmenwechsel in der Behandlung der Alzheimerkrankheit begonnen. Anti-Amyloid-Antikörper können den ...
Highlights der ÖPG-Jahrestagung 2025
Vom 22. bis 24. Oktober 2025 fand die Jahrestagung der Österreichischen Parkinson-Gesellschaft in Graz statt. Tagungspräsidentin Assoc. Prof.in Dr.in Petra Schwingenschuh, Medizinische ...