Aktuelle Aspekte der Radiotherapie von Hirnmetastasen beim Mammakarzinom
Autor:
Prim. Dr. Wolfgang Raunik
Abteilungsvorstand
Kärntner Landeskrankenanstalten-Betriebsgesellschaft – KABEG
Klinikum Klagenfurt am Wörthersee
Institut für Strahlentherapie/Radioonkologie
E-Mail: wolfgang.raunik@kabeg.at
Technische Fortschritte schaffen auch bei der Therapie von Hirnmetastasen neue Möglichkeiten. Die onkologische Medizin nähert sich so in der Radiotherapie dem Ziel an, Patient*innen ein langes Überleben mit wenigen Nebenwirkungen und bestmöglicher Lebensqualität zu bieten.
Das Auftreten von Hirnmetastasen ist leider kein seltenes Ereignis bei Patient*innen, die an einem Mammakarzinom erkranken. Nach dem Bronchuskarzinom (40–50%) ist Brustkrebs mit einem Anteil von 15–25% die zweithäufigste Ursache für Hirnmetastasen. Nach wie vor ist dieses Ereignis prognostisch höchst nachteilig.
Das Risiko innerhalb der Brustkrebserkrankten hängt von etablierten Kriterien ab: Negativer Hormonrezeptorstatus, HER2/neu-Expression, Grading des Tumors sowie jugendliches Alter und axillärer Lymphknotenstatus sind als Risikofaktoren bekannt. Die vielfältigen und erfolgreichen medikamentösen Therapieoptionen ermöglichen in metastasierter Erkrankungssituation mittlerweile eine beeindruckende Verlängerung des Gesamtüberlebens, also eine Chronifizierung bei guter/akzeptabler Lebensqualität.
Dabei entsteht der Eindruck, dass mit längerer Erkrankungsdauer auch das Auftreten eines zerebralen Ereignisses häufiger wird. Dem stehen Ergebnisse großer Register (Vienna Brain Metastasis Registry) entgegen, die eine konstante Rate (16,4%) in den vergangenen 20 Jahren beobachtet haben.1 Tatsächlich haben sich etliche Therapiemöglichkeiten etabliert – im interdisziplinären Miteinander hat sich die Prognose nach dem Auftreten von Hirnmetastasen verbessert.
Radiotherapie von zerebralen Metastasen
Seit über 70 Jahren ist Strahlentherapie eine erfolgreiche palliative Maßnahme und bleibt eine tragende Säule im Behandlungskonzept, gemeinsam mit Chirurgie und der medikamentösen Systemtherapie.
Bereits in den 1950er-Jahren wurde die Ganzhirnbestrahlung gegenüber alleiniger Cortisongabe als überlegen in der Behandlung von symptomatischen Hirnmetastasen bestätigt.2 Die technische Revolution in Diagnostik und Therapie eröffnet heute eine radioonkologische Behandlungsvielfalt:
-
WBRT („Whole Brain RadioTherapy“) +/– Hippocampusschonung
-
WBRT +/– SRS („Stereotactic Radiosurgery“)
-
WBRT + SIB („Simultaneous Integrated Boost“)
-
WBRT +/– Memantin
-
operative Resektion +/– SRS
-
operative Resektion +/– WBRT
-
SRS alleine
Die Komplexizität jeder einzelnen Patient*innensituation kann nur im interdisziplinären Kontext berücksichtigt und daraus ein Behandlungskonzept abgestimmt werden. Ein Tumorboard ist hierfür geeignet. Faktoren, die die Therapiewahl beeinflussen, sind:
-
ECOG Performance Status
-
Alter
-
Behandlungshistorie
-
extrakranieller Status
-
neurologische Symptomatik
-
Anzahl der Hirnläsionen
-
Gesamtvolumen aller Metastasen und Einzelvolumina
-
Lokalisation
-
Patient*innenwunsch
Bei günstiger Konstellation und Prognose wird den aufwendigeren und lokal aggressiveren Verfahren der Vorzug gegeben. Bei ungünstiger Situation mit schlechter Prognose liegt das Hauptaugenmerk auf Symptomkontrolle und Lebensqualität – die Intervention sollte also kurz und wenig belastend sein. Ärzt*innen neigen allerdings dazu, die Prognose der ihnen anvertrauten Patient*innen zu überschätzen.3
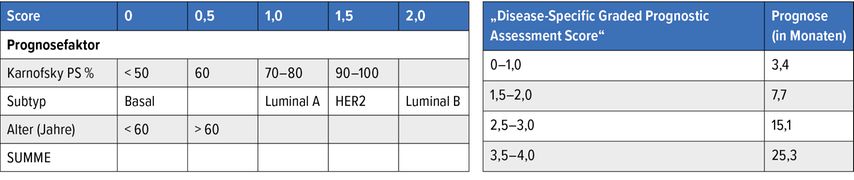
Eine einfache und gut evaluierte Entscheidungshilfe ist der „Disease-Specific Graded Prognostic Assessment Score“, der das mittlere Überleben nach Radiotherapie von Hirnmetastasen angibt (Tab. 1).4 Die Prognose ist beim Brustkrebs deutlich besser als bei allen anderen Karzinomen.
Ganzhirnbestrahlung
Die Ganzhirnbestrahlung (WBRT) bleibt eine wichtige Option bei multiplen Hirnmetastasen mit Symptomen. Auch in dieser Indikation können kurze Serien mit höheren Einzeldosen gleiche Ergebnisse erzielen wie moderate Hypofraktionierungen. 20 Sitzungen zu 2Gy wirken vergleichbar gut wie 10x3Gy sowie 5x4Gy – entsprechen also radiobiologisch einem ähnlichen Niveau. Hinsichtlich Gesamtüberleben besteht überhaupt kein Unterschied, auch das Toxizitätsprofil ist gleich.5
Der stärkste Kritikpunkt an der WBRT sind neurokognitive Defizite als mittel- und langfristige Folgen. Patient*innen mit einem günstigen GPA-Score haben eine mittlere Lebenserwartung von zwei Jahren und können damit relevante Folgen erleiden.
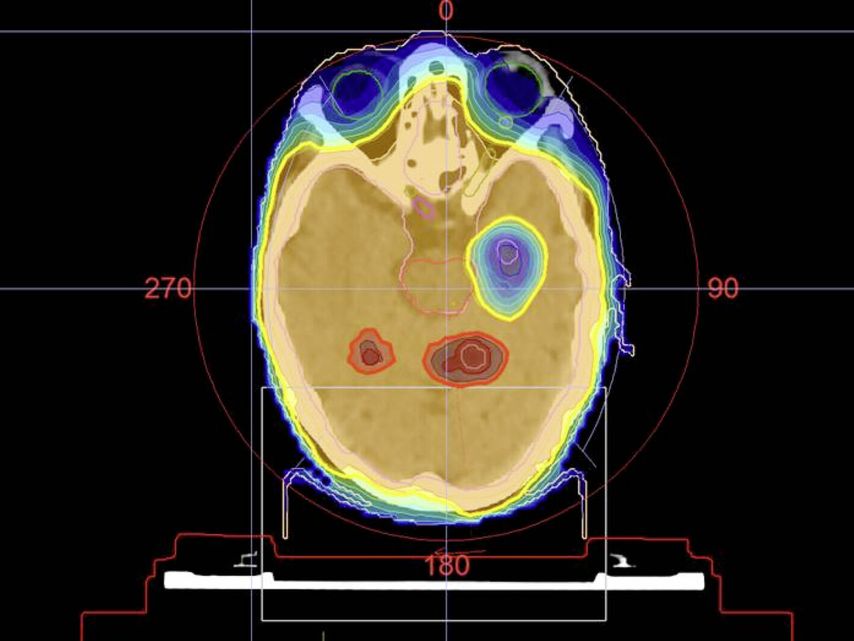
Abb. 1: Dosisverteilung mit Hippocampusschonung (blau) und SIB (rot) in der HIPPORAD-Studie. Modifiziert nach Grosu et al. 20207
Toxizität der Ganzhirnbestrahlung
In der Akutphase verursachen Beeinträchtigungen der Oligodendro- und Astrozyten und Ödeme durch Änderung der Gefäßwandpermeabilität passagere Symptome wie Fatigue, Kopfschmerzen und Übelkeit. Nach Wochen kann man neben einer Reduktion der Fähigkeit zur Neurogenese auch eine transiente Demyelinisierung beobachten.
Die Patient*innen berichten über Schläfrigkeit, Aufmerksamkeitsdefizite und eine Verschlechterung des Kurzzeitgedächtnisses. Als irreversible Spätfolge nach etlichen Monaten führen die Vaskulopathie und die Demyelinisierung zu neurokognitiven Defiziten und eventuell Radionekrosen.6
Für Patient*innen mit guter Lebenserwartung bewährt sich daher eine aufwendige und subtile Bestrahlungsplanung und Nutzung aller technischen Möglichkeiten der modernen Radiotherapie. So ist es möglich, die Hippocampus-Regionen zu schonen und gleichzeitig die Dosis in den Makrometastasen zu erhöhen, ohne die Risikoorgane zusätzlich zu belasten (SIB).
Das Projekt HIPPORAD in Deutschland beinhaltet auch eine umfassende Dokumentation und Analyse von radiodiagnostischen Verläufen sowie ein neurokognitives Monitoring.7 Erste Ergebnisse zeigen eine signifikante Reduktion der Hippocampusatrophie.8 Eine verbesserte kognitive Leistungsfähigkeit wurde von anderen Forschungsgruppen bestätigt (Brown PD et al., 2021).9
Zusätzlich kann das Antidemenzpräparat Memantin die neurokognitive Entwicklung nachweislich unterstützen – es muss allerdings über sechs Monate mit anfänglicher Dosissteigerung eingenommen werden und bleibt damit wenigen Patient*innen vorbehalten.10
Ganzhirnbestrahlung nach Chirurgie
Die Frage, welchen Nutzen eine zusätzliche WBRT nach Operation oder Radiochirurgie bringt, ist durch randomisierte Studien beantwortet:9,11 Mit WBRT ist zwar intrazerebral die lokoregionäre Tumorkontrolle besser, dies wirkt sich allerdings nicht auf die Überlebenswahrscheinlichkeit aus.
Dazu kommt die Verschlechterung der Lebensqualität durch die genannte Spättoxizität. Die Leitlinien empfehlen daher, nach Möglichkeit auf die Ganzhirnbestrahlung zu verzichten. Zur Behandlung der etwas häufigeren Rezidive sind der wiederholte Einsatz von Resektion und stereotaktischer Radiotherapie möglich. Außerdem ist das Risiko einer unerwarteten Kotoxizität mit der medikamentösen Tumortherapie deutlich geringer und das Intervall zur Fortsetzung der Systemtherapie kürzer.
Die modernen Onkologika sind üblicherweise nicht auf die Verträglichkeit einer gleichzeitigen Applikation mit Strahlentherapie getestet. Daher ist Vorsicht angezeigt. Tran TT et al. (2019) beschreiben eine Zunahme von symptomatischen Ödemen und Radionekrosen bei gleichzeitiger Gabe von Immuntherapien.12 Eine Gruppe der TU München konnte diese Beobachtung nicht bestätigen und beschreibt sogar eine verbesserte Lokalkontrolle.13
Meningeosis carcinomatosa
Eine besondere Indikation für die WBRT ist eine Meningeosis carcinomatosa. Diese Problematik tritt nach alleiniger Operation (Resttumor, Resektion in Teilstücken) oder stereotaktischer Radiotherapie häufiger auf.14 Die spezielle Konfiguration des Bestrahlungsfeldes (Helmfeld) sollte alle Nischen des Liquorraumes umfassen, wie die Sehnerven, die Lamina cribrosa und die proximalen Verläufe der Hirnnerven.
Fraktionierte stereotaktische Radiotherapie und Radiochirurgie
Seit circa 30 Jahren hat sich die einzeitige Radiochirurgie als gleichwertige respektive überlegene Alternative zur chirurgischen Resektion etabliert. Primär wurden dabei dedizierte Geräte verwendet (z.B. Gammaknife), seit 1996 wird diese Spezialtechnik in Österreich an Standard-Linearbeschleunigern durchgeführt. Metastasenvolumen, Ödem, Lage und Symptomatik sind Kriterien für die Entscheidung zwischen Operation und stereotaktischer Radiochirurgie (SRS).
Der Name „Stereotaxie“ bedeutet heute die Applikation hoher Einzeldosen mit subtiler Präzision. Ein steiler Dosisgradient zum Nachbargewebe sichert gute Verträglichkeit und verhindert Spättoxizität. Damit der Bestrahlungsmittelpunkt (Isozentrum) während des gesamten Planungsverlaufs bis zur Bestrahlung räumlich im Submillimeterbereich definiert bleibt, werden etliche Zusatzkomponenten eingesetzt (Masken, externe Koordinatensysteme und Gantry-unabhängige Bildgebung).
Einzeitige SRS bleibt Patient*innen mit wenigen Metastasen (<3 Läsionen) und kleinem Metastasendurchmesser vorbehalten. Volumen ist der stärkste Faktor für das Entstehen einer Radionekrose. Deshalb wird vielfach alternativ die Dosis mittels fraktionierter stereotaktischer Radiotherapie auf mehrere Tage (üblicherweise fünf) aufgeteilt.
Die zerebrale Kontrolle und auch das Überleben sind nach Stereotaxie einer singulären Metastase am besten. Überraschenderweise ist allerdings die Prognose nach stereotaktischer Bestrahlung von zwei bis vier Herden genauso gut wie von fünf bis zehn.15 Li J. aus dem MD Anderson Cancer Center hat 2020 eine randomisierte Studie präsentiert, in der bei vier bis 15 Metastasen die WBRT mit der SRS verglichen wurde.16 Gedächtnis und allgemeine kognitive Funktionen wurden bei SRS signifikant geschont – das Gesamtüberleben war gleich.
Conclusio
Die Radioonkologie bietet heute vielfältige Behandlungsoptionen für Patient*innen mit zerebral metastasiertem Mammakarzinom. Die moderne Technik bietet Sicherheit, Symptomkontrolle, Lebensqualität und Hoffnung.
Literatur:
1 Steindl A et al.: Changing characteristics, treatment approaches and survival of patients with brain metastasis: data from six thousand and thirty-one individuals over an observation period of 30 years. Eur J Cancer 2022; 162: 170-81 2 Chao JH et al.: Roentgen-ray therapy of cerebral metastases. Cancer 1954; 7(4): 682-9 3 Koji A et al.: The accuracy of physicians’ clinical predictions of survival in patients with advanced cancer. J Pain Symptom Manage 2015; 50(2): 139-46 4 Sperduto PW et al.: Summary report on the graded prognostic assessment: an accurate and facile diagnosis-specific tool to estimate survival for patients with brain metastases. J Clin Oncol 2012; 30(4): 419-25 5 Rades D et al.: Evaluation of 2 whole-brain radiotherapy schedules and prognostic factors for brain metastases in breast cancer patients. Cancer 2007; 110(11): 2587-92 6 Chu T et al.: Dynamic glial response and crosstalk in demyelination-remyelination and neurodegeneration processes. Neural Regen Res 2021; 16(7): 1359-68 7 Grosu et al.: Whole-brain irradiation with hippocampal sparing and dose escalation on metastases: neurocognitive testing and biological imaging (HIPPORAD) – aphase II prospective randomized multicenter trial (NOA-14, ARO 2015–3, DKTK-ROG). BMC Cancer 2020; 20(1): 532 8 Popp I et al.: Hippocampus-avoidance whole-brain radiation therapy is efficient in the long-term preservation of hippocampal volume. Front Oncol 2021; 11: 714709 9 Brown PD et al.: Effect of radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases: a randomized clinical trial. JAMA 2016; 316(4): 401-9 10 Brown PD et al.: Memantine for the prevention of cognitive dysfunction in patients receiving whole-brain radiotherapy: arandomized, double-blind, placebo-controlled trial (RTOG). Neuro Oncol 2013; 5(10): 1429-37 11 Kocher M et al.: Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study. J Clin Oncol 2011; 29(2): 134-41 12 Tran TT et al.: Perilesional edema in brain metastases: potential causes and implications for treatment with immune therapy. JImmunother Cancer 2019; 7(1): 200 13 Kowalski ES et al.: Immune checkpoint inhibition in patients treated with stereotactic radiation for brain metastases. Radiat Oncol 2020; 15: 245 14 Brown PD et al.: Hippocampal avoidance during whole-brain radiotherapy plus memantine for patients with brain metastases: phase III trial NRG oncology CC001. J Clin Oncol 2020; 38(10): 1019-29 15 Yamamoto M et al.: Stereotactic radiosurgery for patients with multiple brain metastases (JLGK0901): a multi-institutional prospective observational study. Lancet Oncol 2014; 15(4): 387-95 16 Li J et al.: Stereotactic radiosurgery versus whole-brain radiation therapy for patients with 4-15 brain metastases: a phase III randomized controlled trial. ASTRO Annual Meeting 2020
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...