Aktuelle Daten zum Brustkrebs im Frühstadium
Autor:
Assoc. Prof. Priv.-Doz. Dr. Rupert Bartsch
Universitätsklinik für Innere Medizin I
Klinische Abteilung für Onkologie
Medizinische Universität Wien
E-Mail: rupert.bartsch@meduniwien.ac.at
Im Rahmen der diesjährigen Jahrestagung der American Society of Clinical Oncology (ASCO) wurde eine Reihe von klinisch relevanten Studienergebnissen auf dem Gebiet des Mammakarzinoms im Frühstadium vorgestellt, über die im Rahmen dieses Artikels ein Überblick gegeben werden soll.
Tripelnegativer Brustkrebs
Basierend auf den Ergebnissen der BrighTNess-Studie wird die Addition von Carboplatin zu Paclitaxel vor einer Anthrazyklin/Cyclophosphamid-Kombination heute als potenzieller Standard in der neoadjuvanten Therapie des tripelnegativen Mammakarzinoms (TNBC) angesehen. Dieses Quadrupel-Regime wurde folglich auch als Chemotherapiebackbone für die Etablierung der perioperativen Immuntherapie mit Pembrolizumab in der KEYNOTE-522-Studie verwendet.
Fragen bestanden jedoch auch weiterhin in Hinblick auf eine Kombination von Carboplatin mit Docetaxel sowie auf die potenzielle Rolle von Carboplatin als Bestandteil einer postoperativen Chemotherapie nach primärer Operation. In der koreanischen Phase-III-Studie PEARLY wurden Patient:innen mit TNBC im klinischen Stadium II und III im neoadjuvanten oder adjuvanten Setting zu vier Zyklen Doxorubicin/Cyclophosphamid gefolgt von vier Zyklen einer taxanbasierten Therapie mit oder ohne Carboplatin randomisiert.1
Dabei zeigte sich eine signifikante Verbesserung der 5-Jahres-Rate des ereignisfreien Überlebens (EFS) von 75,1% auf 82,3% (HR: 0,67; p=0,012), wobei der Vorteil unabhängig von der Art des Taxans (Paclitaxel oder Docetaxel) und vom Behandlungskonzept (prä- oder postoperativ) war. Darüber hinaus war ein nichtsignifikanter Trend zu einer Verbesserung der Gesamtüberlebensrate zu verzeichnen.
Die neoadjuvante Chemo-Immuntherapie mit Pembrolizumab nach dem KEYNOTE-522-Protokoll stellt heute den Standard in der Therapie von Patient:innen mit TNBC im klinischen Stadium II und III dar. Eine adjuvante Gabe von Atezolizumab, einem weiteren Immuncheckpoint-Inhibitor (IO), nach primärer Operation erbrachte in der Studie IMpassion030 keinen Vorteil gegenüber einer alleinigen Chemotherapie.
In der Phase-III-Studie A-BRAVE wurden Patient:innen mit TNBC und hohem Rückfallrisiko zu einer postoperativen Immuntherapie mit Avelumab additiv zu einer (neo)adjuvanten Chemotherapie oder Observanz randomisiert.2 Dabei wurden zwei Gruppen unterschieden:
-
Stratum A: primäre Operation, adjuvante Chemotherapie plus Avelumab (18% der Gesamtpopulation)
-
Stratum B: postneoadjuvante Therapie mit Avelumab bei Patient:innen ohne pathologische Komplettremission (pCR) nach neoadjuvanter Chemotherapie
In der Gesamtpopulation war durch die Addition von Avelumab lediglich ein nichtsignifikanter Trend zu einer Verbesserung der Rate des krankheitsfreien Überlebens (DFS) zu beobachten, der in der Kohorte der postneoadjuvant behandelten (non-pCR) Patient:innen numerisch stärker ausgeprägt war. Auch wenn der primäre Endpunkt negativ war, war dennoch eine potenziell klinisch relevante Verlängerung der Gesamtüberlebensrate im Avelumab-Arm auffällig (HR: 0,66; 95% CI: 0,45–0,97).
Zusammenfassend lässt sich feststellen, dass die neoadjuvante Chemo-Immuntherapie mit Pembrolizumab unverändert den Standard in der genannten Situation darstellt, die Daten von PEARLY ermöglichen jedoch im Einzelfall einen flexibleren Einsatz von Carboplatin im (neo)adjuvanten Setting. Falls im neoadjuvanten Setting kein Pembrolizumab verabreicht worden ist, kann auf Basis der Studie A-BRAVE im Falle einer relevanten posttherapeutischen Tumorlast auf individueller Basis eine postneoadjuvante Therapie mit Avelumab angedacht werden, da in dieser Situation scheinbar ausreichend residuale Tumorlast gegeben sein kann, um die Wirksamkeit einer Immuntherapie zu ermöglichen.
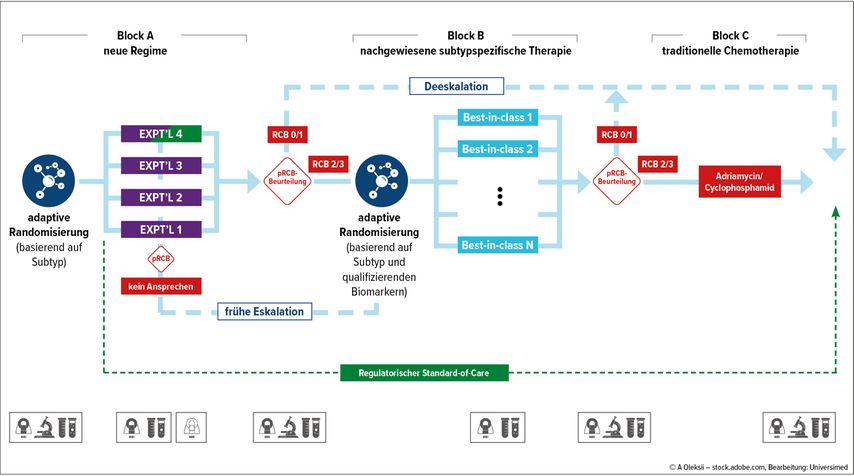
I-SPY 2.2 ist ein innovatives Phase-II-Studienprogramm, das die Wirksamkeit und Sicherheit neuer Therapieansätze sequenziell vor einer neoadjuvanten Standardtherapie untersucht (Abb. 1). Wie im Vorläufer I-SPY 2 ermöglicht dieses Design eine rasche Evaluierung der potenziellen Aktivität neuer Substanzen oder Kombinationstherapien, gleichzeitig können Deeskalationsstrategien mit frühzeitiger Operation bei gutem Ansprechen untersucht werden.
Abb. 1: I-SPY 2.2-Aufbau. Die Patient:innen beginnen mit einer adaptiven Randomisierung auf nichtstandardisierte Chemotherapieschemata. Bei geringem oder fehlendem Ansprechen nach drei und sechs Wochen (RCB2/3) werden die Patient:innen in Block B randomisiert, der aus subtypspezifischen Regimen besteht, die zuvor in I-SPY 2 getestet wurden, oder aus der Standardtherapie (SOC). Die für die Randomisierung in Block B zur Verfügung stehenden Therapien sind die besten ihrer Klasse je nach Subtyp und die Randomisierung erfolgt auf der Grundlage der Wahrscheinlichkeiten, die sich aus ihrer Leistung in I-SPY oder anderen Studien ergeben. Im Falle einer vorhergesagten Resterkrankung (RCB2/3) würden die Patient:innen des Blocks B mit AC (Adriamycin/Cyclophosphamid) behandelt. Die Patient:innen werden am Ende jeder Therapie bewertet. Diejenigen, bei denen ein vollständiges Ansprechen vorhergesagt wird (RCB 0/1), haben die Möglichkeit, sich direkt in den Operationssaal zu begeben, um eine endgültige chirurgische Behandlung durchzuführen. Nahtloses Phase-III-Design: Wirkstoffe aus Block A, die die Studie abschließen, verbleiben in der Studie (feste Randomisierung im graduierenden Subtyp (lila/grün) und werden im Vergleich zum subtypspezifischen regulatorischen Behandlungsstandard gekennzeichnet zu diesem Zeitpunkt (grüne gestrichelte Linie) getestet. Wenn die personalisierte Strategie besser ist als die Standardtherapie (SOC), wird die personalisierte Behandlung zur neuen regulatorischen SOC
Am ASCO-Jahrestreffen 2024 wurden Ergebnisse der Kombination von Datopotamab Deruxtecan, einem TROP2-gezielten Antikörper-Medikamenten-Konjugat (ADC), mit dem IO Durvalumab vorgestellt.3
In einer gemischten Population von Patient:innen mit TNBC und Hormonrezeptor(HR)-positiver/HER2-negativer Erkrankung und hohem Risiko war aufgrund des guten Ansprechens bei einem Drittel der Teilnehmer:innen die Operation bereits nach Block A möglich (d.h. nach nur vier Zyklen der experimentellen Therapie). Die modellierte pCR-Rate betrug bei Patient:innen mit TNBC 44% (95% CI: 32–56%), bei Patient:innen, deren Tumoren nach dem „response-predictive“ Subtyp als Immune+ klassifiziert wurden, 65% (95% CI: 47–83%). Auch ohne direkte klinische Konsequenz weist I-SPY 2.2 den Weg, wie die frühe Evaluierung innovativer Therapieansätze gelingen kann.
Luminaler Brustkrebs
Bei Hormonrezeptor-positiver/HER2-negativer Erkrankung im Frühstadium mit Chemotherapieindikation kann (sofern maximal drei axilläre Lymphknoten befallen sind) auf den Einsatz von Anthrazyklinen verzichtet werden und sechs Zyklen Docetaxel/Cyclophosphamid (DC) werden als potenzieller Standard angesehen.
Im amerikanischen FLEX-Register wurde untersucht, ob sich das Outcome dabei nach der Risikogruppe anhand des Mammaprint-Genexpressionsprofils unterscheidet.4 Tatsächlich fand die nichtrandomisierte Analyse einen Vorteil für eine Anthrazyklin-haltige Therapie in der H2-Gruppe, die ein besonders hohes genomisches Risiko aufweist (3-Jahres-Rate des rezidivfreien Überlebens: AC-T: 97,7% vs. DC: 86,4% bei H2; 95,3% vs. 97,1% bei H1). Aus früheren Arbeiten ist bekannt, dass die Tumoren der H2-Gruppe eine biologische Verwandtschaft zu TNBC aufweisen und im I-SPY-Programm von der Addition einer Immuntherapie profitieren, was suggeriert, dass im Randbereich der klassischen Subtypen die Grenzen verschwimmen und zukünftig weitere Biomarker zur individuellen Therapieoptimierung herangezogen werden könnten.
RxPONDER war eine prospektiv randomisierte Studie, im Rahmen derer der Benefit einer additiven Chemotherapie zu einer endokrinen Therapie bei Patient:innen mit ein bis drei positiven axillären Lymphknoten und einem OncotypeDX-Recurrence-Score zwischen 0 und 25 evaluiert wurde. Dabei hatte sich in der Gruppe der Teilnehmer:innen, die als prämenopausal klassifiziert worden waren, ein signifikanter Vorteil für die Chemotherapie gezeigt. Dieses Ergebnis und die Tatsache, dass in RxPONDER weniger als 10% der Patient:innen eine hormonelle Blockade mittels GnRH-Analoga und Aromatasehemmer als endokrine Therapie erhalten hatten, führte neuerlich zur Diskussion, ob hier der endokrine Effekt der Chemotherapie (also die Induktion der Amenorrhö durch Chemotherapie) im Vordergrund steht.
Ergebnisse, die am ASCO-Jahrestreffen 2024 vorgestellt wurden, untermauern diese Hypothese:5 Nur bei der Gruppe prämenopausaler Patient:innen, bei denen der Spiegel des Anti-Müller-Hormons (AMH) ≥10pg/ml war und die folglich auch seitens der ovariellen Reserve als prämenopausal angesehen wurden, bestand ein Vorteil für die Chemotherapie. Dies führt zum Schluss, dass die Optimierung der endokrinen Therapie im Vordergrund stehen sollte und nicht reflektorisch bei prämenopausalen Frauen mit luminaler nodal-positiver Erkrankung eine Chemotherapie angedacht werden sollte.
Ein weiterer Ansatz, um den Effekt der adjuvanten Therapie bei HR-positiver/HER2-negativer Erkrankung zu verbessern, ist die Addition eines CDK4/6-Inhibitors zu einer endokrinen Standardtherapie. Basierend auf den Daten der MonarchE-Studie wurde Abemaciclib bei hohem Rückfallrisiko bereits zugelassen, die Zulassung von Ribociclib basierend auf der Studie NATALEE bei intermediären bis hohem Risiko wird in Bälde erwartet. Zu beiden prospektiv randomisierten Phase-III-Studien wurden am ASCO-Jahrestreffen 2024 neue Daten präsentiert.
In einer Subgruppe der Patient:innen der MonarchE-Studie (n=910) war eine Untersuchung auf das Vorliegen von zirkulierender Tumor-DNA (ctDNA) erfolgt.6 Wie zu erwarten, war bei Patient:innen mit nachweisbarer ctDNA ein deutlich höheres Rezidivrisiko zu verzeichnen. Besonders deutlich wird das Risiko aber bei Patient:innen, bei denen unter Therapie ctDNA persistiert oder eine initial negative Probe im Verlauf positiv wurde – in diesen Fällen war fast stets ein Rückfall zu verzeichnen, was auf die Notwendigkeit hindeutet, bei Patient:innen mit Mammakarzinom im Frühstadium und nachweisbarer ctDNA Eskalationsstrategien zu evaluieren.
Im Unterschied zur Studie MonarchE, in die nur Patient:innen mit nodal-positiver Erkrankung eingeschlossen werden konnten, war in NATALEE auch der Einschluss von Patient:innen mit negativem Nodalstatus bei Vorliegen weiterer Risikofaktoren möglich. Nunmehr wurden Daten der pN0-Gruppe (n=613) bei 38,7 Monaten medianen Follow-ups präsentiert.7
In dieser Population konnte durch Addition von Ribociclib zu endokriner Therapie mit einem Aromatasehemmer das invasive DFS bei niedrigen Ereigniszahlen numerisch von 90,6% auf 93,2% verbessert werden (HR: 0,723; 95% CI: [0,412–1,268]). Auch wenn dies formal keine statistische Signifikanz erreichte, war das Ergebnis in Übereinstimmung mit der Gesamtpopulation. Insgesamt weisen diese Daten auf die Möglichkeit hin, auch bei intermediärem Risiko bzw. bei pN0-Situation die adjuvante Therapie zu intensivieren und so das Rückfallrisiko weiter zu senken. Abhängig vom Ausgangsrisiko muss die Entscheidung jedoch auf individueller Basis im Sinne eines „Shared-decision-making“-Konzepts getroffen werden.
Die ADAPTcycle-Studie wird zeigen, ob der Ersatz einer Chemotherapie durch Addition eines CDK4/6-Inhibitors zu adjuvanter endokriner Therapie möglich ist, was den wesentlichen nächsten Schritt darstellen würde.
Literatur:
1 Sohn J et al.: ASCO 2024; Abstr. #LBA502 2 Conte PF et al.: ASCO 2024; Abstr. #LBA500 3 Shatsky R et al.: ASCO 2024; Abstr. #LBA501 4 O’Shaughnessy J et al.: ASCO 2024; Abstr. #511 5 Kalinsky K et al.: ASCO 2024; Abstr. #505 6 Loi S et al.: ASCO 2024; Abstr. #LBA507 7 Yardley GN et al.: ASCO 2024; Abstr. #512
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...