Antibody-Drug Conjugates auch für ältere Patient:innen geeignet
Bericht:
Mag. Dr. Anita Schreiberhuber
In der Webinar-Reihe „How I Treat“ ging es am 30. April um den Einsatz von Antibody-Drug Conjugates (ADC) beim metastasierten Mammakarzinom mit dem Fokus auf die Therapie von Patient:innen über 65 Jahren. Aus den klinischen Studien liegen dazu nur wenige Daten vor. Zudem handelt es sich um ein selektioniertes Kollektiv. Die Frage lautet daher: Können diese Ergebnisse in die tägliche klinische Praxis übersetzt werden?
Ältere Patient:innen in Studien unterrepräsentiert
Die optimale Therapie von älteren Patient:innen mit metastasiertem Mammakarzinom (MBC) im Zeitalter der Antibody-Drug Conjugates (ADC) ist eine Herausforderung. „Das Problem ist, dass in klinischen Studien eine Patient:innenselektion vorgenommen wird und die wenigen älteren Patient:innen, die die Einschlusskriterien erfüllen, gewissermaßen eine idealisierte Population darstellen, indem sie einen guten Performancestatus und nur wenige Komorbiditäten aufweisen“, sagte Assoc. Prof. Priv.-Doz. Dr. Rupert Bartsch, Medizinische Universität Wien. Die klinische Realität sieht laut Bartsch anders aus: „Die älteren Patient:innen, die wir in den Ambulanzen sehen, weisen diverse Komorbiditäten auf und nehmen dementsprechend mehrere Begleitmedikationen ein. Inwieweit sind die Studienergebnisse daher auf dieses Kollektiv übertragbar? Und inwieweit sind unsere Therapien in diesem Kollektiv genauso sicher?“
Für das HR+/HER2– MBC konnte laut Daten aus dem Register der Austrian Group Medical Tumor Therapy (AGMT) zur Zeit der Zulassung der CDK4/6-Inhibitoren (-I) eine deutliche Verlängerung des medianen Gesamtüberlebens (mOS) um ein Jahr erzielt werden.1 Kommen diese Fortschritte aber auch bei älteren MBC-Patient:innen an? De facto wird in diesem Kollektiv eine höhere BC-spezifische Mortalität beobachtet.2 Aus dem dänischen Krebsregister (medianes Follow-up: 10 Jahre) mit rund 12000 weiblichen MBC-Patientinnen geht hervor, dass in der jüngeren Population über die Jahre eine OS-Verlängerung erzielt werden konnte, dieser Benefit bei den Älteren jedoch nicht angekommen ist.3
Hingegen konnte in einer von der FDA (Food and Drug Administration) geforderten gepoolten Analyse zur Gabe eines CDK4/6-I plus einem Aromatase-Inhibitor (AI) in der Erstlinie (1L) gezeigt werden, dass die Verlängerung des progressionsfreien Überlebens (PFS) auch bei Ansetzen unterschiedlicher Alters-Cut-offs (>65, >75 Jahre) im Vergleich zur AI-Monotherapie erhalten bleibt. Dasselbe trifft auf die Nebenwirkungen (AE) und die Verträglichkeit zu: Es wurden keine Unterschiede zwischen den einzelnen Subgruppen nachgewiesen.4 Bartsch stellte jedoch infrage, ob diese Ergebnisse tatsächlich repräsentativ sind und auf die tägliche Praxis übertragen werden können. Er forderte klinische Studien zu älteren Patient:innen, in denen ein geriatrisches Assessment und eine kontinuierliche Evaluierung der Lebensqualität (Qol) durchgeführt werden.
„Wir wissen, dass viele Patient:innen unter endokriner Therapie (ET) + CDK4/6-I viele Jahre einen stabilen Verlauf aufweisen. Der Großteil entwickelt aber früher oder später eine Progression und wir benötigen weitere Therapielinien. Nach den 2L-SOC (Standard of Care) liegt der Weg zu den ADC nahe und bei tripelnegativem MBC (TNBC) noch näher“, so Bartsch.
Wirkmechanismus der ADC
ADC sind Kombinationen aus einem monoklonalen Antikörper, einem Linker und einem Zytostatikum in einem einzigen Molekül. Das Toxizitätsprofil ist abhängig von: Zielstruktur, Linkertechnologie (stabil vs. instabil; instabil; spaltbar vs. nicht spaltbar), Toxizität der CTx und Zahl der CTx-Moleküle, die an ein Molekül des Antikörpers gebunden sind.5,6 Das ADC bindet an den Oberflächen-Antigen(AG)-Rezeptor der Zelle, im Anschluss wird der AG-ADC-Komplex internalisiert, woraufhin nach lysosomaler Degradierung intrazellulär die Freisetzung des Zytostatikums erfolgt: So können durch Ruptur der DNA oder der Mikrotubuli die Tumorzellen gezielt in die Apoptose geführt werden.5 „Die ADC-assoziierten AE sind charakteristisch für CTx! Aus der klassischen CTx-Zeit wissen wir, dass bei älteren/als „frail“ eingestuften Patient:innen AE der Grade 3/4 zunehmen – deswegen müssen wir die unter ADC auftretenden AE genau beobachten!“, betonte Bartsch.
Einsatz von ADC in der klinischen Praxis
Mit der Zulassung im Dezember 2020 ist Trastuzumab Deruxtecan (T-DXd) ein First-in-Class-ADC der dritten Generation.7 Basis der Zulassung waren die Ergebnisse der Phase-III-Studie DESTINY-Breast03.8 T-DXd ist für das HER2+ MBC nach mehr als einer HER2-gerichteten Therapie zugelassen9 und hat sich in dieser Indikation als 2L-SOC etabliert. Inzwischen ist dieses ADC auch aufgrund der signifikanten PFS-Überlegenheit im Vergleich zu T-DM1 (Trastuzumab Maytansin) in DESTINY-Breast0410 für das „HER2-low“ MBC nach mehr als einer CTx zugelassen.9 In DESTINY-Breast03 wurde unter T-DXd eine PFS-Verlängerung im Vergleich zu T-DM1 um mehr als das Doppelte erzielt (12-Monats-PFS: 75,8 vs. 34,1%; p<0,001). „Der Grund, warum T-DXd so viel effektiver ist als T-DM1, liegt einerseits im Zytostatikum, das eine andere Zielstruktur und eine hohe Potenz hinsichtlich der Topoisomerase-1-Inhibition aufweist. Andererseits liegt es an der Linkertechnologie von T-DXd. Dabei handelt es sich um einen spaltbaren, im Plasma stabilen Linker, woraus der bekannte ,Bystander-Effekt‘ resultiert“, erklärte Bartsch.
Neben gastrointestinalen (GI) AE und Fatigue sind vor allem T-DXd-assoziierte interstitielle Lungenkrankheiten (ILD) zu erwähnen, bei denen ein sofortiges Handeln erforderlich ist.8 Wegen der häufigen GI AE empfiehlt Bartsch die Verabreichung einer Triple-emetischen Prophylaxe.
Ein anderer Treiber und eine Zielstruktur beim Mammakarzinom ist TROP-2. Das gegen TROP-2 gerichtete ADC Sacituzumab Govitecan (SG) ist wie T-DXd ein Topoisomerase-1-I und weist einen spaltbaren Linker auf. SG ist für das mTNBC und das HR+/HER2– MBC für Patient:innen zugelassen, die mehr als zwei Vortherapien erhalten haben.11 In beiden Zulassungsstudien (ASCENT12 bzw. TROPiC-0213) wurde eine signifikante Überlegenheit in PFS und OS im Vergleich zur CTx nach Wahl der Prüfärzt:innen nachgewiesen. SG ist ebenfalls hoch emetogen und erfordert eine entsprechende Prophylaxe. Zu weiteren AE zählen Fatigue und Neutropenie.11–13
Daten zu älteren Patient:innen unter ADC
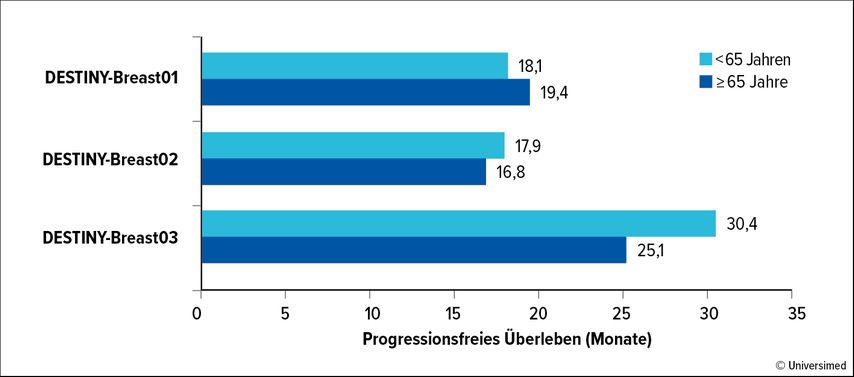
Kropet al. haben eine gepoolte altersspezifische Analyse der Studien DESTINY-Breast01–03 hinsichtlich Wirksamkeit und Sicherheit durchgeführt. Die Ergebnisse zeigen, dass ältere Patient:innen (≥65 Jahre vs. <65 Jahren) gleichermaßen hinsichtlich PFS (Abb. 1) und OS von T-DXd profitieren. Auch Ansprechraten und -dauer sowie die relative Dosisdichte waren zwischen den Altersgruppen vergleichbar.14 „Das deutet darauf hin, dass es sich um ein Kollektiv von älteren Patient:innen handelt, das noch relativ fit war“, merkte Bartsch an. Numerisch war ein Anstieg der TEAE (Treatment-emergent AE) ≥Grad 3 bei den ≥65-Jährigen im Vergleich zu den <65-Jährigen zu beobachten. Dasselbe trifft auf schwerwiegende TEAE, Dosisreduktionen und -unterbrechungen zu, was aber nicht zu einer höheren Rate an Therapieabbrüchen geführt hat. Bei Selektion der ≥75-Jährigen waren diese Effekte nicht nachweisbar. Dabei handelte es sich jedoch um eine sehr kleine Population (n=50; ≥65 Jahre: n=273; <65 Jahren: n=1043).14 Vergleichbare Ergebnisse liegen aus einer Subanalyse der ASCENT-Studie zu SG vor.15
Abb. 1: Medianes progressionsfreies Überleben: gepoolte Analyse der Studien DESTINY-Breast01–03 nach Alter (modifiziert nach Krop IE et al.)14
Bartsch kommentierte die Ergebnisse folgendermaßen: „Dass schwerwiegende TEAE bei älteren Patient:innen häufiger auftreten, ist ein Phänomen, das wir kennen. Wie bei den CDK4/6-I müssen wir bei diesem Kollektiv wachsamer sein. Im Wissen, dass damit keine Einbußen in der Wirksamkeit zu erwarten sind, tendieren wir zu Dosisreduktionen.“ Bezüglich der höheren Rate an Niedriggrad-ILDs, die bei den ≥65-Jährigen beobachtet wurde, machte Bartsch auf die Relevanz einer entsprechenden Schulung aufmerksam, in die ggf. auch die Angehörigen eingebunden werden sollten.
Fazit: mehr Studien mit Älteren wünschenswert
In seiner Zusammenfassung stellte Bartsch erneut die Repräsentativität von Studienergebnissen hinsichtlich der Übertragbarkeit auf den klinischen Alltag bei älteren Patient:innen infrage, noch dazu, weil Ältere (≥65 Jahre) sehr wohl noch sehr fit sein können. Anhand der verfügbaren Daten zu ADC bei älteren Patient:innen können diese zwar sicher zum Einsatz kommen. Wünschenswert wären allerdings klinische Studien, die speziell für diese Population konzipiert sind, um Daten zu generieren, die auch für das Real-World-Setting als aussagekräftiger gewertet werden können.
Quelle:
„How I Treat. Brustkrebs im Alter“, Webinar am 30. April 2024
Literatur:
1 Rinnerthaler G et al.: SABCS 2023; Poster #P04-04-14 2 Greco SJ: Breast Cancer (Dove Med Press) 2019; 11: 111-3 3 De Glas N et al.: Breast Cancer Res Treat 2019; 178(1): 141-9 4 Singh H et al.: SABCS 2017; Abstr. #GS05-06 5Trail PA et al.: Pharmacol Ther 2018; 181: 126-42 6 Tsuchikama K, An Z: Protein Cell 2018; 9(1): 33-46 7 www.ema.europa.eu/en/medicines/human/EPAR/enhertu#authorisation-details 8 Cortés J et al.: N Engl J Med 2022; 386(12): 1143-54 9 Fachinformation Trastuzumab deruxtecan, Stand: März 2024 10 Modi S et al.: N Engl J Med 2022; 387(1): 9-20 11Fachinformation Sacituzumab govitecan, Stand: August 2023 12 Bardia A et al.: N Engl J Med 2021; 384(16): 1529-41 13 Rugo HS et al.: Lancet 2023; 402(10411): 1423-33 14Krop IE et al.: ASCO 2023; Oral Presentation #1006 + Abstract #1006 15 Kalinski K et al.: ASCO 2021; Abstr. #1011
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...