Bedeutung der MRD bei akuter myeloischer Leukämie
Autoren:
Dr. Jennifer Moritz
Ao. Univ.-Prof. Dr. Albert Wölfler
Klinische Abteilung für Hämatologie
Medizinische Universität Graz
Korrespondenz:
E-Mail: albert.woelfler@medunigraz.at
E-Mail: jennifer.moritz@medunigraz.at
Eine erfolgreiche Behandlung der akuten myeloischen Leukämie (AML) gilt trotz zahlreicher Fortschritte in den letzten Jahren aufgrund der hohen Rezidivrate weiter als große Herausforderung. Wie das Ausmaß der minimalen Resterkrankung bestimmt werden kann und welche therapeutische Relevanz sich daraus ergibt.
Keypoints
-
Mittels MRD-Diagnostik kann bei AML-Patient*innen in kompletter Remission die Persistenz von Chemotherapie-resistenten Leukämiezellen nachgewiesen werden. Ein positiver MRD-Status geht mit einem deutlich reduzierten krankheitsfreien als auch Gesamtüberleben einher.
-
Aktuell werden bei der AML die Durchflusszytometrie und der Nachweis von Fusionsgenen bzw. spezifischen Mutationen (NPM1) mittels quantitativer PCR (qPCR) für die MRD-Diagnostik eingesetzt.
-
Die klinische Implementierung der MRD-Diagnostik stellt eine vielversprechende Möglichkeit zur Therapieindividualisierung und Abschätzung des Rezidivrisikos bei AML-Patient*innen dar und könnte zum Beispiel in die Entscheidung zur Durchführung einer alloSCT eingebunden werden. Der Stellenwert solcher Behandlungsstrategien muss zukünftig in großen prospektiven klinischen Studien geprüft werden.
Während prognostische Faktoren zum Zeitpunkt der Diagnose – wie Alter der Patient*innen, Karyotyp und Mutationsprofil – bereits als essenzielle Grundlage für therapeutische Entscheidungen herangezogen werden, ist die Bedeutung einer nachgewiesenen messbaren Resterkrankung („measurable residual disease“, MRD) im Verlauf der Therapie noch nicht einheitlich in den Leitlinien abgebildet.
Mittels MRD-Diagnostik kann bei AML-Patient*innen in kompletter Remission die Persistenz von Chemotherapie-resistenten Leukämiezellen nachgewiesen werden, welche einer rein morphologischen Diagnostik mittels Mikroskopie des Knochenmarks entgehen.
Eine rezente Metaanalyse von 81 Studien unterstreicht die Bedeutung der MRD-Bestimmung: Eine MRD-Persistenz bei AML geht mit einem deutlich reduzierten krankheitsfreien Überleben (64% vs. 25% nach 5 Jahren) als auch Gesamtüberleben (68% vs. 34%) einher.1 Diese Daten veranschaulichen die prognostische Bedeutung der MRD-Diagnostik und etablieren diese als Erfolg versprechende Basis zur Therapieindividualisierung bei AML-Patient*innen.
Methoden der MRD-Diagnostik
Aktuell werden bei der AML die Durchflusszytometrie und der Nachweis von Fusionsgenen bzw. spezifischen Mutationen mittels quantitativer PCR (qPCR) für die MRD-Diagnostik eingesetzt. Insgesamt liegt die Sensitivität der MRD-Detektion bei der AML mit diesen Methoden in einem Bereich zwischen 10–3 und 10–6, das heißt, es kann eine Leukämiezelle unter tausend bis einer Million normalen Zellen nachgewiesen werden.
Die sensitivste Methode zur MRD-Diagnostik stellt aktuell die qPCR dar, mit welcher die für AML typischen Fusionsgene RUNX1-RUNX1T1, CBFB-MYH11 sowie die NPM1-Mutation mit hoher Genauigkeit nachgewiesen werden können. Zudem kann durch die quantitative Bestimmung der Mutationen verfolgt werden, ob diese im Krankheitsverlauf ab- oder zunehmen. Der Nachteil der MRD-Diagnostik mittels qPCR ist jedoch, dass die genannten mittels PCR detektierbaren Marker nur bei etwa 50% der Erkrankten nachweisbar sind.
Liegt kein Fusionsgen oder keine Mutation vor, die einer standardisierten qPCR zugänglich sind, sollte eine MRD-Messung mittels Durchflusszytometrie („multicolour flow-cytometry“, MFC) erfolgen. Mittels MFC werden abnorme Antigen-Expressionsmuster auf den AML-Zellen, sogenannte Leukämie-assoziierte aberrante Immunphänotypen (LAIPs) festgestellt, die eine Unterscheidung von normalen Knochenmarkszellen ermöglichen. Vorteile dieser Methode sind die breite Anwendbarkeit bei nahezu allen Patient*innen und eine rasche Verfügbarkeit des Ergebnisses. Die Sensitivitätsraten der MFC sind mit zumindest 10–3 jedoch niedriger als die der PCR. Zudem ist die Methodik arbeitsaufwendig und schlecht standardisierbar.2
Aus diesem Grund wird zunehmend der Nachweis von krankheitsspezifischen Mutationen mittels „next-generation sequencing“ (NGS) zur MRD-Diagnostik in Studien geprüft. Diese Methode zeichnet sich vor allem dadurch aus, dass sie im Gegensatz zur qPCR mehrere mutierte Gene gleichzeitig identifizieren und somit bei nahezu allen Patient*innen angewandt werden kann. Bisher hat sich NGS als Standard zur MRD-Diagnostik jedoch noch nicht etabliert, da die Sensitivität ohne zusätzliche Fehlerkorrektur relativ gering ist. Zusätzlich ist es nicht immer möglich, zwischen Mutationen einer klonalen Hämatopoese und Leukämie-spezifischen Mutationen zu unterscheiden.
Aktuelle Empfehlungen
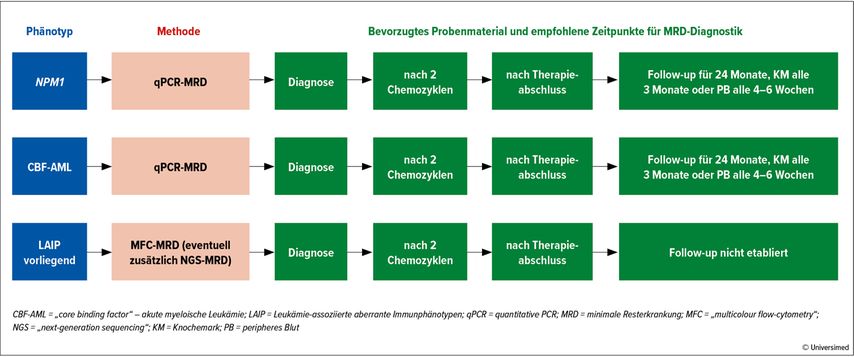
Entsprechend der aktuellen ELN-Empfehlungen von 20213 sollte bei allen AML-Patient*innen in kompletter Remission eine MRD-Diagnostik zur Risikoabschätzung für ein Rezidiv durchgeführt werden. Bei Vorliegen von Fusionsgenen oder einer NPM1-Mutation sollte eine qPCR zum Zeitpunkt der Diagnose, nach zwei Chemotherapiezyklen und nach Abschluss der Therapie durchgeführt werden (Abb. 1).
Abb. 1: Empfohlene MRD-Diagnostik bei unterschiedlichen AML-Subtypen: Standardmethode zum MRD-Nachweis ist bei NPM1-mutierten sowie CBF-AMLs die qPCR aus peripherem Blut oder Knochenmark, AMLs ohne spezifische Mutation können mittels MFC aus Knochenmarksproben auf das Vorliegen einer MRD evaluiert werden. Nachfolgend sollte der MRD-Status für alle Patient*innen nach zwei Chemozyklen und am Behandlungsende sowie regelmäßig in einem Follow-up-Zeitraum von 24 Monaten erhoben werden (adaptiert nach Heuser M et al.)3
Im Anschluss sollte alle 3 Monate aus dem Knochenmark oder alle 6 Wochen aus dem peripheren Blut eine qPCR für zumindest 2 Jahre erfolgen. Besteht nach Abschluss der Therapie ein persistierend nachweisbares qPCR-Produkt, das sich im Verhältnis zum Diagnosezeitpunkt um weniger als 3–4 log10-Stufen vermindert hat, liegt eine klinisch relevante MRD-Positivität vor. Ähnliches gilt für das Wiederauftreten eines (zweimalig) positiven Signals im Rahmen der Nachsorge nach zwischenzeitlich negativem MRD-Ergebnis.
Für Patient*innen ohne Möglichkeit einer qPCR sollte eine MRD-Diagnostik mittels MFC aus dem Knochenmark zum Zeitpunkt der Diagnose, nach zwei Chemotherapiezyklen sowie nach Abschluss der Therapie durchgeführt werden. Hier gilt ein Nachweis von Leukämiezellen >10–3 als klinisch relevante MRD-Positivität. NGS alleine wird zur MRD-Detektion als noch unzureichend angesehen, kann aber in bestimmten klinischen Situationen zur Entscheidungsfindung der optimalen Therapie herangezogen werden.3
Therapeutische Konsequenzen
Trotz des signifikanten prognostischen Einflusses der MRD liegen bislang erst wenige Studiendaten zur Einbeziehung des MRD-Status in weitere therapeutische Schritte vor. Bataller et al. konnten in einer Kohorte von 110 NPM1-mutierten AML-Patient*innen zeigen, dass Patient*innen mit molekularem Rezidiv von einer sofortigen Therapie profitieren. So lag die 2-Jahres-Überlebensrate bei Patient*innen, welche bereits im molekularen Rezidiv einer erneuten Therapie zugeführt wurden, bei 80%. Das Gesamtüberleben der Patient*innen, welche erst im morphologischen Rezidiv behandelt wurden, war indessen mit 40% nach 2 Jahren vergleichsweise gering.4 Die Ergebnisse veranschaulichen, dass Patient*innen durch regelmäßige Untersuchung auf das Wiederauftreten einer MRD und frühzeitiges therapeutisches Einschreiten bei molekularem Rezidiv profitieren können.
Die Bedeutung des MRD-Status im Rahmen der allogenen Stammzelltransplantation (alloSCT) wurde von Hourigan et al. untersucht. Dabei fanden sie heraus, dass bei MRD-positiven Patient*innen vor alloSCT eine RIC-Konditionierung im Vergleich zur MAC-Konditionierung mit einem erhöhten Relaps-Risiko verbunden war. Auch wenn die erhöhte Transplant-assoziierte Mortalität durch MAC-Konditionierung berücksichtigt wurde, ergab sich insgesamt für MRD-positive Patient*innen ein verlängertes Gesamtüberleben durch die Anwendung einer myeloablativen Chemotherapie.5
Venditti et al. führten 61 Patient*innen mit „intermediate risk“ je nach MRD-Status einer autologen oder alloSCT zu. Sie konnten zeigen, dass durch eine MRD-abhängige autologe vs. alloSCT kein Unterschied im 2-Jahres-Gesamtüberleben und progressionsfreien Überleben zwischen der MRD-positiven und -negativen Kohorte bestand. Diese Ergebnisse lassen vermuten, dass MRD-negativen Patient*innen die erhöhte Toxizität und Mortalität einer alloSCT erspart werden könnten.6
In den aktuellen ELN-Empfehlungen von 2021 wird bezüglich der klinischen Implementierung der MRD-Diagnostik empfohlen, dass mittels MFC MRD-positive AML-Patient*innen sowie jene mit persistierendem, klinisch relevantem Nachweis eines Fusionsgens oder einer NPM1-Mutation in der qPCR als auch Patient*innen mit molekularem Rezidiv individualisierten Therapieansätzen, vorzugsweise im Rahmen von Studien, zugeführt werden sollten. FürPatient*innen mit „intermediate risk“ nach ELN-Kriterien und negativem MRD-Status nach zwei Chemotherapiezyklen kann statt einer alloSCT auch eine herkömmliche Konsolidierungstherapie erwogen werden.3
Fazit
Insgesamt kann gesagt werden, dass die MRD-Messung bereits jetzt einen wertvollen Beitrag zur Therapieoptimierung anhand der Abschätzung des Rezidivrisikos leisten kann und das frühzeitige Eingreifen bei molekularem Rezidiv trotz histologisch anhaltend kompletter Remission ermöglicht. Zur vollständigen klinischen Etablierung im Sinne einer MRD-gesteuerten individualisierten Therapie muss neben der Standardisierung der Methodik der Stellenwert von solchen Behandlungsstrategien in großen prospektiven klinischen Studien geprüft werden.
Literatur:
1 Short NJ et al.: Association of measurable residual disease with survival outcomes in patients with acute myeloid leukemia. a systematic review and meta-analysis. JAMA Oncol 2020; 6: 1890-9 2 Voso MT et al.: MRD in AML: the role of new techniques. Review. Front Oncol 2019; 9: 655 3 Heuser M et al.: 2021 Update on MRD in acute myeloid leukemia: a consensus document from the European LeukemiaNet MRD Working Party. Blood 2021; 138: 2753-67 4 Bataller A et al.: Acute myeloid leukemia with NPM1 mutation and favorable European LeukemiaNet category: outcome after preemptive intervention based on measurable residual disease. Br J Haematol 2020; 191: 52-61 5 Hourigan CS et al.: Impact of conditioning intensity of allogeneic transplantation for acute myeloid leukemia with genomic evidence of residual disease. J Clin Oncol 2019; 38: 1273-83 6 Venditti A et al.: GIMEMA AML1310 trial of risk-adapted, MRD-directed therapy for young adults with newly diagnosed acute myeloid leukemia. Blood 2019; 134: 935-45
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...