Das ZNS im Fokus
Bericht:
Dr. Corina Ringsell
Jeden Monat lädt das CCC zur hybriden Fortbildung Cancer Update. Im Folgenden lesen Sie eine Zusammenfassung des Cancer Updates zu Tumoren des zentralen Nervensystems (ZNS) bei Kindern und Erwachsenen. Schon die Auswahl von neun Vortragenden aus unterschiedlichen Fachbereichen unterstreicht, wie wichtig dabei die inter- und multidisziplinäre Zusammenarbeit in spezialisierten Zentren ist. Dies betonten die Referentinnen und Referenten auch in ihren jeweiligen Vorträgen.
Neu war bei diesem Cancer Update, dass es interaktiv gestaltet war. Vor jedem Vortrag wurde eine Frage gestellt, welche die Zuhörenden im Saal und online mittels Scannens eines QR-Codes anonym beantworten konnten. Ob sie richtig gelegen hatten, erfuhren sie anschließend im Vortrag.
Hirntumoren: vielgestaltig, aber insgesamt selten
Zu Beginn gab Univ.-Prof. Dr. Adelheid Wöhrer, inzwischen Direktorin des Instituts für Pathologie, Neuropathologie & Molekularpathologie der Medizinischen Universität Innsbruck, einen Überblick über die wichtigsten Hirntumortypen. Insgesamt seien Hirntumoren selten, sagte sie. Sie machen etwa 1–2% aller Tumorerkrankungen aus; für Österreich bedeutet dies rund 1800 Neuerkrankungen/Jahr. Anders sei dies bei Kindern und Jugendlichen: Hier gehörten Hirntumoren zu den häufigsten Tumorkrankheiten und seien die häufigste Krebstodesursache, betonte sie.
Bei Erwachsenen sind mehr als die Hälfte der Hirntumoren gutartig, können aber dennoch teils gravierende Symptome verursachen, unter anderem Kopfschmerzen, epileptische Anfälle, Sprach- oder Sehstörungen. In den meisten Fällen ist die Ursache der Tumoren unbekannt; es gibt allerdings Risikofaktoren, die sie begünstigen. Dazu zählen beispielsweise hereditäre Prädispositionen (z.B. Neurofibromatose), ionisierende Strahlung, Immunsuppression und Übergewicht.
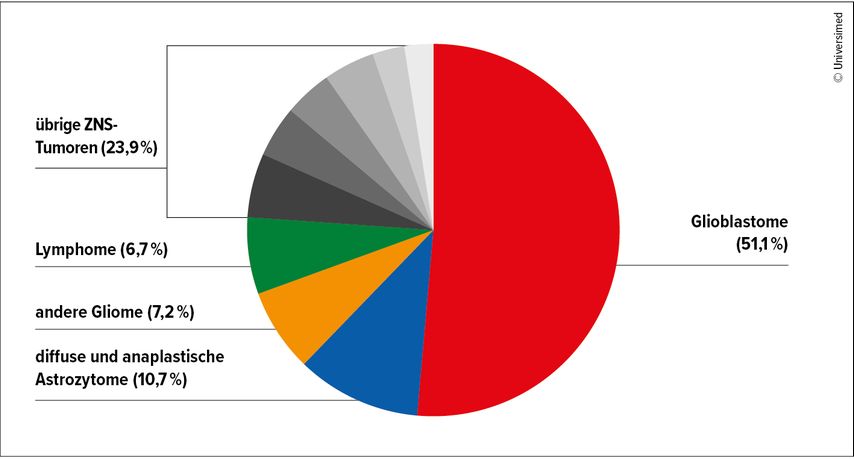
Derzeit seien mehr als 120 verschiedene ZNS-Tumortypen beschrieben, es könnten aber auch mehr werden, so Wöhrer. Denn: Die Klassifikation erfolgt nicht mehr nur morphologisch, sondern auch molekularbiologisch.1 Am häufigsten treten Meningeome (>40%) auf, gefolgt von Glioblastomen (14%) und Schwannomen (8%). Bei den malignen Hirntumoren machen Glioblastome mehr als die Hälfte der Fälle aus (Abb. 1).2
Wöhrer ging auch kurz auf die sekundären Hirntumoren, die Metastasen, ein. Diese seien fünf- bis zehnmal häufiger als primäre Tumoren, erklärte sie. Die meisten entstünden durch hämatogene Absiedelung von Krebszellen aus Bronchial- und Mammakarzinomen sowie Melanomen.
Neurologische Symptome bei Hirntumoren
DDr. Anna Grisold, Arbeitsgruppe für Neuroonkologie an der Universitätsklinik für Neurologie, MedUni Wien/AKH Wien, informierte über neurologische Symptome und Diagnostik bei ZNS-Tumoren. Meist träten neurologische Symptome bei Gehirntumoren subakut über Tage bis Wochen auf, außer z.B. epileptische Anfälle, die durch einen akuten Beginn charakterisiert sind. Daher sollte man bei einem erstmaligen epileptischen Anfall im Erwachsenenalter unbedingt auch einen Gehirntumor in Betracht ziehen.3
Die Symptome von ZNS-Tumoren sind vielgestaltig, es können unter anderem Kopfschmerzen, Seh- und Hörstörungen, Paresen oder kognitive Defizite auftreten. Dies ist unter anderem von der Tumorlokalisation und -biologie abhängig. Zunächst werden die Patient:innen klinisch neurologisch untersucht. Danach wird eine Bildgebung veranlasst, präferentiell sollte ein MRT (+/– Kontrastmittel) des Kopfes angefertigt sowie bei Verdacht auf epileptische Anfälle oder unklare Bewusstseinsstörungen ein EEG vorgenommen werden. Bei Verdacht auf eine Meningeosis carcinomatosa oder eine Infektion kann ggf. eine Lumbalpunktion erfolgen.4 Im Verlauf der Tumorerkrankung kann ein Hirnödem auftreten, das jedoch nur behandelt werden sollte, wenn es symptomatisch ist. Medikamentös wird Dexamethason oral (im Notfall als Bolus i.v.) verabreicht, ein ausschleichendes Prozedere und eine baldige Beendigung der Therapie ist wichtig, um Nebenwirkungen zu vermeiden.4,5
Die Diagnose einer tumorbedingten Epilepsie kann beim Vorliegen entsprechender Veränderungen im Gehirn bereits nach dem ersten Anfall gestellt werden. Besonders hoch ist die Wahrscheinlichkeit bei kortikalen (temporalen > frontalen > parietalen) Läsionen sowie auch bei IDH-mutierten Tumoren. Die höchste Prävalenz tumorassoziierter Epilepsien liegt bei dysembryoplastischen neuroepithelialen Tumoren (DNET) und Gangliogliomen (80–100%), gefolgt von Oligodendrogliomen (70–90%) und etwas seltener bei Glioblastomen (40–60%). Auch Hirnmetastasen können je nach Tumorentität und Lokalisation Anfälle auslösen.6–8 Die Einstellung der anfallssuppressiven Therapie erfolgt individuell und zunächst als Monotherapie. Es sollten neue, gut verträgliche und nicht enzyminduzierende Medikamente verabreicht werden. Die Tumorresektion (kombiniert mit Chemo-±Strahlentherapie) ist ebenso ein wichtiger Grundpfeiler der Therapie. Eine anfallssuppressive Medikation sollte jedenfalls nicht prophylaktisch verabreicht werden, betonte Grisold.6–8
Auch neue Tumortherapien (z.B. Immuncheckpoint-Inhibitoren, VEGF-Inhibitorenund CAR-T-Zellen) können neurologische Nebenwirkungen verursachen und müssen als Differenzialdiagnose in Betracht gezogen werden.
Hirnmetastasen systemisch behandeln – geht das?
Ob und wie Hirnmetastasen mit Medikamenten behandelt werden können, erläuterte Assoc. Prof. Priv.-Doz. Dr. Rupert Bartsch, Universitätsklinik für Innere Medizin I, Klinische Abteilung für Onkologie, MedUni Wien/AKH Wien. Er betonte, dass systemische Therapien keinesfalls lokale Maßnahmen wie die Neurochirurgie oder fokale Bestrahlungen ersetzen, neue Medikamente jedoch eine Ganzhirnbestrahlung vermeiden helfen oder hinauszögern.
Der Erfolg einer medikamentösen Therapie hängt von der Tumorbiologie ab. So erreicht bei Hirnmetastasen des HER2-positiven Mammakarzinoms die Zugabe des Tyrosinkinase-Inhibitors (TKI) Tucatinib zu Trastuzumab/Capecitabin intrakranielle Responseraten von rund 47% (vs. Placebo 20%).9 Hirnmetastasen von HER2-negativen Mammakarzinomen sprechen laut Bartsch dagegen deutlich schlechter auf systemische Therapien an. Sehr gute Ansprechraten erreicht Osimertinib bei Hirnmetastasen von Lungenkarzinomen mit EGFR-Mutation, da der TKI die Blut-Hirn-Schranke passieren kann.10
Vielversprechend sind auch Daten zu den neuen Antikörper-Wirkstoff-Konjugaten (ADC) wie Trastuzumab Deruxtecan (T-DXd). Im Bereich der Hirnmetastasen selbst ist die Blut-Hirn-Schranke durch eine durchlässigere Blut-Tumor-Schranke ersetzt, weshalb auch große Moleküle relevante intrakranielle Aktivität mit Ansprechraten von bis zu 80% aufweisen können.11,12 Dies sei besser als das Ansprechen auf die Ganzhirnbestrahlung und stellt somit eine mögliche Alternative dar, sagte Bartsch. Allerdings mahnte er zur Vorsicht bei der Kombination von T-DXd mit Kortikosteroiden, da es hierbei zu schweren Verläufen einer interstitiellen Lungenerkrankung mit Ko-Infektionen durch opportunistische Keime kommen kann. Werden Hirnmetastasen zudem lokal bestrahlt, sollte zwischen ADC-Gabe und Bestrahlung ein Abstand von mindestens zwei Wochen eingehalten werden, da ansonsten das Risiko für Strahlennekrosen erhöht sei, betonte er.
Neurochirurgie für Biopsie und Tumorresektion
Assoz. Prof. Priv.-Doz. Dr. Georg Widhalm, Universitätsklinik für Neurochirurgie, MedUni Wien/AKH Wien, zeigte die Herausforderungen bei Operationen im Gehirn auf. Mit Nadelbiopsien („stereotaktische Biopsie“) kann durch Entnahme von Gewebeproben bei Tumoren eine histopathologische und molekulare Diagnose gestellt werden. Bei Resektionen kann zusätzlich zur histopathologischen und molekularen Diagnosesicherung eine Tumorentfernung erreicht werden. Bei der Tumorresektion im Gehirn sei das Ziel die maximal sichere Entfernung des Tumorgewebes unter Erhalt der Funktion des betroffenen Gehirnareals, betonte Widhalm. Und gerade dies sei eine Herausforderung, da Tumoren oft nahe an funktionellen Bahnen, etwa für Sprache oder Motorik, lägen und die Tumorgrenzen oft schlecht zu erkennen seien, sagte er. Daher kann es zu neurologischen Defiziten nach der Operation und auch zu inkompletten Tumorresektionen kommen. Bei der stereotaktischen Biopsie kann es laut Widhalm dazu kommen, dass nichtdiagnostisches Gewebe entnommen wird, wobei das entnommene Gewebe keine histologische/molekulare Diagnose zulässt. Dadurch kann ein erneuter Eingriff nötig sein.
An der Universitätsklinik für Neurochirurgie helfen modernste Geräte, diese Herausforderungen zu meistern. So werden neben einem modernen OP-Mikroskop hochspezialisierte Navigationssysteme mit multimodalen Bilddaten, zum Beispiel MRT,PET, Magnetresonanzspektroskopie (MRS), funktionelle MRT und „diffusion tensor imaging“ (DTI) eingesetzt. Im Rahmen einer Wach-OP ist zudem die Sprachtestung ein etabliertes Verfahren, um das Risiko von neurologischen Defiziten nach der Operation wie einer Sprachstörung zu minimieren. Eine weitere Option sind fluoreszenzgeführte Eingriffe mit dem Fluoreszenzmarker 5-ALA zum verbesserten Erkennen von Tumorgewebe. Daneben ist an der Universitätsklinik für Neurochirurgie als eines von wenigen Zentren in Österreich ein intraoperatives MRT verfügbar, das Resttumorgewebe noch während der Operation erkennen kann. Neuerdings unterstützt ein neuartiges KI-basiertes System während der Operation beim raschen Erkennen von Tumorgewebe und der Tumorgrenze innerhalb von wenigen Minuten. Im Rahmen von Forschungsprojekten konnte sogar eine rasche histologische und molekulare Klassifikation von Tumoren mittels KI gezeigt werden.
Strahlentherapie bei primären Hirntumoren
Apl. Prof. Priv.-Doz. Dr. Franziska Eckert, Universitätsklinik für Radioonkologie, MedUni Wien/AKH Wien, ging auf die Strahlentherapie zur Behandlung von Hirntumoren ein. Dabei handle es sich immer um multimodale Konzepte, die interdisziplinär abgesprochen werden, sagte sie und nannte als Beispiel die Behandlung des Glioblastoms: Hier erfolgt zuerst die Operation, dann eine sechswöchige Strahlen- ± Chemotherapie und anschließend eine alleinige Chemotherapie. Zwischen den einzelnen Behandlungsschritten ist immer wieder eine Bildgebung notwendig, um den Verlauf zu dokumentieren.
Das Glioblastom zählt auch zu den Hauptindikationen für eine Bestrahlung. Diese kann entweder über sechs Wochen mit 60 Gray (Gy) in 30 Fraktionen oder bei älteren Menschen bzw. bei reduziertem Allgemeinzustand über drei Wochen mit reduzierter Intensität in 15 Fraktionen erfolgen. Dabei müsse die genaue Strahlendosis individuell bestimmt werden, betonte Eckert. Weitere Indikationen sind IDH-mutierte Tumoren in Risikokonstellationen (eindeutiger Grad 3, großer Resttumor, eloquente Lage), seltene Entitäten wie Medulloblastome oder Ependymome sowie die Rebestrahlung bei lokalem Tumorprogress, sofern dieser mehr als sechs Monate nach der Erstbestrahlung auftritt. Bei kürzeren Intervallen sei eine Rebestrahlung wenig sinnvoll, da man davon ausgehen müsse, dass der Tumor nicht auf die Therapie angesprochen habe und eine weitere Bestrahlung keine Vorteile bringe, erklärte Eckert. Eine Rebestrahlung wird immer mit deutlich reduziertem Volumen und reduzierter Dosis vorgenommen, da ein erhöhtes Risiko für Nebenwirkungen besteht.
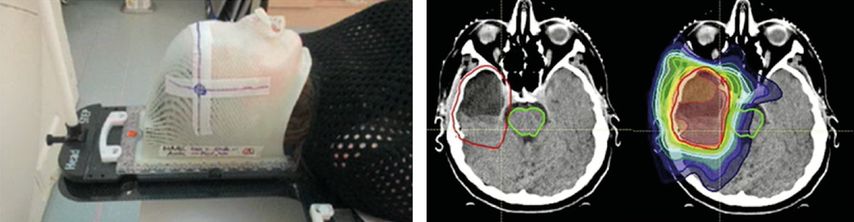
Auch bei der Strahlentherapie ermöglichen technische Neuerungen eine bessere Versorgung der Patient:innen: Um immer millimetergenau die gleiche Stelle zu bestrahlen, ist es nötig, den Kopf zu immobilisieren. Hierzu werden individuelle Masken angefertigt (Abb. 2, links) und der Tisch wird über bildgeführte Einstellungen stets exakt gleich positioniert.
Für komplex geformte Tumoren oder solche in der Nähe von Risikostrukturen empfiehlt sich die intensitätsmodulierte Radiotherapie (IMRT) oder die „volumetric intensity modulated arc therapy“ (VMAT). Mit diesen Verfahren kann die Intensität der Strahlung innerhalb des Bestrahlungsfelds variiert werden. So können bestimmte Bereiche stärker, andere schwächer bestrahlt werden, ohne dass gesundes Gewebe in Mitleidenschaft gezogen wird (Abb.2, rechts).
Abb. 2: Links: Individuell angepasste Masken fixieren den Kopf und ermöglichen in jeder Sitzung stets die punktgenaue Bestrahlung. Rechts: Bei der intensitätsmodulierten Radiotherapie kann die Intensität der Strahlung innerhalb des Bestrahlungsfelds variiert werden
Radiochirurgie mit dem Gamma-Knife
Dr. Brigitte Gatterbauer, Universitätsklinik für Neurochirurgie, MedUni Wien/AKH Wien, erläuterte, wie die Radiochirurgie mit dem Gamma-Knife die Therapie von Hirntumoren/-metastasen verbessert hat. Das Verfahren erlaubt eine sehr präzise Hochdosisbestrahlung intrakranieller Läsionen. Vorteile gegenüber der Chirurgie sind laut Gatterbauer, dass kein langer stationärer Aufenthalt nötig ist und die Rekonvaleszenz kurz ist. Patient:innen würden für zwei Tage und eine Nacht stationär aufgenommen und dürften wenige Stunden nach der Behandlung wieder nach Hause, erklärte sie.
Hauptindikation für das Gamma-Knife sind Hirnmetastasen, aber auch beninge Tumoren wie Meningeome und Schwannome. Es kann aber auch bei zahlreichen anderen intrakraniellen Veränderungen eingesetzt werden, unter anderem bei vaskulären Pathologien, Trigeminusneuralgie und funktionellen Störungen. In der Therapie von Hirnmetastasen ist es vor allem etabliert bei singulären und Oligometastasen, selbst wenn diese sehr tief sitzen und nicht resezierbar sind, sowie bei Kontraindikationen gegen einen operativen Eingriff.13 Auch bei Rezidiven nach Ganzhirnbestrahlung und strahlenresistenten Metastasen ist es bewährt.14,15
Inzwischen könnten sogar multiple Hirnmetastasen mit dem Gamma-Knife in Kombination mit Immuntherapien behandelt werden, denn in hohen Dosen verursache die Radiochirurgie direkte Gefäßschäden, die Apoptose von Endothelien und Zerstörung von Tumorzellen, so Gatterbauer. Dies führe einerseits dazu, dass die Blut-Hirn-Schranke im Bestrahlungsgebiet geöffnet wird. Andererseits ändere sich die Tumormikroumgebung, es würden Entzündungen ausgelöst und die lokale Immunantwort stimuliert. Die Folge sei eine gesteigerte Wirksamkeit der Immuntherapie, sagte sie.
Ganz ohne Komplikationen und Nebenwirkungen sei aber auch das Gamma-Knife nicht, erklärte die Expertin. Akut (1–4 Tage) können Übelkeit, transiente neurologische Symptome und Anfälle auftreten. Subakut (1–6 Monate) kann es zu Hirnödemen, neurologischen Beschwerden und Anfällen kommen. Als chronische Nebenwirkungen (>6 Monate) werden Strahlenreaktionen/-nekrosen, Zysten und neurologische Symptome beschrieben.16,17 Laut Gatterbauer können postradiogene Symptome mit Dexamethason und bei Nichtansprechen mit Bevacizumab reduziert werden.
Chemotherapie und zielgerichtete Therapien bei Gliomen
Assoc. Prof. Priv.-Doz. Dr. Dr. Anna Berghoff, Universitätsklinik f. Innere Medizin I, Klinische Abteilung für Onkologie, MedUni Wien/AKH Wien, befasste sich mit der Radio-Chemo- sowie der zielgerichteten Therapie von Gliomen. Auch sie betonte, wie wichtig es ist, Patient:innen in spezialisierten Zentren zu behandeln. „Für jeden Gliompatienten ist eine Studie die beste Therapie“, sagte sie.
Derzeit wird spätestens sechs Wochen nach der Tumorresektion mit einer kombinierten Radio-Chemotherapie mit Temozolomid begonnen. Nach deren Ende und einer Pause von vier Wochen folgen weitere sechs Zyklen Temozolomid – jeweils an fünf Tagen pro Monat, die übrige Zeit ist „therapiefrei“.18 Der Vorteil von Temozolomid ist, dass es oral eingenommen wird und weniger Übelkeit und Haarausfall auslöst als i.v. verabreichte Chemotherapeutika. Die Patient:innen berichten vorwiegend über starke Müdigkeit, die aber sehrgelindert werden könne, wenn das Medikament abends eingenommen werde, so Berghoff. Für die Behauptung, dass es morgens eine bessere Wirkung habe als abends gebe es keine Evidenz, betonte sie. Wichtig sei ein monatliches Blutbild, da Temozolomid (behandlungsbedürftige) Thrombo- und Lymphopenien verursachen könne. Letztere können spezifisch zu einer Infektion mit Pneumocystis carinii führen, sagte Berghoff.
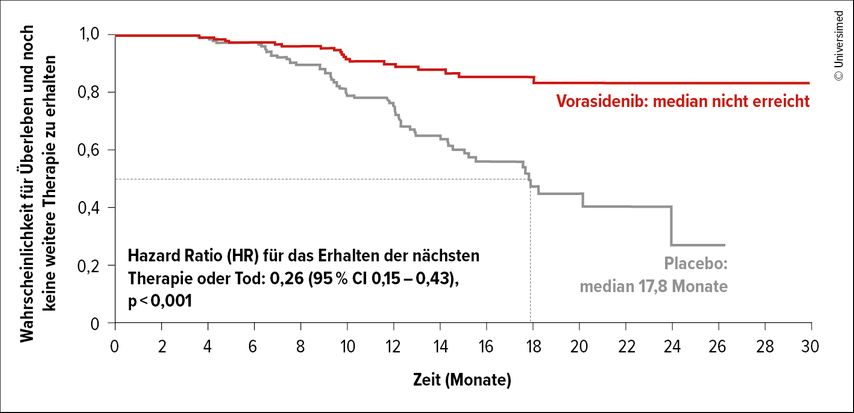
Einen besonderen Fokus legte die Onkologin auf die IDH-mutierten Gliome (Astrozytome, Oligodendrogliome). Das Besondere an diesen Tumoren sei, dass die Betroffenen meist sehr lange überleben – oft mehr als zehn bis fast 20 Jahre, sagte Berghoff. Das mediane Erkrankungsalter liegt bei 30 bis 40 Jahren. Daher müssen die Langzeitnebenwirkungen der Therapie berücksichtigt werden. Mit dieser Fragestellung befasste sich die INDIGO-Studie.19 Untersucht wurde, ob die Strahlen-Chemotherapie bei diesen Tumoren hinausgezögert werden kann. Dazu wurde Vorasidenib, ein oraler, hirngängiger Inhibitor der mutierten IDH1- und IDH2-Enzymen mit Placebo verglichen. Eingeschlossen waren Patient:innen mit IDH-mutierten Astrozytomen oder Oligodendrogliomen, die abgesehen von der Operation keine vorangegangene Therapie erhalten hatten. Vorasidenib verlängerte nicht nur das progressionsfreie Überleben signifikant (27,7 vs. 11,1 Monate; p<0,001), sondern auch die Zeit bis zur nächsten Therapie: Während diese in der Placebogruppe bei median 17,8 Monaten lag, wurde der Median in der Vorasidenib-Gruppe noch nicht erreicht (Abb. 3).19 Darüber hinaus sei die Therapie gut verträglich und ermögliche den Patient:innen ein vollkommen normales Leben, schloss die Onkologin.
Abb. 3: Vorasidenib verlängerte in der INDIGO-Studie die Zeit bis zur nächsten Therapie signifikant (modifiziert nach Mellinghoff IK)19
ZNS-Tumoren bei Kindern häufig
Während Hirntumoren bei Erwachsenen selten sind, gehören sie bei Kindern und Jugendlichen zu den häufigsten Krebsarten. Dies war Thema von Prof. DDr. Johannes Gojo, Abteilung für Neonatologie, Pädiatrische Intensivmedizin und Neuropädiatrie an der Universitätsklinik für Kinder- und Jugendheilkunde, MedUni Wien/AKH Wien.
Zumindest 10% dieser Tumoren entstehen aufgrund von Prädispositionen.20 Der Tumortyp sei abhängig vom Alter des Kindes und der Gehirnentwicklung, sagte Gojo. Die Therapiebausteine sind die gleichen wie bei Erwachsenen (Resektion, Chemo-, Strahlen- und zielgerichtete Therapie), die Konzepte unterscheiden sich jedoch deutlich. Da bei Kindern noch eine lange Überlebenszeit zu erwarten sei – etwa 80% können geheilt werden –, müsse auf mögliche Spätfolgen geachtet werden, betonte er. Dazu zählen unter anderem Wachstumsstörungen, Hörverlust sowie kognitive Defizite wie Konzentrationsstörungen – und damit eine erhebliche Beeinträchtigung der Lebensqualität.21
Auch bei pädiatrischen ZNS-Tumoren ist das molekulare Tumorprofil entscheidend für die Wahl der Therapie. So können bei bereits bekannten Mutationen wie PIK3CA bei Erwachsenen erprobte Medikamente im Rahmen von Studien oder individualisierten Heilversuchen eingesetzt werden, wobei die Dosierung herausfordernd sei.22 Für BRAFV600E-mutierte Tumoren ist die Kombination aus Dabrafenib und Trametinib bereits für Kinder zugelassen.23 Die Behandlung sollte unbedingt an einem spezialisierten Zentrum erfolgen, betonte Gojo.
Onkologische Rehabilitation für die Teilhabe am Leben
Nicht nur eine Krebserkrankung selbst, auch die Therapie führt zu körperlichen und psychischen Beeinträchtigungen. Daher sollte sich immer eine Rehabilitationsmaßnahme anschließen, wie Ao. Univ.-Prof. Dr. Richard Crevenna, MMSc, MBA, Universitätsklinik für Physikalische Medizin, Rehabilitation und Arbeitsmedizin, MedUni Wien/AKH Wien, in seinem Vortrag betonte.
Das Ziel der Rehabilitation sei es, die soziale und berufliche Teilhabe wiederherzustellen. Davon könnten alle Patient:innen profitieren, ganz besonders solche mit Hirntumoren, sagte Crevenna.24 Die Rehabilitation ist ein inter- und multidisziplinäres Konzept und umfasst Edukation/Empowerment der Betroffenen, Diätologie/Ernährungstherapie, physikalische Medizin und mentale Gesundheit/psychische Therapien. Dabei sei ein wesentlicher Faktor die Bewegung: Mobilisierung und Verbesserung der Beweglichkeit, Training der Grob- und Feinmotorik sowie körperliche Aktivität und Sport, erklärte Crevenna.
Alle Maßnahmen könnten jedoch auch in Form einer Prähabilitation bereits ab der Diagnosestellung eingeleitet werden, sagte er. Dies verbessere in der Regel das Outcome der Krebstherapie, da die Patient:innen bei deren Beginn fitter seien.25 Das Problem ist laut Crevenna allerdings der Mangel an therapeutischen Kapazitäten, die unbedingt ausgebaut werden müssten, um die Patient:innen angemessen betreuen zu können.
Mit diesem Appell rundete Crevenna den gelungenen Fortbildungsabend des CCC ab.
Quelle:
Cancer Update CCC Vienna: Tumoren des Zentralnervensystems, 19. November 2024 (hybrid)
Literatur:
1 WHO-Klassifikation 5th Ed., ISBN-13: 978-92-832-4508- 7 2 Price M et al.: Neuro Oncol 2024; 26(Suppl_6): vi1-85 3 Avila EK et al.: Neuro Oncol 2024; 26(1): 7-24 4 Roth P et al.: Ann Oncol 2021; 32(2): 171-82 5 Ospina JP, Wen Y: Curr Opin Neurol 2024; 37(6): 657-65 6 Chen DY et al.: J Neurooncol 2018; 139(1): 13-21 7 Seidel S et al.: Neurol Res Pract 2022; 4(1): 45 8 Stefan H et al.: Seizure 2024: S1059-1311(24)00161-4 9 Lin NU et al.: J Clin Oncol 2020; 38(23): 2610-9 10 Varrone A et al.: J Cereb Blood Flow Metab 2020; 40(4): 799-807 11 Bartsch R et al.: Nat Med 2022; 28(9): 1840-7 12 Harbeck N et al.: Nat Med 2024; 30(12): 3717-27 13 S2k-Leitlinie Hirnmetastasen und Meningeosis neoplastica. AWMF-Registernummer 030/060. Stand 2014, derzeit in Überarbeitung 14 Skeie BS et al.: World Neurosurg 2013; 79(3-4): 525-36 15 Pagnini PG: World Neurosurg 2013; 79(3-4): 437-9 16 Minniti G et al.: Radiat Oncol 2011; 6: 48 17 Chin LS et al.: J Neurosurg 2001; 94(6): 899-904 18 Preusser M et al.: Ann Neurol 2011; 70(1): 9-21 19 Mellinghoff IK et al.: N Engl J Med 2023; 389(7): 589-601 20 Ostrom QT et al.: Neuro Oncol 2022; 24(Suppl 3): iii1-38 21 Pancaldi A et al.: Children (Basel) 2023; 10(3): 472 22 Gojo J et al.: Front Oncol 2020; 9: 1436 23 www.ema.europa.eu/en/medicines/human/EPAR/finlee + www.ema.europa.eu/en/medicines/human/EPAR/spexotras 24 Giovanazzi S et al.: Neurooncol Pract 2024; 11(6): 803-12 25 Crevenna R et al.: Memo 2021; 14: 39-43
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...