Chemotherapie vs. Chirurgie beim Pankreaskarzinom
Autor:
Dr. Patrick Kirchweger
Assistenzarzt für Chirurgie
Ordensklinikum Linz
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Detektion von ctDNA (zirkulierender Tumor-DNA) erlaubt die minimal invasive Erfassung der aktuellen systemischen Gesamttumorlast in Echtzeit. Prätherapeutische ctDNA-Präsenz ist unabhängig vom Primärtumorvolumen und zeigt Disseminierung oder fortgeschrittene Erkrankung mit hohem Rezidivrisiko an. Somit könnte in Zukunft ein einfacher und kostengünstiger Bluttest maßgeblich zum Therapieentscheid Chemotherapie vs. Chirurgie beitragen.
Im Blut zirkulierende tumorspezifische DNA (ctDNA) spiegelt die aktuelle systemische Gesamttumorlast in Echtzeit wider und wird mittels einfacher Blutabnahme gewonnen.
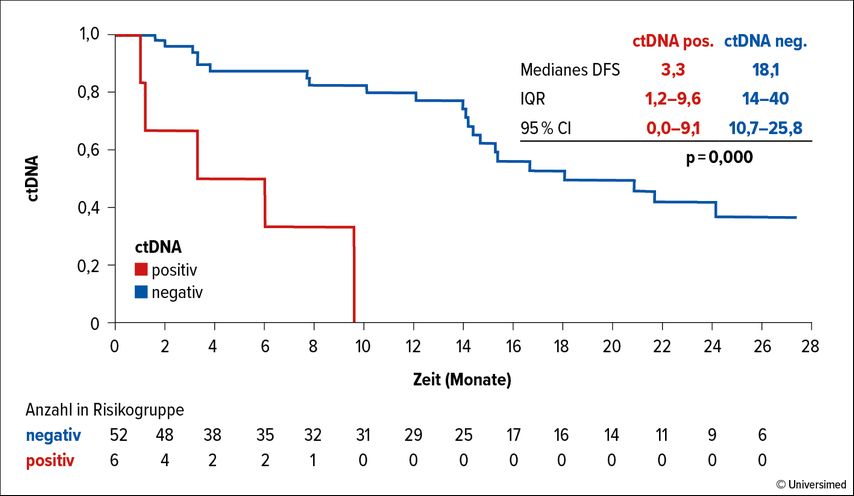
Beim Pankreaskarzinom ist deren Nachweisbarkeit in der „liquid biopsy“ von signifikant negativ prognostischem Wert (krankheitsfreies Überleben [DFS] 3,3 vs. 18,1 Monate) und korreliert unabhängig vom Tumorstadium nicht mit dem Primärtumorvolumen, sondern mit der fortgeschrittenen Nodalpositivität und Disseminierung.
In Zukunft könnte prätherapeutische ctDNA-Bestimmung bei Patient:innen mit lokalisierter Erkrankung zum Therapieentscheid (Chemotherapie vs. chirurgische Exploration) beitragen, da die Präsenz von ctDNA in diesem Tumorstadium subklinische Metastasierung (im CT nicht nachweisbar, aber intraoperativ detektiert) oder lokal fortgeschrittene (Gefäß- und Mesopankreasinvasivität) Befunde mit hohem Frührezidivrisiko anzeigt.
Zirkulierende Tumor-DNA stellt einen vielversprechenden neuartigen Biomarker zur Diagnose, Prognoseeinschätzung und Therapieevaluierung in vielen Malignomen dar (unter anderem gastrointestinal, aber auch Brust, Lunge oder Haut). Theoretisch wäre das Pankreaskarzinom eine ideale Tumorentität für die Mutationssuche ohne die Notwendigkeit einer vorhergehenden Analyse einer Gewebeprobe („next-generation sequencing“, NGS), da im histologischen Präparat etwa 90% der Patient:innen eine KRAS-Mutation aufweisen (meist KRAS G12/13). In der „liquid biopsy“ finden sich je nach Tumorstadium und durchgeführter Analysenmethode jedoch deutlich geringere Detektionsraten (Stadium IV: 40–75%, Stadium I–III: 10–40%).
Das duktale Adenokarzinom des Pankreas (PDAC) ist mit einem nach wie vor sehr geringen 5-Jahres-Überleben und hohem Rezidivrisiko trotz kurativ intendierter Resektion vergesellschaftet. Ein valider prognostischer Marker zur Verbesserung der Schnittstelle von perioperativer Chemotherapie und dem optimalen Zeitpunkt für die chirurgische Resektion wäre von außerordentlich großer klinischer Bedeutung im kurativen Setting, zumal CA 19–9 ein nicht sehr verlässlicher Tumormarker ist (etwa 15% „non-secretors“, anfällig für Cholestase und Entzündung).
Methodik und Mutationsspektrum
Am Ordensklinikum Linz werden seit 2019 im Rahmen von Studien prospektiv prätherapeutische, posttherapeutische (und gelegentlich, mit Ziel der Therapieüberwachung der Chemotherapie, seriell alle zwei Wochen bis zum Restaging) Proben von Patient:innen mit Pankreaskarzinom, Kolorektalkarzinom und gastroösophagealem Karzinom gesammelt und in Kooperation mit dem hauseigenen Labor für molekulargenetische Diagnostik und dem Institut für Humangenetik der Medizinischen Universität Innsbruck auf Mutationen in der ctDNA analysiert. Dazu werden einfache Blutabnahmen von unter 30ml pro Messzeitpunkt verwendet, welche im Rahmen der klinischen Routine erfasst werden.
Die folgenden Ausführungen beschränken sich auf das Pankreaskarzinom: Hier werden die qPCR („real time quantitative PCR“) und die sensitivere ddPCR („digital droplet PCR“) mit Mutationstestung auf KRAS G12/13 und, wenn negativ, zusätzlich KRAS Q61 durchgeführt.
Dabei ergaben sich Detektionsraten von etwa 64% im metastasierten Stadium und anfangs 10% im lokalisierten Stadium, welche durch methodologische Verbesserungen auf 38,2% gesteigert werden konnten (vermehrter DNA-Einsatz, Verwendung spezieller Röhrchen mit DNA-Stabilisatoren als Puffer, äußerst kurze Lagerdauer bis zur Präparation etc.).
Hierzu ist, anders als beim Kolonkarzinom oder gastroösophagealen Karzinom, keine vorhergehende histologische und molekulargenetische Aufarbeitung des Primärtumors notwendig. Diese würde zwar die Möglichkeit eines „individual assay designing“ bieten (ggf. höhere Detektionsraten), ist aber derzeit nicht klinisch applikabel, da die Umsetzung von der Probengewinnung bis zum Testergebnis aus dem peripheren Blut bis zu etwa sechs Wochen dauern kann. Dies würde einen Therapieverzug in der Fragestellung Neoadjuvanz vs. primäre Operation bedeuten, der ethisch nicht vertretbar ist.
Seltenere Mutationen (z.B. CDKN2) und Mutationen mit vielen unterschiedlichen Targets (TP53) werden hier aus Kostengründen und dem relativ geringen Beitrag zur möglichen Detektionsrate (max. etwa 75% beim metastasierten Pankreaskarzinom mittels NGS) bewusst nicht analysiert. Die Kosten unserer Teststrategie sind überschaubar und betragen zwischen 150 und 250 Euro pro primär resektabler Patient:in.
Korrelation der ctDNA mit dem Tumorvolumen
Die ctDNA wurde bezüglich ihrer Korrelation mit dem Tumorvolumen und dessen Einfluss auf das Rezidivrisiko und das Gesamtüberleben analysiert (Tab. 1).
Tab. 1:Spearman-Korrelationen von cfDNA, ctDNA, CA19-9 und Tumorvolumensubsets (Gesamtvolumen, Primum, Leber, Lunge, Lymphknotenbeteiligung und andere) beim lokalisierten und metastasierten Pankreaskarzinom. Modifiziert nach Kirchweger P et al.
Beim lokalisierten Pankreaskarzinom (CT-radiologisch primär resektabel) korrelierte präoperative ctDNA-Positivität signifikant mit der Zahl an positiven lokoregionären Lymphknoten (p=0,030). Im metastasierten Stadium sehen wir Korrelationen mit dem Metastasenvolumen (p=0,026), insbesondere bei Metastasen der Leber (p=0,004).
Das Primumvolumen hingegen korrelierte weder im lokalisierten (p=0,573) noch im metastasierten (p=0,878) Stadium mit der Nachweisbarkeit (ctDNA-positiv) oder Höhe der ctDNA-Level (MAF [„minor allele frequency“] in %).
Prognostischer Einfluss der ctDNA beim Pankreaskarzinom
Patient:innen mit prätherapeutisch positiver ctDNA zeigten ein deutlich geringeres krankheitsfreies Überleben bei lokalisierter Erkrankung (DFS: 3,3 vs. 18,1 Monate; p<0,000).
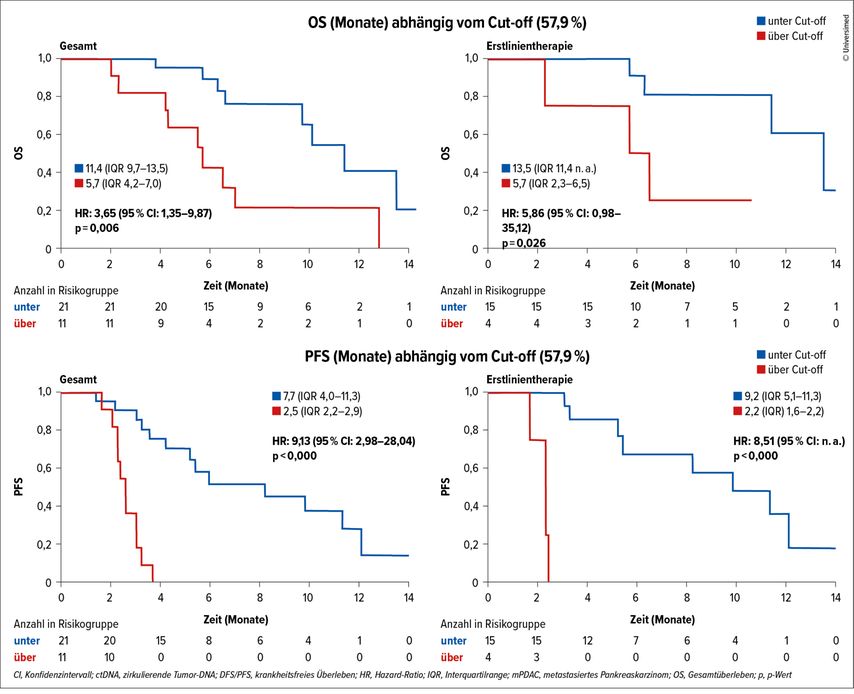
In der metastasierten Kohorte war ctDNA-Positivität mit einem schlechteren Gesamtüberleben assoziiert (OS: 5,7 vs. 7,8 Monate; p=0,036), die reine Präsenz der ctDNA über der Nachweisgrenze ist hier allerdings nicht von signifikant prognostischer Bedeutung für das DFS (da ctDNA bei einem Großteil der Patient:innen nachweisbar ist; hier ist ein Cut-off notwendig); wohl aber der ctDNA-Verlauf unter laufender Chemotherapie. Hier kann eine progressive Erkrankung bereits zwei Wochen nach Therapieinitiierung mit einer Spezifität von 100% und Sensitivität von 92% detektiert werden, wenn die ctDNA unter etwa 58% des Ausgangswertes sinkt (Abb. 1).
Abb. 1A: ctDNA-Nachweisbarkeit (prätherapeutisch positiv vs. negativ) hat einen signifikanten Einfluss auf das krankheitsfreie Überleben (DFS) beim lokalisierten Pankreaskarzinom (3,3 vs. 18,1 Monate; p<0,000)
Abb. 1B: Prognostischer Einfluss der ctDNA-Dynamik zum Cut-off von Absinken unter 58% des Ausgangswertes nach zwei Wochen Chemotherapie beim metastasierten Pankreaskarzinom (HR 9,13 für Gesamt-PFS und 2,2 vs. 9,2 Monate PFS für Chemotherapie-naive Patient:innen)
Abb. 1C: Im Stadium IV kann das Therapieansprechen unter Chemotherapie bereits nach zwei Wochen vorausgesagt werden (Spezifität 100%, Sensitivität 92%). Modifiziert nach Kirchweger P et al.
Conclusio
ctDNA ist unabhängig vom Primumvolumen, korreliert jedoch stark mit dem Metastasenvolumen (insbesondere der Leber) im metastasierten und im lokal fortgeschrittenen Lymphknotenstatus beim lokalisierten Pankreaskarzinom. Patient:innen mit lokalisiertem Pankreaskarzinom und nachweisbarer ctDNA haben ein signifikant erhöhtes Rezidivrisiko.
„Liquid biopsy“ beim lokalisierten Pankreaskarzinom könnte trotz vermeintlicher radiologischer Resektabilität subklinische Metastasierung bzw. lokal fortgeschrittene Stadien anzeigen. Zusätzlich eignet sich die ctDNA als früher Marker für Therapieansprechen einer Chemotherapie und könnte so zur Risikostratifizierung als Therapieentscheid (extendierte) neoadjuvante Chemotherapie vs. Exploration dienen.
Somit ist ctDNA ein vielversprechendes Tool, um in Zukunft in individualisierten Behandlungskonzepten von der rein radiologischen zur (molekular-)biologischen Resektabilität im Sinne der Präzisionsmedizin überzugehen.
Literatur:
● Kirchweger P et al.: Circulating tumor DNA correlates with tumor burden and predicts outcome in pancreatic cancer irrespective of tumor stage. Eur J Surg Oncol 2022; 48(5): 1046-53 ● Kirchweger P et al.: Prediction of response to systemic treatment by kinetics of circulating tumor DNA in metastatic pancreatic cancer. Front Oncol 2022; 12: 902177 ● Kirchweger P et al.: Circulating tumor DNA for diagnosis, prognosis and treatment of gastrointestinal malignancies. World J Clin Oncol 2022; 13(6): 473-84
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...