Chirurgie und neoadjuvante Konzepte bei HCC, CCA und Lebermetastasen des CRC
Autor:innen:
Prim. Univ.-Prof. Dr. Thomas Grünberger
Dr. Yawen Dong
Abteilung für Chirurgie und HPB-Zentrum
Klinik Favoriten
Gesundheitsverbund Wien
E-Mail: tgruenberger@icloud.com
E-Mail: yawen.dong@gesundheitsverbund.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auch der heurige ASCO-Kongress war wieder ein Highlight für onkologisch Interessierte, mit einer Reihe von praxisverändernden Ergebnissen, die unserer Meinung nach die SOP in den Tumorboards der soliden Tumoren deutlich verändern werden. In diesem Bericht beschränken wir uns auf jene Abstracts, die sich mit der chirurgischen Behandlung des lebermetastasierten Kolorektalkarzinoms (mCRC) beschäftigt haben und zu einem geänderten Vorgehen beim hepatozellulären Karzinom (HCC) bzw. beim Cholangiokarzinom (CCA) führen könnten.
Lebermetastasen beim mCRC: drei spannende Studien
René Adam berichtete über die 5-Jahres-Überlebensdaten der ersten randomisierten Studie, TRANSMET, die bei Patient:innen mit nicht resektablen Lebermetastasen des kolorektalen Karzinoms, welche unter Systemtherapie zumindest stabil waren, die Fortführung der Chemotherapie mit Lebertransplantation plus Fortführung der Chemotherapie verglich.1
-
Die randomisierten Patient:innen mussten zumindest drei Monate unter Systemtherapie stabil sein,
-
sie durften keine BRAF-Mutation haben,
-
das Primum musste reseziert sein und
-
es durften keine extrahepatalen Metastasen vorhanden sein.
Die initial randomisierten 94 Patient:innen hatten durchschnittlich 20 Lebermetastasen, 24% hatten eine RAS-Mutation und 15% hatten ein rechtsseitiges Primum. Die Patienten erhielten bis zu drei Therapielinien, wobei 35% eine Anti-VEGF(„vascular endothelial growth factor“)- und 59% eine Anti-EGFR(„epidermal growth factor receptor“)-Therapie erhielten. Von den zur Transplantation randomisierten Patient:innen wurden 77% transplantiert, bei 80% wurde die Systemtherapie fortgeführt.
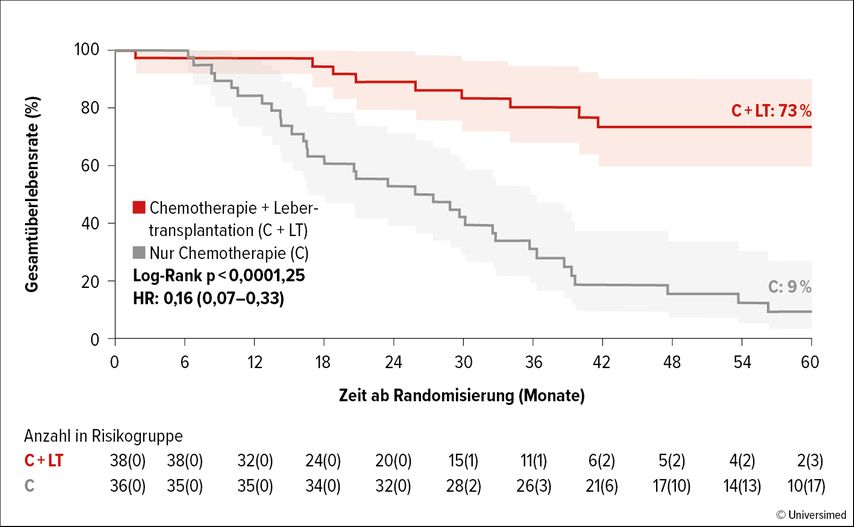
Der primäre Endpunkt, die 5-JahresÜberlebensrate, war in der transplantierten Gruppe mit 73% beeindruckend verlängert, verglichen mit 9% in der lediglich chemotherapierten Gruppe (HR: 0,16; p<0,0001; Abb. 1). 72% der transplantierten Patient:innen erlitten ein Rezidiv, durch weitere Chirurgie oder Thermoablation konnten jedoch 42% neuerlich tumorfrei werden (mit einer Rate von 5 Jahren rezidivfreiem Überleben von 36%). Die Autor:innen sehen somit die Lebertransplantation bei hoch selektionierten mCRC-Patient:innen als weitere Therapieoption an.
Abb. 1: 5-Jahres-Überlebensrate von Patient:innen mit mCRC und nichtresektablen Lebermetastasen, die im Rahmen der TRANSMET-Studie Chemotherapie + Lebertransplantation vs. nur Chemotherapie erhielten (modifiziert nach Adam R et al.)1
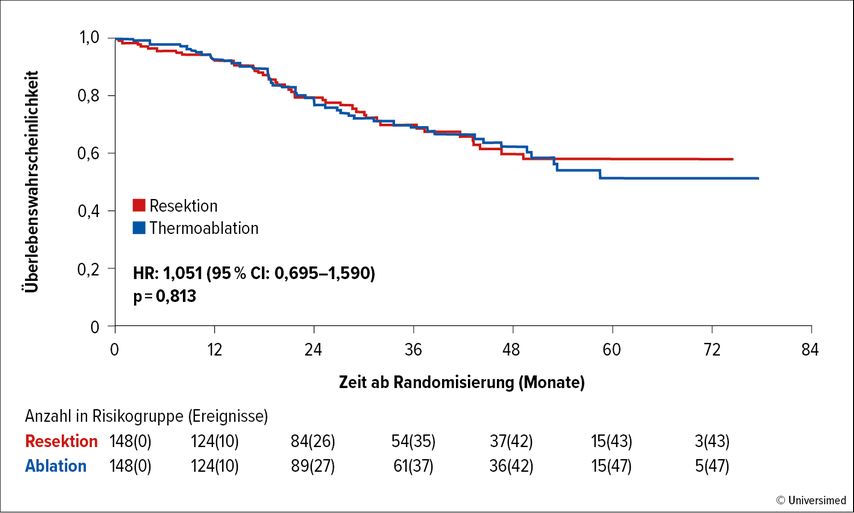
Gratulation einmal mehr an die Niederländer:innen, die es geschafft haben, die Frage der Effektivität einer Thermoablation verglichen mit der Resektion von kleinen Lebermetastasen des mCRC zu klären, und zwar im Rahmen der prospektiven Studie COLLISION.2 Trotz der im Studienprotokoll etwas hoch gegriffenen maximalen Anzahl an Metastasen mit 10 kleiner als maximal 3cm konnte in der Endauswertung mit median zwei Metastasen mit einem medianen Durchmesser von 14mm ein positives Ergebnis bezüglich der primären Endpunkte erzielt werden: Weder bezüglich des Gesamtüberlebens (OS; Abb. 2) noch bezüglich des progressionsfreien Überlebens (PFS) oder des Überlebens ohne hepatische Progression war ein Unterschied zwischen den beiden Gruppen zu identifizieren. Therapiebezogene Komplikationen waren mit 7% im Thermoablationsarm deutlich weniger häufig als im Chirurgiearm (20%).
Abb. 2: OS-Rate von Patient:innen mit mCRC und Lebermetastasen in der COLLISION-Studie: Thermoablation vs. Resektion (modifiziert nach Adam R et al.)1
Interessant ist bei solch einem Vergleich natürlich auch das Lokalrezidivrisiko, das mit ca. 15% in beiden Gruppen besonders für die Chirurgiegruppe hoch war und am ehesten mit der Tatsache erklärt werden kann, dass ein hoher Prozentsatz der Patient:innen im Chirurgiearm mit dem Roboter reseziert worden ist, wo doch die chirurgische Expertise generell noch limitiert ist. Nicht ganz unerwartet hingegen war die doch deutlich geringere Dauer der Hospitalisierung im Ablations- vs. den Chirurgiearm (p<0,001).
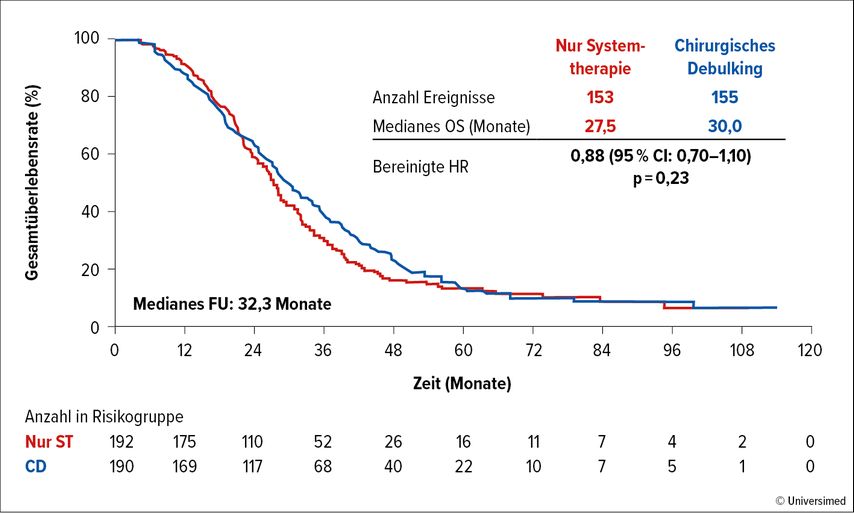
In der (ebenfalls niederländischen) Multicenter-Phase-III-Studie ORCHESTRA wurde untersucht, ob ein chirurgisches Debulking bei „Multiorgan“-mCRC einen Benefit gegenüber der alleinigen Systemtherapie bringt.3 Es wurden 382 Patient:innen randomisiert, wobei von den 190 in die Chirurgiegruppe randomisierten Patient:innen letztendlich nur 137 auch wirklich ein Tumordebulking erhielten. Der primäre Endpunkt, die Verlängerung des OS (Abb.3), konnte zwar numerisch, aber nicht statistisch signifikant erreicht werden, weshalb diese Studie als formal negativ zu beurteilen ist.
Abb. 3: OS-Rate von Patient:innen mit „Multiorgan“-mCRC in der ORCHESTRA-Studie: chirurgisches Debulking vs. alleinige Systemtherapie (modifiziert nach Gootjes EC et al.)3
Erstlinien-Immuntherapie statt TKI beim fortgeschrittenen HCC?
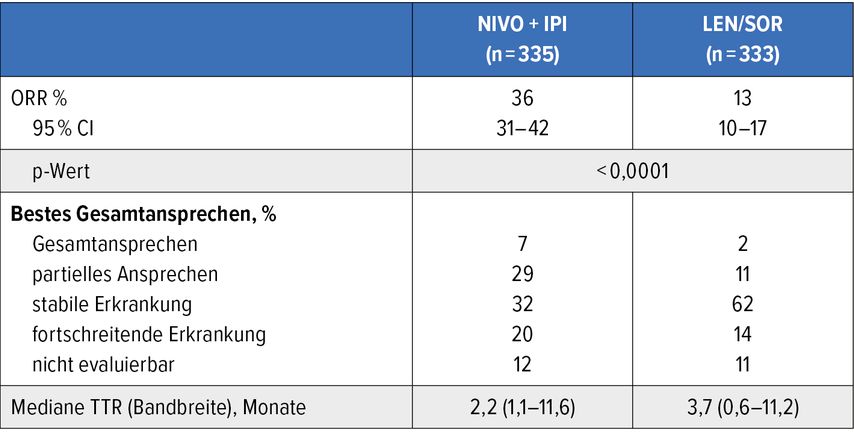
In der Phase-III-Studie Checkmate-9DW konnte die Kombinationstherapie aus Nivolumab und Ipilimumab nicht nur eine signifikante Überlebensverlängerung bei Patient:innen mit fortgeschrittenem HCC gegenüber den altbekannten Tyrosinkinase-Inhibitoren (Sorafenib bzw. Lenvatinib) erreichen, sondern interessanterweise sogar eine relevante und signifikant höhere Ansprechrate von 36% erzielen (Tab. 1).4 Dies ist vor allem bei Patient:innen wichtig zu berücksichtigen, die ein Ansprechen benötigen, um zum Beispiel sekundär resektabel zu werden. Sie könnten schlussendlich eine Chance bekommen, tumorfrei zu werden.
Tab. 1:Ansprechrate und bestes Gesamtansprechen bei Patient:innen mit fortgeschrittenem HCC unter Nivolumab+Ipilimumab vs. Sorafenib bzw. Lenvatinib (modifiziert nach Galle PR et al.);4 TTR, „time to treatment response“
Stereotaktische Bestrahlung vs. nurSystemtherapie beim CCA
In einer britischen Phase-II-Studie zu Patient:innen mit CCA konnte die Zugabe der stereotaktischen Bestrahlung nach initialer Stabilisierung der Erkrankung unter Systemtherapie weder beim PFS noch beim OS einen Vorteil gegenüber der alleinigen Fortführung der Systemtherapie erzielen.5 Interessanterweise hatten in beiden Gruppen mehr als 80% der Patient:innen entweder perihiläre oder distale CCA, bei denen man weiß, dass die biliäre Sepsis das Haupthindernis für die kontinuierliche Gabe der Systemtherapie darstellt.
Fazit
Die Behandlung des mCRC wird deutlich individualisierter: Sowohl im neoadjuvanten wie im Induktionssetting als auch im adjuvanten Algorithmus sollte die Therapiezusammensetzung unbedingt einer erweiterten Analyse von Patient:innen- und Tumorcharakteristika angepasst werden. Die Behandlungssequenzen sind heute wesentlich vom Stadium bei Erstdiagnose und von der spezifischen Molekulargenetik abhängig. Inwieweit die Lebertransplantation wirklich eine relevante Therapieoption bei rein lebermetastasierten mCRC-Patient:innen werden wird, wird uns die Zeit zeigen, da meiner Erfahrung nach bislang nur sehr selektionierte Patient:innen für diese Option gefunden werden konnten.
Sehr erfreulich ist die Entwicklung der Behandlungsmöglichkeiten beim HCC, wo neben den beeindruckenden Ergebnissen mit Immuntherapeutika auch andere Therapiezusammensetzungen das Überleben unserer Patient:innen deutlich verlängern können (z.B. Immuntherapie + transarterielle Chemoembolisation, Daten nicht in diesem Artikel gezeigt). In der Therapie des CCA gibt es leider noch ein wenig Nachholbedarf verglichen mit der des HCC.
Von großer Bedeutung ist weiterhin die Diskussion jeder/jedes neu diagnostizierten Tumorpatientin/-patienten in einem spezialisierten multidisziplinären Meeting, um eine auf Patient:innen- und Tumorcharakteristika abgestimmte ideale Therapieabfolge zu definieren. Wichtig ist außerdem zu erwähnen, dass die Fälle dieser initial diskutierten Patient:innen nach zwei Monaten mit einer aktualisierten Bildgebung unbedingt neuerlich besprochen werden sollten.
Literatur:
1 Adam R et al.: J Clin Oncol 2024; Abstr. #3500 2Meijerink MR et al.: J Clin Oncol 2024; Abstr. #LBA3501 3 Gootjes EC et al.: J Clin Oncol 2024; Abstr. #LBA3502 4 Galle PR et al.: J Clin Oncol 2024; Abstr. #LBA4008 5 Hawkins MA et al.: J Clin Oncol 2024; Abstr. #4006
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...