Chronische myelomonozytäre Leukämie – was gibt es Neues?
Autor:
Prim. Univ.-Prof. Dr. med. Klaus Geissler
Vorstand der 5. Medizinischen Abteilung mit Onkologie
Klinik Hietzing, Wien
Professor für Hämatoonkologie
Sigmund Freud PrivatUniversität, Wien
E-Mail: klaus.geissler@wienkav.at
Neue Erkenntnisse zum Mutationsstatus bei der chronischen myelomonozytären Leukämie helfen nicht nur, ihre Pathophysiologie besser zu verstehen, sondern eröffnen auch zuvor unbekannte Therapieoptionen.
Keypoints
-
Die CMML ist eine klinisch, molekular und biologisch heterogene Neoplasie.
-
Es gibt zunehmend Bestrebungen, die Diagnose von myeloischen Neoplasien nur aus peripherem Blut zu machen.
-
Patienten, die einen niedrigen ART-Score haben, haben ein sehr geringes Risiko, eine AML zu erleben.
-
Auch bei der CMML wird der Ansatz einer zielgerichteten Therapie in zunehmendem Maße verfolgt.
Die chronische myelomonozytäre Leukämie (CMML) ist eine klonale Erkrankung der Hämatopoese. Sie ist charakterisiert durch überlappende Eigenschaften einer myeloproliferativen Neoplasie (MPN) und eines myelodysplastischen Syndroms (MDS). Die CMML zählt daher laut WHO-Klassifikation 2016 zu den myelodysplastischen/myeloproliferativen (MDS/MPN) Neoplasien.
Lange Zeit war die CMML nur wenig erforscht. Erst in den letzten Jahren haben sich einige Forschungsgruppen mit dieser Erkrankung beschäftigt und tiefere Einblicke in ihre Pathophysiologie ermöglicht. Derzeit ist die Behandlung der CMML im Wesentlichen auf den unspezifischen Einsatz von Hydroxyurea (HU) und hypomethylierenden Substanzen beschränkt.
Zuletzt wurden in der präklinischen Forschung zahlreiche molekulare Zielstrukturen entdeckt, die letztlich dazu führen werden, dass auch bei der CMML zielgerichtete Therapiekonzepte bei bestimmten molekularen Subgruppen eine immer größere Rolle spielen werden.
Pathophysiologie
Bekannt ist, dass die CMML eine klinisch, molekular und biologisch heterogene Neoplasie ist. TET2-Mutationen sind häufig die initialen klonalen Treiber der CMML. Es gibt eine enge Korrelation zwischen dem Wachstumfaktor-unabhängigen In-vitro-Wachstum myeloischer Kolonien und dem Vorliegen von RAS-Pfad-Mutationen. Die RAS-Pfad-Aktivierung ist ein zentraler pathophysiologischer Prozess für GM-CSF(Granulozyten-Monozyten-Kolonien-stimulierender Faktor)-Hypersensitivität, Myeloproliferation, Progression der Erkrankung und Transformation in eine akute myeloische Leukämie (AML).
Bisher schlecht untersucht ist allerdings die funktionelle Rolle unterschiedlicher Zellpopulationen bei CMML. Zur Beantwortung dieser Frage hilft die Einzelzellsequenzierung. Die Einzelzellsequenzierung erleichtert die molekulare und funktionelle Kartierung heterogener Zellpopulationen und verbessert dadurch das Verständnis physiologischer und pathophysiologischer Prozesse.
Die Gruppe rund um Eric Padron1 konnte mithilfe dieser neuen Technologie bei CMML innerhalb der frühen hämatopoetischen Zellen drei Zellkategorien unterscheiden. Ein transkriptionales und immunphänotypisches Mapping von CD34+ Progenitorzellen wurde bei insgesamt 45 Patienten durchgeführt. Mithilfe spezifischer Signaturen war es möglich, Zellpopulationen mit einer monozytären Differenzierungsrichtung, Zellen mit einer megaerythroiden Differenzierungsrichtung und Zellen des normalen Progenitor- und Stammzellpools zu unterscheiden.
Patienten mit megaerythroider Differenzierung hatten statistisch höhere Hämoglobinwerte, während Fälle mit überwiegender monozytärer Differenzierung ein schlechteres Überleben, inflammatorische klinische Korrelate und RAS-Pfad-Mutationen aufwiesen. Interessanterweise war eine signifikante Depletion von hämatopoetischen Stammzellen bei Patienten mit monozytärer Differenzierungsrichtung am stärksten ausgeprägt.
In Übereinstimmung mit dieser Beobachtung konnten wir unlängst zeigen, dass CMML-Patienten, die noch kein myelomonozytäres Skewing in der In-vitro-Kultur zeigen, eine deutlich bessere Prognose haben als die meisten CMML-Patienten, bei denen ein solches Phänomen nachweisbar ist.2
Schlecht untersucht waren bisher auch die einzelnen Entwicklungsstufen einer CMML. Unlängst wurde im präklinischen Setting mithilfe der CRISPR/Cas-Technologie und induzierter pluripotenter Stammzellen ein Modell entwickelt, in dem die Multistufen-Pathogenese myeloischer Neoplasien in eindrucksvoller Weise rekapituliert werden konnte.3
Pluripotente Stammzellen, in die eine mutierte Komponente der epigenetischen Maschinerie eingeführt wurde, zeigten in diesem Modell einen Phänotyp im Sinne einer klonalen Hämatopoese von indeterminiertem Potenzial (CHIP). Wurde zusätzlich eine mutierte Spliceosomkomponente eingebaut, zeigte sich ein MDS-Phänotyp, und bei zusätzlicher Ausstattung mit einer mutierten NRAS-Veränderung entwickelte sich eine typische AML.
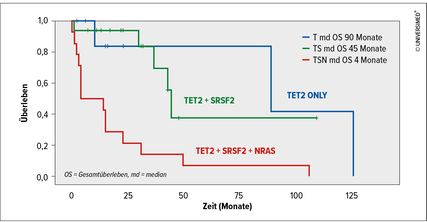
Abb. 1: Überlebensunterschiede zwischen drei Gruppen je nach Mutationsstatus. Modifiziert nach Geissler K et al. 20224
In dieser überzeugenden Art konnte dieser Effekt bei Patienten bisher nicht gezeigt werden. Wir haben uns daher die Frage gestellt, ob wir dieses Modell mithilfe von klinischen, phänotypischen, molekularen und biologischen Daten, die wir in unserer Austrian Biodatabase for CMML (ABCMML) gesammelt haben, bei CMML-Patienten validieren können.4
Unsere Analysen ergaben, dass die drei Gruppen klare Überlebensunterschiede aufweisen: mit 90 Monaten bei Patienten mit einer TET2-Monomutation, 45 Monaten mit einer TET2/SRSF2-Komutation und nur vier Monaten bei Patienten, die zusätzlich zur TET2/SRSF2- noch eine NRAS-Mutation aufwiesen (Abb. 1).
Diagnostik
Die bisherige Diagnostik der CMML stützt sich auf die WHO-Kriterien aus dem Jahr 2016. Betreffend Leukozytenzahl unterscheidet man eine MPN-CMML von einer MDS-CMML und trifft eine Unterscheidung bezüglich Blastzellanteil im Knochenmark (KM) und peripheren Blut (PB): CMML 0, 1 und 2. Die WHO-Kriterien verlangen also die Ermittlung des Blastzellanteils im KM. Die Befundung aus dem KM ist allerdings nicht unproblematisch.
Es gibt eine relativ hohe Variabilität zwischen einzelnen Untersuchern, vor allem auch durch die Einbeziehung von Promonozyten in den Blastzellanteil, und auch die unterschiedliche Blutverdünnung mit Blut ist vor allem bei der zytologischen Analyse ein Problem. Es gibt daher zunehmend Bestrebungen, eine Diagnose nur aus peripherem Blut zu machen. Hier scheint die Anwendung genoklinischer Entscheidungsmodelle bei Patienten mit myeloischen Neoplasien ein vielversprechender Weg zu sein.5 ROC-Analysen in dieser Studie zeigen, dass mit dieser Methode sehr gut Patienten mit MDS vs. CMML diskriminiert werden können.
Neu bei der Diagnostik der CMML ist auch das Auftauchen neuer Begriffe wie etwa jener der oligomonozytären CMML oder der CMML mit konkomitanten myeloischen Neoplasien, die MPN-Treiber-Mutationen besitzen, wie in einem Konsensuspaper kürzlich berichtet wurde.6 In diesem Zusammenhang haben wir auch das klinische Outcome von MPN-Patienten untersucht, die aber einen CMML-ähnlichen Phänotyp aufweisen. In dieser Untersuchung konnten wir zeigen, dass die Prognose dieser Patienten eindeutig vom CMML-Phänotyp determiniert wird.7
Prognose
Einzelparameter
Was die Prognose betrifft, so ist bekannt, dass es eine Reihe von Einzelparametern gibt, die eine prognostische Aussagekraft haben. Wir haben zeigen können, dass das spontane Wachstum myeloischer Kolonien unter diesen Parametern die höchste Aussagekraft hat.8 Wir führen diesen Sachverhalt darauf zurück, dass die Wachstumsfaktor-unabhängige Kolonienbildung ein eher globaler Test ist, der vermutlich mehrere prognostisch relevante Parameter erfasst, wie etwa die Konzentration unreifer Zellen und die GM-CSF-Hypersensitivität.
All diese Einzelparameter wurden bisher in unterschiedliche CMML-Risikoscores integriert. Die bisherigen Scores ermitteln vor allem die Überlebenswahrscheinlichkeit und das Risiko einer Transformation beim jeweiligen CMML-Patienten.
Der ART-Score
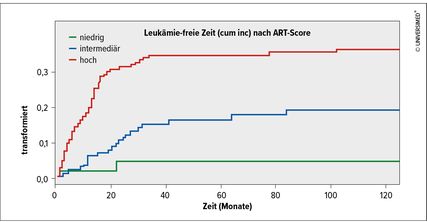
Abb. 2: Der Zusammenhang zwischen ART-Score und Auftreten einer AML. Modifiziert nach Machherndl-Spandl S et al. 20219
Wir haben vor Kurzem einen Score entwickelt, der uns nicht sagt, wie hoch beim betroffenen Patienten die Wahrscheinlichkeit ist, eine AML zu entwickeln, sondern, diese AML tatsächlich auch zu erleben.9 Dieser Score trägt den Namen ART-Score. Im ART-Score spielt das Alter des Patienten neben dem Blastzellanteil im peripheren Blut und der Thrombozytenzahl eine entscheidende Rolle (Tab. 1). Patienten, die einen niedrigen ART-Score haben, haben ein sehr geringes Risiko, eine AML zu erleben (Abb. 2). Es erscheint daher nicht gerechtfertigt, Patienten mit niedrigem Score mit epigenetischen Therapien zu behandeln, die das Ziel haben, die Entwicklung einer AML hinauszuzögern.
Komorbiditäten
Konsequenterweise stellt sich die Frage, woran CMML-Patienten versterben, die keine AML erleben. Auf der Suche nach Faktoren, an denen CMML-Patienten versterben, die nicht an einer AML leiden, haben wir uns mit der prognostischen Bedeutung von Komorbiditäten beschäftigt. Wir können zeigen, dass manche Komorbiditäten eine prognostische Rolle spielen, während andere bei CMML-Patienten offenbar irrelevant sind.
Zu den prognostisch relevanten zählt zum Beispiel die Einschränkung der Nierenfunktion. CMML-Patienten mit einem erhöhten Kreatinin-Wert haben eine kürzere Überlebenszeit als Patienten mit normaler Nierenfunktion.10 Da die Prothrombinzeit (PTZ) der wichtigste Parameter für die Leberfunktion ist, haben wird auch die prognostische Bedeutung der PTZ bei CMML-Patienten, die keine Antikoagulation hatten, untersucht. CMML-Patienten mit verminderter PTZ haben eine kürzere Überlebenszeit als Patienten mit normaler Leberfunktion.11
Auch der prognostische Einfluss einer akuten und chronischen Inflammation wurde in unseren Analysen untersucht. Das C-reaktive Protein (CRP) ist der am häufigsten verwendete Parameter für eine Akutphasereaktion. CMML-Patienten mit CRP-Werten über 10 haben ein kürzeres Überleben als Patienten mit CRP-Werten unter 10.12 Die relative Hypergammaglobulinämie ist hingegen ein gern verwendeter Parameter für chronische Inflammation. CMML-Patienten mit einer Hypergammaglobulinämie >20% haben eine kürzere Überlebenszeit als Patienten mit Gammagobulinwerten <20%.13
Aber nicht alle Parameter führen zu einer Verschlechterung des Outcomes. Interessanterweise haben CMML-Patienten mit einer kardiovaskulären Komorbidität keinen Überlebensnachteil.14
Therapie
Bis jetzt gibt es nur eine einzige randomisierte Studie, die eine Verbesserung des Outcomes bei CMML gebracht hat. In dieser Studie hat HU gegenüber VP16 bei Patienten mit CMML einen Überlebensvorteil gezeigt. Seit der Jahrtausendwende werden bei CMML-Patienten jedoch epigenetische Substanzen in vermehrtem Ausmaß eingesetzt. Daher wurden vor Kurzem Ergebnisse einer prospektiven randomisierten Studie präsentiert (DAKOTA-Trial), in der Decitabin vs. HU bei MPN-CMML-Patienten untersucht wurde.15 In dieser Studie konnte kein Vorteil von Decitabin gegenüber HU gezeigt werden.
In einer großen internationalen retrospektiven Studie wurde der therapeutische Stellenwert von Azacitidin (AZA) bei CMML-Patienten analysiert. Hier zeigten sich Unterschiede im Outcome zugunsten der mit AZA behandelten Patienten mit dem Caveat einer unkontrollierten Studie.16 Was man aber vermutlich sagen kann ist, dass von dieser Therapie am ehesten Patienten mit Myeloproliferation und erhöhtem Blastzellanteil profitieren dürften.
Wir haben ähnliche Analysen in der CMML-Kohorte unserer ABCMML durchgeführt und konnten bestätigen, dass auch bei uns Patienten mit AZA signifikant besser abschneiden.17 Da wir in unserer Datensammlung auch Patienten mit bekanntem molekularem Status haben, konnten wir darüber hinaus zeigen, dass RAS-Pfad-Aberrationen einen günstigen prädiktiven Parameter darstellen.
Molekulare Targets
Das Konzept der Präzisionsmedizin basiert auf der Erwartung, durch die Entdeckung pathophysiologischer Targets wirksamere und nebenwirkungsärmere Therapieformen entwickeln zu können. Auch bei der CMML wird dieser Ansatz in zunehmendem Maße verfolgt.
Eine Gruppe von der Mayo Clinic konnte unter Einbeziehung von Daten aus unserer ABCMML zeigen, dass NRAS-mutierte Patienten mit MPN-CMML eine erhöhte Expression von mitotischen Checkpointkinasen aufweisen, wie z.B. jene der PLK1.18 Da es mit Volasertib einen Hemmer dieser Kinase gibt, eröffnet sich dadurch ein völlig neues Therapiekonzept bei dieser Patientengruppe.
Ein anderer therapeutischer Ansatz könnte sich bei CMML-Patienten ergeben, die neben einer RAS-Mutation auch eine EZH2-Mutation tragen. Die Arbeitsgruppe um Armin Zebisch konnte zeigen, dass sich bei RAS-Pfad-Aktivierung und dem zusätzlichen Vorliegen einer EZH2-Mutation die Sensitivität des RAS-Signalweges gegenüber dem MEK-Inhibitor Mekinist steigert und so der Einsatz von Mekinist bei RAS-EZH2-doppeltmutierten Patienten besonders sinnvoll sein könnte.19
Literatur:
1 Dhawan A et al.: Blood 2021; 138 (Suppl 1): 319 2 Geissler K et al.: EJH 2021; 106: 627-33 3 Wang T et al.: Cell Stem Cell 2021; 28: 1074-89 4 Geissler K et al.: EJH 2022; 109: 50-7 5 Hilton CB et al.: Blood 2018; 132(Suppl 1): 1813 6 Valent P et al.: Haematologica 2019; 104: 1935-49 7 Heibl S et al.: Cancers 2020; 12: 1891 8 Geissler K et al.: IJMS 2020; 21: 6057 9 Machherndl-Spandl S et al.: EJH 2021; 107: 265-74 10 Heschl J, Geissler K: WMW 2022; im Druck 11 Weinfurtner C, Geissler K: WMW 2022; im Druck 12 Liang-Fonseca J, Geissler K: WMW 2022;im Druck 13 Zack MT, Geissler K: WMW 2022; im Druck 14 Lackner D, Geissler K: WMW 2022; im Druck 15 Itzykson R et al.: Blood 2020; 136(Suppl 1): 53-4 16 Pleyer L et al.: Lancet Hematol 2021; 8: e135-48 17 Reiser J,Geissler K: WMW 2022; im Druck 18 Carr RM et al.: Nat Commun 2021; 12: 2901 19 Berg JL et al.: Leukemia 2021; 35: 1521-6