Die intraduktale papillär-muzinöse Neoplasie – eine interdisziplinäre Aufgabe
Autoren:
Dr. Carl-Stephan Leonhardt
Prof. Dr. Klaus Sahora
Prof. Dr. Oliver Strobel
Klinische Abteilung für Viszeralchirurgie,Universitätsklinik für Allgemeinchirurgie
Medizinische Universität Wien
Korrespondenz:
Die intraduktale papillär-muzinöse Neoplasie (IPMN) gehört zu den zystischen, Muzin-produzierenden Läsionen des Pankreas. Erstmals beschrieben im Jahre 1982 von Ohashi, ist die IPMN die wichtigste zystische Vorläuferläsion des duktalen Adenokarzinoms des Pankreas (PDAC). Etwa bis zu 15% der PDAC entstehen auf dem Boden einer IPMN.1
Keypoints
-
Aufgrund der vermehrten Anwendung von Schnittbildgebungen in der Routinediagnostik bei gleichzeitig verbesserter Auflösung werden zystische Pankreasläsionen immer häufiger diagnostiziert, wobei die Gruppe der intraduktalen papillär-muzinösen Neoplasie (IPMN) die wichtigste zugrunde liegende Entität ist.
-
Als potenzielle Präkanzerose des Pankreaskarzinoms sind sie eine therapeutische Herausforderung.
-
Besteht in der Bildgebung ein begründeter Verdacht auf Malignität, ist die Therapie der Wahl die chirurgische Resektion. Analyse von Zystenflüssigkeit, Tumormarker und Klinik können den Verdacht erhärten.
-
Sollte eine Resektion erfolgen, ist eine regelmäßige Bildgebung mittels CT/MRT erforderlich, um ein Rezidiv bzw. eine maligne Transformation frühzeitig zu erkennen. Auch die nicht resezierte IPMN bedarf einer regelmäßigen Bildgebung.
-
Nach Resektion eines IPMN-Karzinoms erfolgt die Nachsorge kongruent zum Pankreaskarzinom.
Die Diagnose IPMN wird mit zunehmender Häufigkeit gestellt. U.a. ist dies auf die vermehrte Anwendung von Schnittbildgebungen zurückzuführen. Jedoch ist auch davon unabhängig über eine Zunahme der Inzidenz berichtet worden. Die Ursachen hierfür sind unklar.
Die Prävalenz von IPMN-Zysten bei Erwachsenen in einer europäischen Population betrug ca. 6,6%.2 Sowohl Schätzungen zur Inzidenz als auch Prävalenz variieren deutlich. Das durchschnittliche Alter zum Zeitpunkt der Diagnose beträgt ca. 65 Jahre mit einer annähernd ausgeglichenen Geschlechterverteilung.
Biologie der IPMN
In der Hämatoxylin-Eosin-Färbung zeigt sich eine intraduktale papilläre Proliferation von Muzin-produzierenden Epithelzellen. Molekulargenetisch ist das Mutationsspektrum ähnlich dem des PDAC. Ebenso scheint analog eine Adenom-zu-Karzinom-Sequenz zu existieren, mit KRAS- und GNAS-Mutationen in der Frühphase und TP53-Mutationen als spätes Ereignis.3
Anhand der Expression von Muzinen kann ein gastrischer Subtyp von einem intestinalen und einem pankreatobiliären Subtyp unterschieden werden. Erstgenannter ist der häufigste Subtyp, während der pankreatobiliäre Subtyp mit dem höchsten Malignitätsrisiko (bis zu 90%) assoziiert ist.4
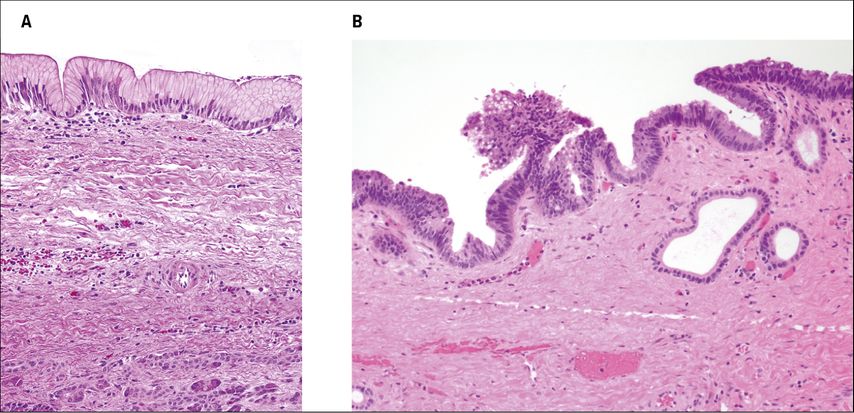
Gemäß der Ausprägung der Atypie lässt sich eine „Low grade“-Dysplasie von einer „High grade“-Dysplasie und dem invasiven Karzinom differenzieren (Abb. 1). Die Dauer der Transformation einer „Low grade“-Dysplasie in ein invasives Karzinom beträgt ca. 4–6 Jahre.5
Abb. 1: IPMN des gastrischen Subtyps mit „Low grade“-Dysplasie (A) sowie IPMN des intestinalen Subtyps mit „High grade“-Dysplasie (B)
In der Bildgebung und der makroskopischen Begutachtung kann ein Seitenasttyp („branch-duct IPMN“, BD-IPMN) von einem Hauptgangtyp („main-duct IPMN“, MD-IPMN) sowie einem gemischten Typ (MT-IPMN) differenziert werden.6 Während bei der BD-IPMN Pankreaszysten mit einem nicht dilatierten Hauptgang kommunizieren, zeichnet sich die MD-IPMN durch eine diffuse oder segmentale Dilatation des Hauptgangs über einen Durchmesser von ≥5mm aus, ohne dass eine alternative Ursache hierfür ersichtlich ist. Bei der MT-IPMN existieren Pankreaszysten zusammen mit einem dilatierten Hauptgang.
Diagnostik
Klinik
In der Regel sind IPMN asymptomatisch, nur in seltenen Fällen kommt es zu Symptomen wie Bauchschmerzen, Gewichtsverlust, Neuauftreten oder Exazerbation eines Diabetes mellitus, Episoden von Pankreatitiden sowie Ikterus.
Bildgebung und Endosonografie
Pankreaszysten über 10mm Durchmesser sollten mittels Computertomografie (CT) oder Magnetresonanztomografie (MRT)/Magnetresonanz-Cholangiopankreatikografie (MR-CP) weiter abgeklärt werden, wobei die MRT/MR-CP-Diagnostik eine höhere Sensitivität aufweist.7 Die meisten IPMN-Läsionen befinden sich im Pankreaskopf, nur in ca. 10–20% der Fälle handelt es sich um multifokale Erkrankungen.
Die Diagnose erfolgt bevorzugt mit MRT, ggf. mit MR-CP. Alternativ bietet sich die CT an. Die Endosonografie mit der Möglichkeit der Gewinnung von Zystenflüssigkeit ist lediglich eine Zweitliniendiagnostik. Die klassischen Tumormarker des Pankreaskarzinoms CA19-9 und CEA können bei IPMN die Differenzierung des Malignitätspotenzials unterstützen.8
Therapie
IPMN stellen eine therapeutische Herausforderung dar. Es gilt, das Potenzial einer malignen Transformation gegenüber dem Risiko einer potenziell unnötigen Operation mit relevanter Morbidität und Mortalität abzuwägen. Während die MD-IPMN und die MT-IPMN aufgrund ihres hohen Malignitätsrisikos immer operiert werden sollten, ist insbesondere die Behandlung der BD-IPMN komplex.7
Konsensus-Leitlinien der International Association of Pancreatology (IAP), der American Gastroenterological Association (AGA) sowie der European Study Group on Cystic Tumors of the Pancreas bieten eine Entscheidungshilfe (Tab. 1).9–11 In einer retrospektiven Studie war die AGA-Leitlinien am besten geeignet, unnötige Operationen zu vermeiden. Jedoch wurde für 12% der Patienten mit hochgradiger Dysplasie oder Malignität in der endgültigen Histologie keine OP-Indikation gestellt, während dies bei Anwendung der IAP- oder der europäischen Leitlinie bei keinem Patienten der Fall war.12
Eine kürzlich publizierte Arbeit konnte zeigen, dass viele IPMN zu früh oder zu spät operiert werden und dass mit den in den Leitlinien verwendeten Parametern keine sichere Detektion von Hochrisikoläsionen möglich ist.13
In ca. 60–92% der Fälle der resezierten MD- und MT-IPMN findet sich ein invasives Karzinom, während dies bei BD-IPMN nur in ca. 6–46% der Fall ist.14,15 Bei den IPMN-assoziierten Karzinomen lässt sich primär ein tubulärer von einem kolloidalen Subtyp unterscheiden. Der kolloidale Subtyp zeichnet sich durch Muzin-Produktion aus, während der tubuläre Subtyp dem klassischen PDAC entspricht. Neben den IPMN-assoziierten Karzinomen, welche sich aus einem IPMN entwickeln, können PDAC auch unabhängig von IPMN auftreten (PDAC mit begleitendem IPMN = „concomitant IPMN“).
Bei gegebener OP-Indikation bzw. V.a. auf Malignität sollte eine Pankreasresektion gemäß onkologischen Prinzipien mit Lymphadenektomie durchgeführt werden. Abhängig von der Lokalisation ist die Pankreaskopfresektion bzw. die Pankreaslinksresektion Mittel der Wahl. Bei der multifokalen IPMN muss die Option einer totalen Pankreatektomie evaluiert werden.
Die Enukleation kommt lediglich bei BD-IPMN mit einer präoperativ niedrigen Wahrscheinlichkeit einer Malignität zur Anwendung.16 Eine Schnellschnittuntersuchung ist bei Resektionen von IPMN obligat und erlaubt wichtige Hinweise darauf, ob die Resektion bis hin zu einer totalen Pankreatektomie erweitert werden muss.
Prognose und Nachsorge
Die Fünf-Jahres-Überlebensrate beim nicht invasiven IPMN beträgt bis zu 100%. Im Falle eines Karzinoms ist die Prognose der bei klassischem PDAC ähnlich, eine kumulativ scheinbar bessere Prognose ist v.a. auf eine frühere Diagnose zurückzuführen. Insbesondere ist die Prognose bei dem tubulären PDAC und dem klassischen PDAC vergleichbar bei Stratifizierung gemäß dem Tumorstadium.17 Die Rolle der adjuvanten Chemotherapie beim IPMN-Karzinom ist nicht endgültig geklärt.7,18
Die Empfehlungen zur Nachsorge nach kurativer Operation variieren. Im Falle eines IPMN-Karzinoms erfolgt die Nachsorge analog zum Pankreaskarzinom. Bei Resektion einer nicht invasiven IPMN sowie bei IPMN ohne OP-Indikation sollte die Nachsorge gemäß der European Study Group on Cystic Tumors of the Pancreas lebenslang durchgeführt werden. Die MRT ist die präferierte Modalität und sollte kombiniert werden mit CA-19-9-Messungen zweimal jährlich in den ersten 2 Jahren, anschließend mit jährlichen Messungen.7
Zusammenfassung
IPMN stellen eine zunehmende Herausforderung für den behandelnden Arzt dar. Die Abschätzung des Malignitätsrisikos ist trotz Konsensus-Leitlinien weiterhin schwierig. Nicht nur die Entscheidung für eine Resektion, sondern auch die Beobachtung sollte an erfahrenen Zentren erfolgen. Die Etablierung besserer Entscheidungskriterien wie neuer Biomarker zur Erkennung von noch nicht invasiven Hochrisikoläsionen ist ein wichtiges Forschungsthema.
Fortschritte bei der Modellierung von IPMN-Vorläuferläsionen als auch verbesserte diagnostische Möglichkeiten lassen in Zukunft auf eine individuell angepasste Empfehlung hoffen. Ein kürzlich entwickelter Assay zur besseren Risikoabschätzung stellt einen vielversprechenden Ansatz dar.19
Literatur:
1 Singhi AD, Maitra A: Pancreatic Cancer Ch. Chapter 5, 2018; 147-76 2 Laurent L et al.: United European Gastroenterol J 2017; 5(4): 499-503 3 Noe M et al.: Nat Commun 2020; 11(1): 4085 4 Distler M et al.: Ann Surg 2013; 258(2): 324-30 5 Marchegiani G et al.: Ann Surg 2015; 261(5): 976-83 6 Adsay V et al.: Ann Surg 2016; 263(1): 162-77 7 European Study Group on Cystic Tumours of the Pancreas: Gut 2018; 67(5): 789-804 8 Fritz S et al.:Br J Surg 2011; 98: 104-10 9 Tanaka M et al.: Pancreatology 2006; 6(1-2): 17-32 10 Tanaka M et al.: Pancreatology 2017; 17(5): 738-53 11 Vege SS et al.: Gastroenterology 2015; 148(4): 819-22 12 Lekkerkerker SJ et al.: Gastrointest Endosc 2017; 85(5): 1025-31 13 Tjaden C et al.: JAMA Surg 2021; 156(9): 818-25 14 Sahora K et al.: Surgery 2014; 156(3): 611-21 15 Sahora K et al.: Ann Surg 2013; 258(3): 466-75 16 Kaiser J et al.: Surgery 2017; 161(3) 602-10 17 Yopp AC et al.: Ann Surg 2011; 253(5): 968-74 18 Kaiser J et al.: Eur J Surg Oncol 2022; 48(6): 1309-20 19 Springer S et al.: Sci Transl Med 2019; 11(501): eaav4772
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...