Empfehlungen zur Prophylaxe und Therapie von tumorassoziierten Thrombosen
Autorin:
Dr. Katharina Gütl
Klinische Abteilung für Angiologie
Universitätsklinik für Innere Medizin
LKH Universitätsklinikum Graz
E-Mail: katharina.guetl@medunigraz.at
Venöse Thromboembolien (VTE) sind aufgrund der paraneoplastischen Hyperkoagulabilität häufige Komplikationen von Malignomerkrankungen. Das Ausmaß der Hyperkoagulabilität wird maßgeblich durch die Tumorentität bestimmt. Das höchste VTE-Risiko weisen Patient:innen mit Karzinomen im Bereich von Pankreas, Magen, Lunge und ZNS auf.1
Keypoints
-
Venöse Thromboembolien (VTE) sind häufige Komplikationen von Malignomerkrankungen.
-
Aufgrund der negativen Beeinflussung der Gesamtprognose wird der VTE-Primärprävention eine bedeutende Rolle zugeschrieben.
-
Die Therapieentscheidung über die Antikoagulation ist an die individuellen Patient:innengegebenheiten unter Berücksichtigung des Blutungsrisikos anzupassen; überwiegend werden niedermolekulare Heparine und orale Faktor-Xa-Inhibitoren eingesetzt.
-
Das hohe VTE-Rezidivrisiko rechtfertigt oftmals eine längerfristige Antikoagulation unter regelmäßiger Nutzen-Risiko-Abwägung.
Durch Vorhandensein additiver Risikofaktoren kann sich das Risiko für venöse Thromboembolien (VTE) individuell weiter erhöhen. Die Prognose der Krebserkrankung wird durch ein VTE-Ereignis schwerwiegend beeinträchtigt, sodass die Mortalität bei Malignompatient:innen mit VTE bis zu dreifach erhöht ist im Vergleich zu Malignompatient:innen ohne VTE.2
Die Komplexität in der Prophylaxe sowie auch der Therapie der tumorassoziierten VTE ergibt sich abgesehen vom hohen thromboembolischen Risiko insbesondere auch durch ein oftmals erhöhtes Blutungsrisiko, sodass die Entscheidung über die Blutverdünnung stets individuell getroffen werden muss. Die aktuelle ESMO-Leitlinie bietet übersichtliche und praktikable Empfehlungen zum Management der tumorassoziierten VTE.3
Allgemeine Primärprävention
In der Primärprävention gilt das Hauptziel einer konsequenten VTE-Prophylaxe bei Hochrisikopatient:innen. Zur Erhebung des individuellen Thromboserisikos und somit zur Identifizierung eines Hochrisikokollektivs werden validierte Modelle wie der Khorana-Score,4 der COMPAT-CAT-Score5 oder der Vienna-CATS-Score6 empfohlen.
Die Indikation zur medikamentösen VTE-Prophylaxe kann ab einem VTE-Risiko von 8–10% über sechs Monate diskutiert werden, entsprechend beispielsweise einem Khorana-Score von ≥2 Punkten. Bei ambulanten Patient:innen mit Start einer systemischen tumorspezifischen Therapie kann in diesem Fall eine Prophylaxe mit den oralen Faktor-Xa-Inhibitoren Apixaban 2,5mg zweimal täglich oder Rivaroxaban 10mg einmal täglich für eine Maximaldauer von sechs Monaten angedacht werden. Evidenz hierfür wird durch die AVERT7- sowie die CASSINI-Studie8dargeboten.
Bei Unsicherheit bezüglich der Anwendung dieser beiden direkten oralen Antikoagulanzien – zum Beispiel bei fraglich eingeschränkter Resorption durch Emesis oder bei Bedenken hinsichtlich eines Blutungsrisikos – kann stattdessen eine konventionelle Prophylaxe mit niedermolekularem Heparin (NMH) etabliert werden.
Bei ambulanten Patient:innen mit Pankreaskarzinom unter systemischer tumorspezifischer Erstlinientherapie kann aufgrund des hohen thromboembolischen Risikos die NMH-Applikation in einer intermediären Dosierung für eine Maximaldauer von drei Monaten evaluiert werden.
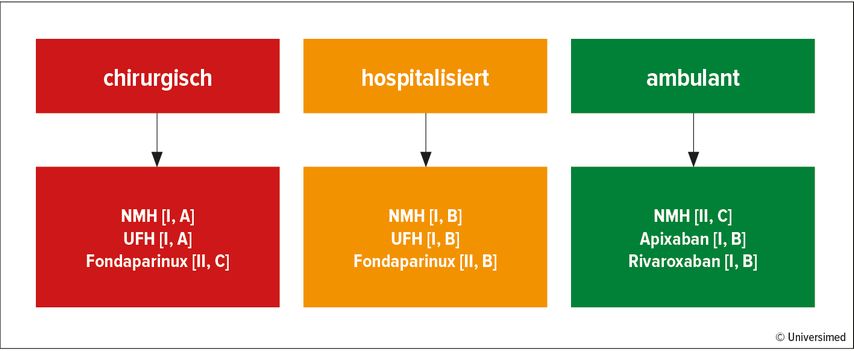
Bei Hospitalisierung von Malignompatient:innen aufgrund von Akuterkrankung ist eine medikamentöse Prophylaxe mit NMH, unfraktioniertem Heparin (UFH) oder dem synthetischen Pentasaccharid Fondaparinux empfohlen.
Spezifische Empfehlungen liefert die ESMO-Leitlinie für die Prophylaxe bei Patient:innen mit multiplen Myelomen, da insbesondere bei diesen Patient:innen das VTE-Risiko überwiegend durch die immunmodulatorischen Therapien bestimmt wird.
Primärprophylaxe im chirurgischen Setting
Im Umfeld großer tumorchirurgischer Eingriffe wird generell eine medikamentöse Thromboseprophylaxe mit Heparinen – vorzugsweise NMH – empfohlen; Fondaparinux kann in dieser Indikationsstellung als Alternative eingesetzt werden.
Bei Anwendung von Heparinen soll die Prophylaxe bereits bis zu zwölf Stunden präoperativ begonnen werden, wobei aufgrund der unterschiedlichen Halbwertszeiten (1–2 Stunden für UFH, 4–6 Stunden für NMH) der Abstand der Letztapplikation zur Operation bei NMH größer gewählt werden muss. Postoperativ wird grundsätzlich eine Prophylaxe für zumindest zehn Tage empfohlen.
Bei offenen Eingriffen am Abdomen und Becken sowie bei laparoskopischen Eingriffen kolorektal wird eine Prophylaxedauer von vier Wochen postoperativ empfohlen.
Mechanische Methoden umfassen die intermittierende pneumatische Kompression und/oder Kompressionsstrümpfe, sie werden aber grundsätzlich nur in Kombination mit einer medikamentösen Prophylaxe empfohlen.Die Prophylaxe isoliert mittels mechanischer Methoden hat ihren Stellenwert im Umfeld der Tumorchirurgie einzig bei bestehender Kontraindikation zur Antikoagulation.
Abbildung 1 bietet eine Übersicht über die ESMO-Empfehlungen zur medikamentösen VTE-Prophylaxe inklusive der Evidenzstufen und Empfehlungsgrade.
Therapie
Bei bestätigter VTE und zugrunde liegender maligner Grunderkrankung wird in der Akutphase der ersten fünf bis zehn Tage nach Diagnosestellung eine Antikoagulation mit NMH, UFH, Fondaparinux, Apixaban oder Rivaroxaban empfohlen.
Unter den parenteralen Antikoagulanzien sollte NMH im Vergleich zu UFH und Fondaparinux grundsätzlich der Vorzug gegeben werden. Der Einsatz von UFH ist insbesondere bei Patient:innen mit fortgeschrittener Nierenfunktionseinschränkung (GFR <30ml/min) zu erwägen.
In der Langzeittherapie bis sechs Monate nach VTE-Diagnosestellung sind sämtliche orale Faktor-Xa-Inhibitoren (Apixaban, Rivaroxaban, Edoxaban) sowie NMH empfohlen; für den direkten Thrombininhibitor Dabigatran gibt es aufgrund fehlender Daten zur Behandlung der tumorassoziierten VTE keinerlei Empfehlungen in der ESMO-Leitlinie.
Der Antikoagulation mittels NMH sollte insbesondere bei gastrointestinalen Tumoren sowie auch bei urothelialen Tumoren aufgrund des erhöhten Blutungsrisikos bei diesen Patient:innen und auch generell bei hohem Risiko für eine gastrointestinale Blutung (beispielsweise bei Vorliegen von aktiven gastroduodenalen Ulzera und/oder bei Einnahme von Inhibitoren/Induktoren von P-Glycoprotein und CYP3A4) Vorrang eingeräumt werden.
Die optimale Therapiedauer der tumorassoziierten Thrombose ist unklar, jedoch sollte ein Fortführen der Antikoagulation über sechs Monate nach Auftreten des VTE-Ereignisses hinaus bei aktiver maligner Grunderkrankung und einem damit assoziierten hohen VTE-Rezidivrisiko erwogen werden.
Abgesehen von NMH und den oralen Faktor-Xa-Inhibitoren ist hierbei auch eine alternative Antikoagulation mit Vitamin-K-Antagonisten (VKA) möglich. Zu beachten sind hier insbesondere auch die generellen Kontraindikationen zum Einsatz von direkten oralen Antikoagulanzien (tripelpositives Antiphospholipid-Antikörper-Syndrom, Nierenfunktionseinschränkung mit glomerulärer Filtrationsrate <15ml/min, Schwangerschaft/Stillzeit), welche mitunter die Entscheidung für eine Antikoagulation mittels VKA stützen können.
Aufgrund der limitierten Datenlage für die verlängerte Antikoagulation der tumorassoziierten Thrombose sind auch die Evidenzgrade für diese Empfehlungen abnehmend.Unter fortlaufender Antikoagulationstherapie ist eine regelmäßige Nutzen-Risiko-Abwägung durchzuführen.
Die ESMO-Empfehlungen zur Antikoagulationstherapie der paraneoplastischen VTE inklusive der Evidenzstufen und Empfehlungsgrade sind in Abbildung 2 dargestellt.
Hinsichtlich der oftmals bestehenden Unsicherheit bezüglich des Vorgehens bei inzidenteller VTE beziehungsweise bei VTE-Minimalereignissen wie der subsegmentalen PAE spricht sich die ESMO-Leitlinie an dieser Stelle für eine therapeutische Antikoagulation bei diesen Ereignissen aus, wobei aber eine restriktive Therapie im Sinne einer verkürzten Therapiedauer zum Beispiel bei hohem Blutungsrisiko dennoch als vertretbar gilt.
Unklarheit herrscht im klinischen Alltag gehäuft auch hinsichtlich der Indikation zur Implantation eines Filters in die Vena cava inferior. Diese Indikationsstellung wird durch die ESMO-Leitlinie – wie auch bereits durch viele vorausgegangene Leitlinien – sehr restriktiv gehandhabt. Der Filter wird als zusätzliche Therapiemaßnahme nur bei akuter und lebensbedrohlicher VTE mit absoluter Kontraindikation zur Antikoagulation sowie bei rezidivierender oder progredienter VTE trotz optimaler therapeutischer Antikoagulation empfohlen.
Sonderfall „katheterassoziierte Thrombose“
Zentralvenöse Katheter sind bei Malignompatient:innen oftmals zur Applikation von systemischen tumorspezifischen Therapien erforderlich, bergen aber ein erhöhtes Risiko für Thrombosen. In den meisten Fällen handelt es sich hierbei aufgrund der Lokalisation der Katheter um Armvenenthrombosen. Eine routinemäßige medikamentöse VTE-Prophylaxe ist dennoch auch bei diesen Patient:innen nicht erforderlich.
Im Falle des Auftretens einer katheterassoziierten Thrombose sind primär eine Antikoagulation mit NMH und eine Mindestantikoagulationsdauer von drei Monaten zu wählen. Der Katheter soll grundsätzlich zunächst sogar belassen werden, insbesondere da durch das (frühzeitige) Entfernen eine Verschleppung des Thrombusmaterials ausgelöst werden kann. Sollte der Katheter längerfristig im Körper verbleiben, so ist nach Auftreten einer katheterassoziierten Thrombose auch eine Antikoagulation über drei Monate hinaus anzustreben.
Die Indikation zur Entfernung ist hingegen gegeben bei Katheterinfektion, bei Kontraindikation zur Antikoagulation, bei Thrombuswachstum unter Antikoagulation sowie auch bei fehlendem Nutzen durch den Katheter.
Literatur:
1 Cohen AT et al.: Epidemiology of first and recurrent venous thromboembolism in patients with active cancer. Apopulation-based cohort study. Thromb Haemost 2017; 117(1): 57-65 2 Mulder FI et al.: Venous thromboembolism in cancer patients: a population-based cohort study. Blood 2021; 137(14): 1959-69 3 Falanga A et al.: Venous thromboembolism in cancer patients: ESMO Clinical Practice Guideline. Ann Oncol 2023;34(5): 452-67 4 Khorana AA et al.: Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood 2008; 111(10): 4902-7 5 Gerotziafas GT et al.: A predictive score for thrombosis associated with breast, colorectal, lung, or ovarian cancer: the prospective COMPASS-Cancer-Associated Thrombosis Study. Oncologist 2017; 22(10): 1222-31 6 Pabinger I et al.: A clinical prediction model for cancer-associated venous thromboembolism: adevelopment and validation study in two independent prospective cohorts. Lancet Haematol 2018; 5(7): e289-e98 7 Carrier M et al.: Apixaban to prevent venous thromboembolism in patients with cancer. N Engl J Med 2019; 380(8): 711-9 8 Khorana AA et al.: Rivaroxaban for thromboprophylaxis in high-risk ambulatory patients with cancer. N Engl J Med 2019; 380(8): 720-8
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...