Entwicklungen in der adjuvanten Radiotherapie beim frühen Mammakarzinom
Autor:
PD Dr. (A) Günther Gruber
Institut für Radiotherapie
Klinik Hirslanden, Zürich
E-Mail: guenther.gruber@hirslanden.ch
Die adjuvante perkutane Radiotherapie ist nach wie vor integraler Bestandteil im primären Behandlungskonzept beim lokalisierten Mammakarzinom. Mit der heutigen besseren Charakterisierung der Tumorerkrankung und des damit verbundenen Risikos ergeben sich Möglichkeiten, risikoadaptiert über eine Deeskalation und Eskalation auch in der Radiotherapie nachzudenken.
Die lokale Tumorkontrolle wird durch eine adjuvante Radiotherapie (RT) signifikant verbessert. Dies ist weitgehend unabhängig vom operativen Vorgehen und von Subgruppen (Reduktion des relativen Risikos um das ca. 3- bis 4-Fache).1 Die Reduktion des absoluten Risikos richtet sich aber nach dem Ausgangsrisiko und liegt in einer Niedrigrisikokonstellation je nach Beobachtungszeitraum im einstelligen Prozentbereich. Hinzu kommt, dass der Einfluss auf das Gesamtüberleben gerade in solchen Situationen nicht bewiesen ist bzw. in einem klinisch gesehen wohl vernachlässigbaren Bereich liegen dürfte.
Keine Wirkung ohne Nebenwirkung: In der Akutphase kommen Reaktionen – einer lokalen Entzündung entsprechend – eigentlich zu 100% und in einem gewissen Maße auch gewollt, weil durch die Inflammation maligne Zellen eliminiert werden sollen. Diese Reaktionen sind meist passager und in seltenen Fällen relevant. Auf lange Sicht können Spätveränderungen – einer „Vernarbung“ entsprechend – auftreten, welche in wenigen Prozent der Fälle gravierend sind. Interessant sind Daten zur Lebensqualität, denn weder in der „Low risk“-Situation (5-Jahres-Ergebnisse der PRIME-1-Studie) noch bei Status nach Mastektomie (2-Jahres-Ergebnisse der SUPREMO-Studie) hatte die adjuvante RT einen signifikanten Einfluss.2,3
Letztlich gilt es, Risiken und Nutzen abzuwägen und das radiotherapeutische Vorgehen risikoadaptiert anzupassen.
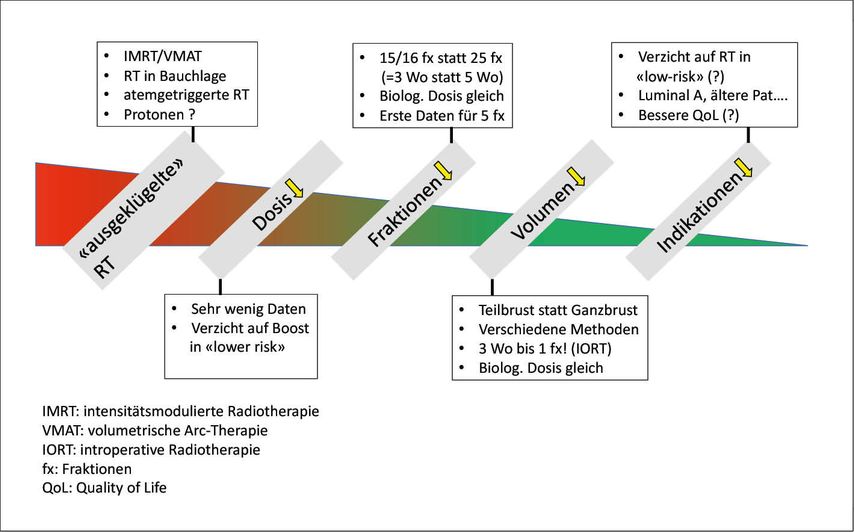
Möglichkeiten der Deeskalation (Abb. 1)
1. „Ausgeklügelte“ RT
Technische Fortschritte ermöglichen eine optimierte Dosisverteilung und Applikation. Dadurch kann vor allem die Akuttoxizität (z.B. exsudative Hautveränderung) deutlich reduziert werden.4,5 Eine Bestrahlung in Bauchlage oder atemgetriggert bei maximaler Inspiration ermöglicht, das Herz besser auszusparen, und gerade bei großer Brust scheint die RT in Bauchlage auch die Akuttoxizität zu senken.6–8 Die Wertigkeit von Protonen („vorteilhafte“ Dosisverteilung im Gewebe) wird momentan in einer großen randomisierten Studie geprüft.9
2. Dosisreduktion
Nachdem eine Dosissteigerung (Boost) die Lokalrezidivrate bei Brusterhaltung verringern konnte,10 war die Bereitschaft für Studien für eine bewusste Dosisreduktion gering. Der „St. George and Wollongong breast boost trial“ (zusätzlicher Boost in Kombination mit reduzierter Ganzbrustdosis) wurde meines Wissens nie bezüglich lokaler Kontrolle publiziert.11 In einer Niedrigrisikokonstellation wird heutzutage aber zumindest der Verzicht auf eine Boostbestrahlung empfohlen.12
3. Reduktion der Fraktionen
Hypofraktionierte Schemata verwenden erhöhte Einzeldosen. Dadurch wird die RT biologisch „aggressiver“. Will man biologisch eine äquivalente RT verabreichen, resultiert eine Reduktion der Gesamtdosis und der Behandlungszeit. So hat sich ein 3-wöchiges Schema bei der Brusterhaltung bereits durchgesetzt,13 und auch nach Mastektomie gibt es erste randomisierte Daten.14 Die Tendenz zur weiteren Verkürzung hält an, ein 1-wöchiges Schema mit 5x5,2Gy steht kurz vor dem Einzug in die klinische Routine. Allerdings sind erst 5-Jahres-Ergebnisse publiziert.15
4. Reduktion des Bestrahlungsvolumens
Durch Reduktion des Bestrahlungsvolumens (alleinige Teilbrustbestrahlung) lässt sich ebenfalls die Gesamtbehandlungszeit senken. Es gibt verschiedene Techniken und Schemata, generell wurden in den Studien Patientinnen mit niedrigem Rückfallrisiko eingeschlossen. Sowohl 5- als auch 10-Jahres-Daten weisen auf eine vergleichbare (und niedrige) Lokalrezidivrate hin, in den meisten Studien mit weniger Toxizität im Teilbrustbestrahlungsarm. Eine Studie mit einmaliger intraoperativer RT (IORT) zeigte ebenfalls vergleichbare Outcome-Daten, die nicht brustkrebsspezifische Mortalität war mit IORT sogar signifikant geringer.16 Über alle Methoden gesehen ist die Mortalität vergleichbar, die Herztodesfallrate ist um 0,3% geringer.17 Die Teilbrustbestrahlung wird sich bei Patientinnen mit niedrigem Risiko durchsetzen.
5. Reduktion der Indikationen (= Verzicht auf RT)
Je geringer das Ausgangsrisiko für einen lokalen Rückfall, umso kleiner der absolute Gewinn durch die RT. Ein Update der PRIME-2-Studie – vor Kurzem am San Antonio Breast Cancer Symposium (SABCS) vorgestellt – hat bei selektionierten Patientinnen einen Unterschied in der lokalen Kontrolle von ca. 1% mit RT versus ca. 10% ohne RT nach 10 Jahren gezeigt, dies ohne Einfluss auf das Gesamtüberleben. Gerade bei älteren Frauen mit niedrigem Risiko ist der Verzicht auf die RT eine Option. Mehrere Studien laufen zu diesem Thema. Interessant ist der Vergleich zwischen alleiniger Teilbrustbestrahlung versus alleinige antihormonelle Therapie (EUROPA-Trial), der primäre Endpunkt ist die Lebensqualität nach 2 Jahren. Für Schweizer Zentren wird in den kommenden Monaten der EXPERT-Trial für Patientinnen mit Luminal-A-Tumoren und niedrigem Rückfallrisiko aktiviert. Diese Studie läuft schon seit einiger Zeit in Australien/Neuseeland und untersucht den Verzicht auf die Ganzbrustbestrahlung bei antihormoneller Basistherapie.
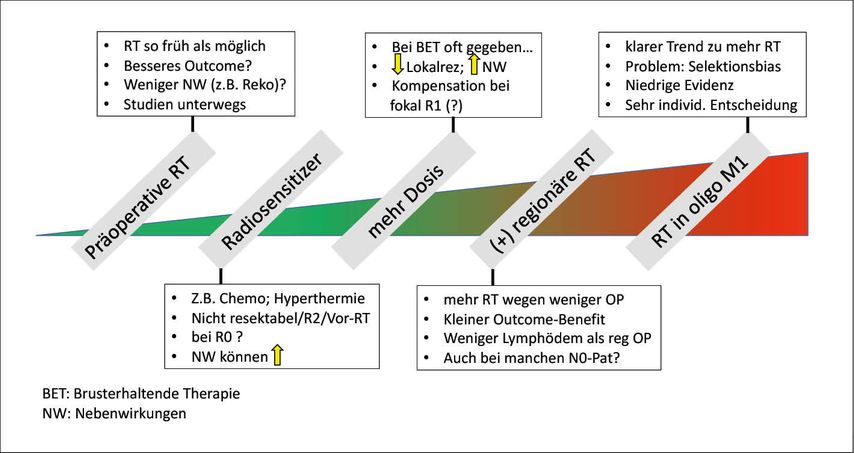
Möglichkeiten der Eskalation (Abb. 2)
1. Präoperative RT
Eine RT so schnell wie möglich könnte das Outcome verbessern. Eine große randomisierte Multicenterstudie ist in Deutschland in Planung. Zumindest bezüglich Nebenwirkungen könnte sich dieser Ansatz positiv auswirken.19 Ich sehe vor allem Vorteile bei geplantem Wiederaufbau, da dadurch keine Brustrekonstruktion bestrahlt werden muss.
2. Radiosensitizer
Eine simultane Chemotherapie oder begleitende Hyperthermie sind bekannte Radiosensitizer. Gerade in Situationen mit nicht resektablem Tumor oder bei Lokalrezidiv mit Vorbelastung findet dieser Ansatz gerne Anwendung.20 Bei simultaner Chemotherapie können aber auch Nebenwirkungen zunehmen. Generell wird deshalb die adjuvante RT erst nach abgeschlossener Chemotherapie sequenziell eingesetzt.
3. Dosiseskalation (Boost)
Bei Brusterhaltung wird eine Boostbestrahlung häufig durchgeführt. Am SABCS 2020 wurden die ersten Daten bei DCIS vorgestellt (Reduktion des relativen Risikos für ein Lokalrezidiv um ca. 50%; Reduktion des absoluten Risikos nach 5 Jahren von 7% auf 3%).21 Ähnlich wie beim invasiven Karzinom wird aber auch das Risiko für relevante Nebenwirkungen durch den Boost leicht erhöht. Interessant ist, dass die Boostbestrahlung eine Reexzision bei fokaler R1-Situation zu ersetzen vermag, sofern man einen kleinen Unterschied in der Lokalkontrolle (ca. 1% versus 3% nach 5 Jahren) akzeptiert.22
4. Zusätzliche regionäre RT
Eine zusätzliche regionäre RT führt zu einem kleinen, aber signifikanten Überlebensvorteil.23 Unklar ist dabei, welche Lymphknoten-Region/en (parasternal/periklavikulär/axillär) wirklich bestrahlt werden soll/en. Neuere Daten deuten darauf hin, dass vor allem die RT der Parasternalregion zu einer Abnahme der Fernmetastasierung und damit zu einem Überlebensvorteil führt.24 Studien wie z.B. AMAROS25 haben dazu geführt, dass bei positivem Sentinellymphknoten anstelle einer axillären Dissektion eine regionäre RT durchgeführt wird (identische Tumorkontrolle bei Halbierung des Armlymphödems). Die chirurgische Deeskalation hat eindeutig zur Zunahme der regionären Bestrahlung beigetragen.
5. RT in oligometastasierter Situation
Das Konzept einer optimalen lokalen Tumorkontrolle bei oligometastasierter Tumorerkrankung wird momentan bei verschiedenen Tumorentitäten evaluiert und hat bereits in verschiedene Guidelines Einzug gehalten. Momentan ist unklar, welche Subgruppen von Patientinnen mit Oligo-M1 am ehesten davon profitieren, die Wahrscheinlichkeit eines Selektionsbias in den publizierten Arbeiten ist hoch.26 Die S3-Leitlinie empfiehlt eine individuelle und interdisziplinäre Entscheidung bei selektionierten Patientinnen.12
Welche Strategien helfen hinsichtlich einer risikoadaptierten Radiotherapie?
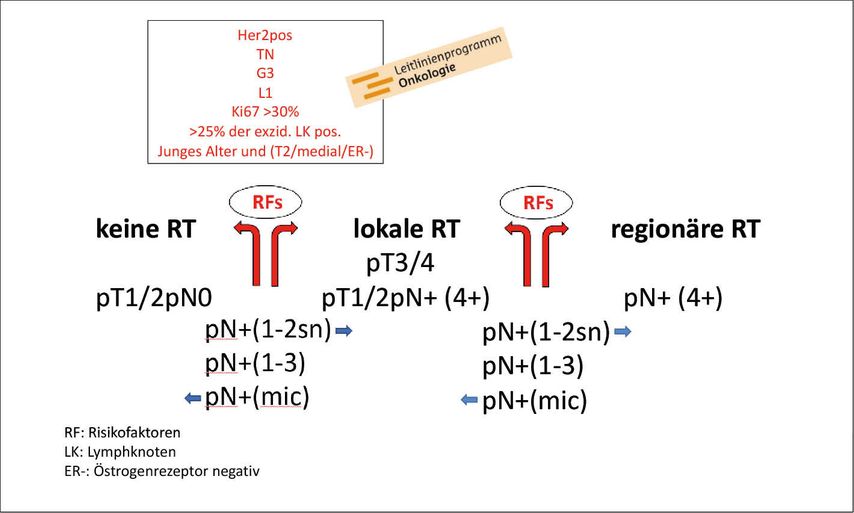
Als Diskriminator zwischen keiner, lokaler oder lokoregionärer RT werden vor allem das T- und das N-Stadium sowie das Patientinnenalter herangezogen. Allerdings hat sich z.B. die NCCN-Guideline27 bei Status nach Mastektomie seit über 20 Jahren kaum verändert. Bei pT1/2 pN0 erfolgt keine Empfehlung einer RT, bei höherem T-Stadium (pT3/4) sieht man die RT lokal, bei 4 oder mehr befallenen Lymphknoten auch regionär indiziert (Abb. 3). Allerdings ist das Vorgehen uneinheitlich, und es gibt Subgruppen von Patientinnen, für welche die Entscheidung schwerfällt. Wie soll man bei 1–2 positiven Sentinels verfahren? Kann bei Mikrometastasierung getrost auf eine Postmastektomie-RT verzichtet werden? Wie sieht es für Patientinnen mit 1–3 befallenen Lymphknoten nach Axilladissektion aus? Auch wenn die Tendenz in die eine oder andere Richtung geht (blaue Pfeile in Abb. 3), die vorhandene Datenlage erlaubt eine unterschiedliche Wertung. Oft helfen zusätzliche Risikofaktoren in der Entscheidungsfindung (Abb.3). Die Tumorbiologie spielt eine immer größere Rolle, vor allem tripelnegative Tumoren rezidivieren häufiger. Die Identifikation von Biomarkern und die Entwicklung Genom-basierter Assays zur prädiktiven Bestimmung von Effektivität und Nebenwirkungen der RT wird die Zukunft darstellen. Wir sind noch nicht so weit, aber die ersten Ergebnisse als Grundstein für einen breiteren Einsatz in der klinischen Routine sind da.28
Literatur:
1 Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) et al.: Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death: meta-analysis of individual patient data for 10,801 women in 17 randomised trials. Lancet 2011; 378(9804): 1707-16 2 Prescott RJ et al.: A randomised controlled trial of postoperative radiotherapy following breast-conserving surgery in a minimum-risk older population. The PRIME trial. Health Technol Assess 2007; 11(31): 1-149 3 Velikova G et al.: Quality of life after postmastectomy radiotherapy in patients with intermediate-risk breast cancer (SUPREMO): 2-year follow-up results of a randomised controlled trial. Lancet Oncol 2018; 19(11): 1516-29 4 Joseph K et al.: Skin toxicity in early breast cancer patients treated with field-in-field breast intensity-modulated radiotherapy versus helical inverse breast intensity-modulated radiotherapy: results of a phase III randomised controlled trial. Clin Oncol (R Coll Radiol) 2021; 33(1): 30-39 5 Yee C et al.: Radiation-induced skin toxicity in breast cancer patients: a systematic review of randomized trials. Clin Breast Cancer 2018; 18(5): e825-e840 6 Jagsi R et al.: A randomized comparison of radiation therapy techniques in the management of node-positive breast cancer: primary outcomes analysis. Int J Radiat Oncol Biol Phys 2018; 101(5): 1149-58 7 Mulliez T et al.: Heart dose reduction by prone deep inspiration breath hold in left-sided breast irradiation. Radiother Oncol 2015; 114(1): 79-84 8 Mulliez T et al.: Hypofractionated whole breast irradiation for patients with large breasts: a randomized trial comparing prone and supine positions. Radiother Oncol 2013; 108(2): 203-8 9 Bekelman JE et al.: Pragmatic randomised clinical trial of proton versus photon therapy for patients with non-metastatic breast cancer: the Radiotherapy Comparative Effectiveness (RadComp) Consortium trial protocol. BMJ Open 2019; 9(10): e025556 10 Bartelink H et al.: Whole-breast irradiation with or without a boost for patients treated with breast-conserving surgery for early breast cancer: 20-year follow-up of a randomised phase 3 trial. Lancet Oncol 2015; 16(1): 47-56 11 Hau E et al.: The impact of breast cosmetic and functional outcomes on quality of life: long-term results from the St. George and Wollongong randomized breast boost trial. Breast Cancer Res Treat 2013; 139(1): 115-23 12 www.awmf.org/uploads/tx_szleitlinien/032-045OLk_S3_Mammakarzinom_2020-02.pdf 13 Haviland JS et al.: The UK standardisation of breast radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer: 10-year follow-up results of two randomised controlled trials. Lancet Oncol 2013; 14(11): 1086-94 14 Wang SL et al.: Hypofractionated versus conventional fractionated postmastectomy radiotherapy for patients with high-risk breast cancer: a randomised, non-inferiority, open-label, phase 3 trial. Lancet Oncol 2019; 20(3): 352-60 15 Murray Brunt A et al.: Hypofractionated breast radiotherapy for 1 week versus 3 weeks (FAST-forward): 5-year efficacy and late normal tissue effects results from a multicentre, non-inferiority, randomised, phase 3 trial. Lancet 2020; 395(10237): 1613-26 16 Vaidya JS et al.: Long term survival and local control outcomes from single dose targeted intraoperative radiotherapy during lumpectomy (TARGIT-IORT) for early breast cancer: TARGIT - a randomised clinical trial. BMJ 2020; 370: m2836 17 Haussmann J et al.: No difference in overall survival and non-breast cancer deaths after partial breast radiotherapy compared to whole breast radiotherapy – ameta-analysis of randomized trials. Cancers (Basel) 2020; 12(8): 2309 18 Kunkler IH et al.: Prime 2 randomised trial (postoperative radiotherapy in minimum-risk elderly): wide local excision and adjuvant hormonal therapy +/- whole breast irradiation in women =/> 65 years with early invasive breast cancer: 10-yr results. SABCS 2020, Abstr. #GS2-03. www.abstractsonline.com/pp8/#!/9223/presentation/579 19 Matuschek C et al.: Long-term cosmetic outcome after preoperative radio-/chemotherapy in locally advanced breast cancer patients. Strahlenther Onkol 2019; 195: 615-28 20 Jones EL et al.: Randomized trial of hyperthermia and radiation for superficial Tumors. J Clin Oncol 2005; 23(13): 3079-85 21 Chua BH et al.: A randomized phase III study of radiation doses and fractionation schedules in non-low risk ductal carcinoma in situ (DCIS) of the breast (BIG 3-07/TROG 07.01). SABCS 2020, Abstr. #GS2-04. https://www.abstractsonline.com/pp8/#!/9223/presentation/580 22 Vos EL et al.: Omitting re-excision for focally positive margins after breast-conserving surgery does not impair disease-free and overall survival. Breast Cancer Res Treat 2017; 164(1): 157-67 23 Budach W et al.: Adjuvant radiation therapy of regional lymph nodes in breast cancer – a meta-analysis of randomized trials – an update. Radiat Oncol 2015; 10: 258 24 Haussmann J et al.: Which target volume should be considered when irradiating the regional nodes in breast cancer? Results of a network-meta-analysis. Radiat Oncol 2019; 14(1): 102 25 Rutgers E et al.: Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer patients: 10 year follow up results of the EORTC AMAROS trial (EORTC 10981/22023). Cancer Research 2019; 79: GS4-01 26 Haussmann J et al.: The role of local treatment in oligometastatic and oligoprogressive cancer. Dtsch Arztebl Int 2019; 116(50): 849-56 27 www.nccn.org/professionals/physician_gls/pdf/breast.pdf 28 Sjöström M et al.: Clinicogenomic radiotherapy classifier predicting the need for intensified locoregional treatment after breast-conserving surgery for early-stage breast cancer. J Clin Oncol 2019; 37(35): 3340-49
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...