Fortschritte personalisierter Medizin in der Brustkrebstherapie
Bericht:
Dr. Ine Schmale
Zielgerichtete Therapien sind aus der Behandlung des fortgeschrittenen Mammakarzinoms nicht mehr wegzudenken. Brustkrebs gehört mit seinen molekularbiologischen Subtypen zu den Vorreitern der personalisierten Medizin. Beim San Antonio Breast Cancer Symposium (SABCS) 2022 wurden neue zielgerichtete Therapieansätze vorgestellt. Bei neu diagnostizierter Erkrankung kann spezifischen Patientinnen mithilfe des Oncotype DX Breast Recurrence Score die kognitive Verschlechterung durch eine Chemotherapie erspart werden.
Patientinnen kognitive Verluste durch Chemo ersparen
Ergebnisse der RxPONDER-Studie zeigten, dass Patientinnen mit einem Oncotype DX Breast Recurrence Score 0–25 nicht von einer Chemotherapie profitieren. Eine Substudie unterstreicht die Verwendung des Score, aufgrund des Risikos für eine anhaltende kognitive Verschlechterung unter und nach Chemotherapie.1
In die RxPONDER-Studie wurden 5083 Brustkrebspatientinnen mit hormonrezeptorpositivem, HER2-negativem Brustkrebs, nicht fernmetastasierten Tumoren und 1–3 befallenen Lymphknoten eingeschlossen. Die Patientinnen wurden randomisiert mit alleiniger endokriner Therapie oder Chemotherapie gefolgt von endokriner Therapie behandelt. In die Substudie zur kognitiven Funktion wurden konsekutiv englischsprachige US-Amerikanerinnen eingeladen und die Fragebögen von 139 prämenopausalen sowie 429 postmenopausalen Patientinnen ausgewertet. Es wurden nur Patientinnen mit einem Oncotype DX Breast Recurrence Score zwischen 0 und 25 ausgewertet.
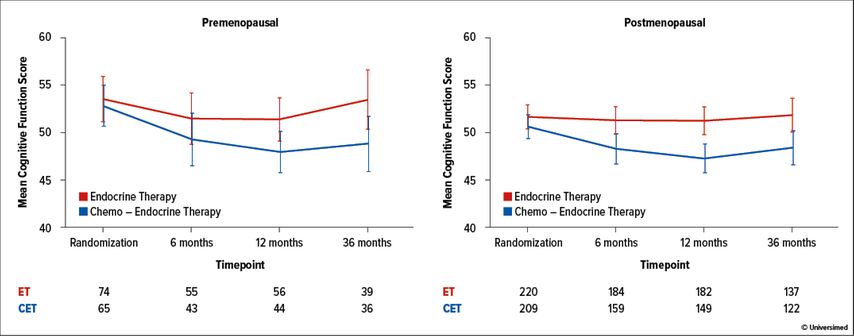
Innerhalb der prämenopausalen Subgruppe wurde für Patientinnen unter alleiniger endokriner Therapie ein leichtes Absinken der kognitiven Funktion nach 6 Monaten beobachtet, das bis zu 12 Monate anhielt, aber nach 36 Monaten wieder auf den Stand bei Randomisierung anstieg (Abb. 1). Bei Gabe von Chemotherapie plus endokriner Therapie war die kognitive Funktion nach 6 Monaten niedriger, nach 12 Monaten weiter gesunken und erholte sich kaum bis nach 36 Monaten. Die postmenopausalen Patientinnen zeigten keinen Verlust der kognitiven Funktion unter endokriner Therapie, jedoch das gleiche Bild der kognitiven Schädigung unter Chemotherapie mit leichter, aber nicht vollständiger Erholung nach 36 Monaten. Der Unterschied zwischen den Therapiearmen erreichte für beide Patientinnensubgruppen die statistische Signifikanz.
Abb. 1: Durchschnittlicher Cognitive Function Score unter endokriner Therapie mit/ohne Chemotherapie bei prä- bzw. postmenopausalen Frauen1
Eine klinisch relevante Verschlechterung der kognitiven Funktion nach 36 Monaten gaben 28% versus 42% der prämenopausalen und 36% versus 41% der postmenopausalen Frauen unter alleiniger endokriner Therapie versus Chemo- und nachfolgender endokriner Therapie an. Eine klinisch relevante Verbesserung wurde von 28% versus 19% bzw. 32% versus 24% der Patientinnen berichtet.
Prognostischer Marker bei inflammatorischem Brustkrebs
Neben wirksamen Therapien ist auch das Erkennen von Risikofaktoren bei der Behandlung von Brustkrebspatientinnen von hohem Stellenwert. Das inflammatorische Mammakarzinom (IBC) beispielsweise ist mit einer erhöhten Inzidenz von Hirnmetastasen assoziiert und hat insgesamt eine schlechtere Prognose als nichtinflammatorischer Brustkrebs. Die Entzündung führt zudem häufig zu einer falschen Beurteilung und damit zu einer verzögerten Diagnose der onkologischen Erkrankung.
Wie beim SABCS gezeigt wurde, scheint beim IBC das Protein E-Cadherin eine onkogene Funktion zu spielen.2 Eine Überexpression des Proteins kann bei IBC-Tumoren und Tumorembolien vermehrt beobachtet werden. Hohe Spiegel von löslichem E-Cadherin können im Serum, im Urin und im Plasma von Krebspatientinnen gemessen werden und gehen mit einer schlechten Prognose einher. Damit kann, so das Ergebnis einer beim SABCS 2022 präsentierten Studie, lösliches E-Cadherin als unabhängiger Prädiktor für das OS bei IBC-Patientinnen verwendet werden. Außerdem könnte lösliches E-Cadherin ein therapeutisches Ziel in der Tumormikroumgebung bei Patientinnen mit metastasiertem IBC werden, bemerkten die Autoren.
Östradiol unterdrückt antitumorale Immunantwort
Jüngere Frauen (<45 Jahre) haben bei einer Brustkrebserkrankung ein erhöhtes Risiko für die Entwicklung von Hirnmetastasen. Auch das aggressive tripelnegative Mammakarzinom entsteht häufiger bei jüngeren Frauen, erklärt aber nicht das häufigere Auftreten der Hirnmetastasierung. Im Mausmodell wurde nun untersucht, ob Östradiol möglicherweise das Wachstum von Hirnmetastasen fördert.3
Im Ergebnis wurde gezeigt, dass prämenopausale Östradiolspiegel das immunsuppressive Tumorumfeld fördern, was zur Hirnmetastasierung beitragen kann. Durch eine Depletion von Östradiol kann die anti-tumorale Immunantwort wiederhergestellt werden, einschließlich der erhöhten Produktion von T- und B-Zellen. Daher könnte die Östradioldepletion in Kombination mit stereotaktischer Bestrahlung verwendet werden, um die Progression von Hirnmetastasen bei jüngeren Patientinnen mit tripelnegativem Brustkrebs mit oder ohne extrakranielle Erkrankung zu vermindern.
T-DXd bei T-DM1-vorbehandeltem, HER2-positivem Brustkrebs
Für das Antikörper-Wirkstoff-Konjugat T-DXd wurde in den Studien DESTINY-Breast03 und DESTINY-Breast01 eine gute Wirksamkeit bei HER2-positivem (HER2+), metastasiertem Mammakarzinom gezeigt. Die randomisierte, offene Phase-III-Studie DESTINY-Breast02 schloss Patientinnen und Patienten ein, die bereits mit T-DM1 behandelt wurden.4 2:1 randomisiert erhielten insgesamt 608 Patient*innen T-DXd oder, nach Wahl des Behandlers, Trastuzumab plus Capecitabin oder Lapatinib plus Capecitabin. Der primäre Studienendpunkt war das progressionsfreie Überleben (PFS).
Mit einer medianen Nachbeobachtungszeit von 21,5 Monaten für T-DXd und 18,6 Monaten für TPC waren noch 23,3% der Patient*innen im T-DXd- versus 2,6% der Patient*innen im TPC-Arm unter Studienbehandlung. Der häufigste Grund für das Abbrechen der Therapie war in 43,1% versus 72,3% der Fälle die progrediente Tumorerkrankung sowie bei 18,3% versus 7,2% der Patient*innen das Auftreten von Nebenwirkungen. Die Studienteilnehmer*innen waren median 54–55 Jahre alt und hatten median 2 Therapielinien erhalten.
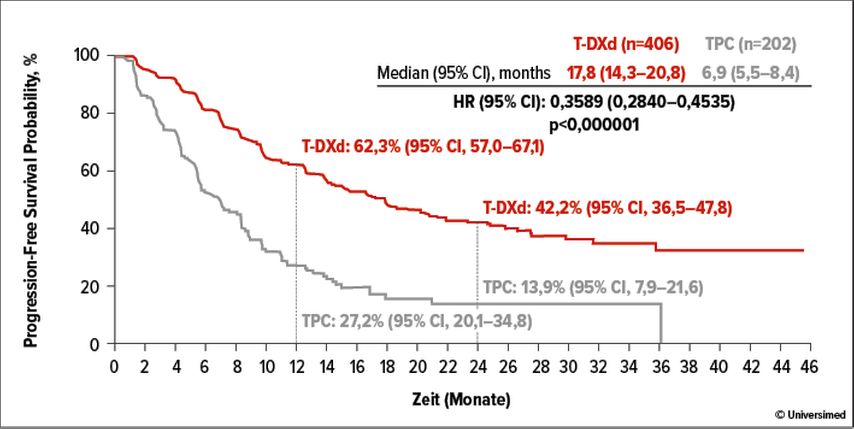
Das Risiko für einen Tumorprogress war im T-DXd-Arm im Vergleich zur Wahl des Behandlers um 64% verringert (HR: 0,36; 95% CI: 0,28–0,45; p<0,0001) (Abb. 2). Im Median betrug das PFS 17,8 versus 6,9 Monate. Nach 12 Monaten lebten 62,3% versus 27,2% der Patient*innen ohne Progress, nach 24 Monaten 42,2% versus 13,9%. Der Vorteil der T-DXd-Therapie wurde für alle untersuchten Subgruppen beobachtet. Als wichtigster sekundärer Endpunkt wurde das Gesamtüberleben (OS) ausgewertet. Das Risiko zu sterben wurde um 34% reduziert (HR: 0,66; 95% CI: 0,50–0,86; p=0,0021). Im Median lebten die Patient*innen 39,2 versus 26,5 Monate. Die 12- und 24-Monats-OS-Raten betrugen 89,4% versus 74,7% bzw. 65,9% versus 54,3%. Ein Ansprechen zeigten 69,7% versus 29,2% der Patient*innen (p<0,0001) und die mediane Dauer des Ansprechens betrug 19,6 versus 8,3 Monate. Das Sicherheitsprofil für T-DXd war konsistent mit den bekannten Daten. Insgesamt trat eine interstitielle Lungenerkrankung bei 10,4% der Patient*innen im T-DXd-Arm auf, bei der Mehrheit nur in moderater Ausprägung (Grad 1–2: 9,2%).
Capivasertib plus Fulvestrant bei fortgeschrittenem HR+ HER2– Brustkrebs
Ein neues Target in der Behandlung des fortgeschrittenen Mammakarzinoms ist der AKT-Signalweg. Der AKT-Signalweg kann beim fortgeschrittenen hormonrezeptorpositiven (HR+), HER2-negativen (HER2–) Mammakarzinom aufgrund von Alterationen in den Genen PIK3CA, AKT1 und PTEN aktiviert sein, wie auch bei Tumoren ohne diese Mutationen. Der AKT-Signalweg ist zudem bei der Entwicklung von Resistenzen gegen endokrine Therapien involviert. Die Therapie mit dem selektiven Inhibitor der drei AKT-Isoformen (AKT1/2/3) Capivasertib zeigte in der placebokontrollierten Phase-II-Studie FAKTION in Kombination mit Fulvestrant vielversprechende Ergebnisse. Beim SABCS 2022 wurden die Ergebnisse der Phase-III-Studie CAPItello-291 präsentiert.5
Insgesamt 708 Patientinnen und Patienten mit fortgeschrittenem Aromataseinhibitor(AI)-resistentem, HR+, HER2– Brustkrebs erhielten in der doppelblinden CAPItello-291-Studie randomisiert Capivasertib plus Fulvestrant oder Placebo plus Fulvestrant. Zu den Einschlusskriterien gehörten der Krankheitsrückfall innerhalb von 12 Monaten nach Beendigung der adjuvanten AI-Therapie oder bei Progress unter AI-Therapie in der fortgeschrittenen Situation. Die Patient*innen durften für die fortgeschrittene Erkrankung maximal 2 endokrine Therapielinien und maximal 1 Chemotherapielinie erhalten haben. Vorangegangene Behandlung mit CDK4/6-Inhibitoren war erlaubt. Stratifiziert wurde nach Vorhandensein von Lebermetastasen und der vorangegangenen CDK4/6-Inhibitor-Therapie. Als dualer primärer Endpunkt wurde das PFS der gesamten Studienpopulation sowie der Patient*innen mit Alterationen im AKT-Signalweg untersucht.
Der duale Endpunkt der Studie wurde erreicht. Das mediane PFS für die gesamte Studienpopulation betrug 7,2 Monate im Capivasertib-Arm versus 3,6 Monate unter Placebo plus Fulvestrant. Das Risiko für einen Progress wurde um 40% reduziert (HR: 0,60; 95% CI: 0,51–0,71; p<0,001). Innerhalb der Population mit AKT-Signalweg-Alterationen betrug das mediane PFS 7,3 versus 3,1 Monate (HR: 0,50; 95% CI: 0,38–0,65; p<0,001). Die explorative Analyse der nicht-AKT-Signalweg-alterierten Population – einschließlich der Patient*innen mit unbekanntem AKT-Alterationsstatus – bestätigte ebenfalls den Vorteil durch die zusätzliche Capivasertib-Therapie mit einem Median von 7,2 Monaten versus 3,7 Monate (HR: 0,70; 95% CI: 0,56–0,88). Wurden die Patient*innen mit unbekanntem AKT-Status aus der Auswertung herausgenommen, verfehlte der Unterschied die statistische Signifikanz knapp (HR: 0,79; 95% CI: 0,61–1,02). Ein PFS-Vorteil der zusätzlichen Capivasertib-Gabe wurde für alle untersuchten Subgruppen bestätigt.
Von der gesamten Studienpopulation sprachen 22,9% der Patient*innen auf die Capivasertib-haltige Therapie versus 12,2% der Patient*innen im Kontrollarm sowie 28,8% versus 9,7% der AKT-Signalweg-alterierten Population auf die Studienmedikation an. Mit einer Reife von 28% für das OS wurde bereits der Capivasertib-Vorteil mit einer Hazard-Ratio von 0,74 (95% CI: 0,56–0,98) für die gesamte Studienpopulation sowie von 0,69 (95% CI: 0,45–1,05) für Patient*innen mit AKT-Signalweg-Alterationen beobachtet. Unter der zusätzlichen Therapie mit Capivasertib erhöhte sich das Auftreten klinisch relevanter Nebenwirkungen von 8,0% auf 16,1%. 13,0% versus 2,3% der Patient*innen brachen die Therapie aufgrund der Toxizität ab. Die häufigsten Nebenwirkungen waren Diarrhö (72,4% vs. 20,0%) und Übelkeit (34,6% vs. 15,4%).
Quelle:
San Antonio Breast Cancer Symposium 2022, 6.-10. Dezember 2022, San Antonio
Literatur:
1 Kang I et al.: Patient-reported cognitive impairment in women participating in the RxPONDER trial (SWOG S1007) by menopausal status. SABCS 2022, Abstr. #GS1-04 2 Hu X et al.: Soluble E-cadherin: A novel prognostic biomarker and driver of brain metastasis in inflammatory breast cancer. SABCS 2022, Abstr. #GS5-08 3 Contreras-Zarate MJ et al.: Estradiol represses anti-tumoral immune response to promote progression of triple-negative breast cancer brain metastases. SABCS 2022, Abstr. #GS5-07 4 Krop I et al.: Trastuzumab deruxtecan vs physician‘s choice in patients with HER2+ unresectable and/or metastatic breast cancer previously treated with trastuzumab emtansine: Primary results of the randomized phase 3 study DESTINY-Breast02. SABCS 2022, Abstr. #GS2-01 5 Turner NC et al.: Capivasertib and fulvestrant for patients with aromatase inhibitor-resistant hormone receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer: Results from the phase III CAPItello-291-trial. SABCS 2022, Abstr. #GS3-04
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...