Interessante Fälle aus dem Tumorboard
Autor:innen:
Ap. Prof. PD Dr. Dagmar Kollmann, PhD
Univ.-Prof. Dr. Sebastian F. Schoppmann, F.A.C.S
Univ.-Prof. DDr. Johannes Gojo
Dr. Abed Ahmadi
PD Dr. Barbara Kiesel
Assoc. Prof. PD Dr. Georg Widhalm
In dieser Ausgabe werden vorgestellt: ein Patient mit Ösophaguskarzinom, ein Kind mit Clivuschordom und ein Patient mit Oligodendrogliom.
Ösophaguskarzinom
Patient, 63 Jahre bei Diagnosestellung
Onkologische Anamnese
Ein 63-jähriger Patient stellt sich mit seit zwei Monaten zunehmender Dysphagie vor. Er beschreibt vor allem postprandial ausgeprägte, schmerzfreie Regurgitationen. Gewichtsverlust ist ihm keiner aufgefallen. Als Nebendiagnosen gibt er eine Hypertonie sowie Nikotinabusus an.
Weiterführende Untersuchung
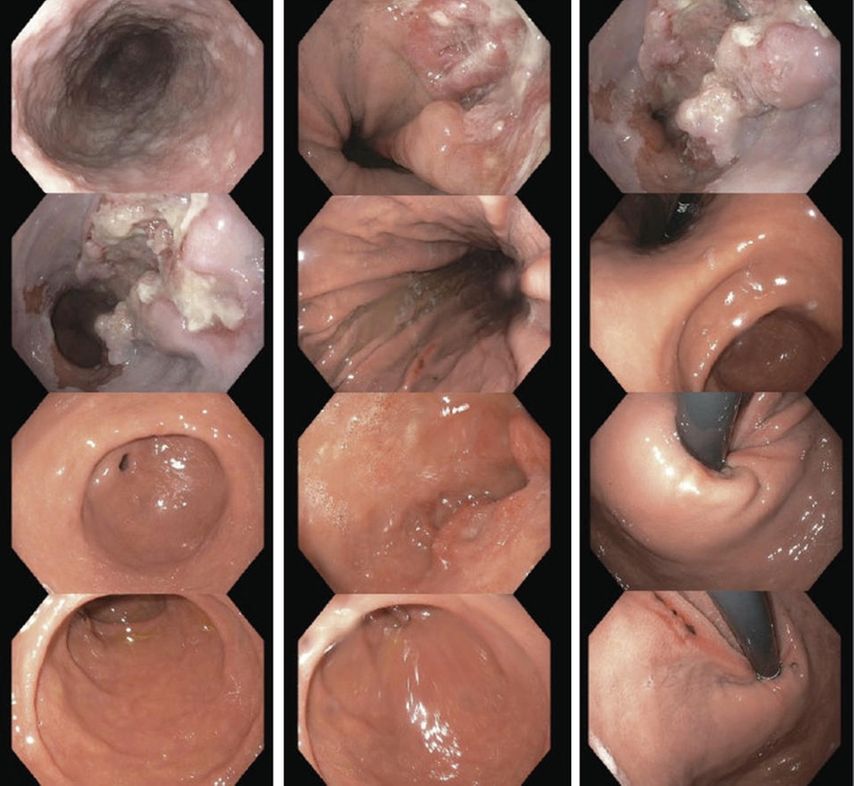
Es wird zunächst eine Gastroskopie durchgeführt, bei der sich bereits der hochgradige Verdacht auf ein Ösophaguskarzinom stellt (Abb. 1). Es zeigt sich ein polypoid exulzerierter Tumor bei 40–43cm AZR (Abstand ab Zahnreihe), in typischer AEG(Adenokarzinom des ösophagogastralen Übergangs)-1-Position. Die histologische Untersuchung bestätigt diesen Verdacht: Es handelt sich um ein invasives, niedrig differenziertes Adenokarzinom, HER2+++, mikrosatellitenstabil (MSI–).
Abb. 1: Gastroskopiebilder der ersten Gastroskopie; der polypoid exulzerierte Tumor zeigt sich bei 40–43 cm AZR am gastroösophagealen Übergang
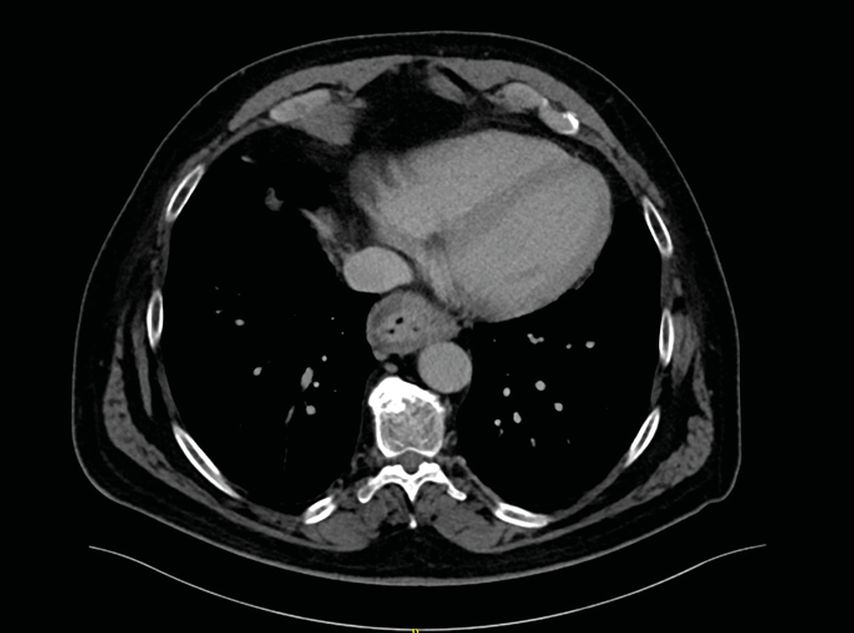
In der daraufhin für das weitere Staging vorgenommenen CT von Thorax und Abdomen (Abb. 2) zeigt sich eine deutliche Wandverdickung am ösophagogastralen Übergang mit vor allem mukosal deutlich verstärktem Kontrastmittel-Enhancement, wobei die Begrenzung zum mediastinalen Fettgewebe glatt imponiert, ohne Hinweis auf Infiltration umgebender Organe. Lokoregional finden sich zwei suspekte, länglich-ovaläre, maximal 6mm im Querdurchmesser haltende Lymphknoten. Radiologisches Staging: T3N+M–
Abb. 2: CT Thorax/Abdomen – im distalen Ösophagus zeigt sich eine Wandverdickung, allerdings keine Infiltration umgebender Strukturen
Vorstellung im Tumorboard
Mit der vorliegenden Diagnose wird der Fall im Tumorboard vorgestellt. Bei dem lokal fortgeschrittenen operablen Adenokarzinom wird beschlossen, eine neoadjuvante Therapie nach dem FLOT-Schema (5-Fluorouracil, Leucovorin, Oxaliplatin, Docetaxel [Taxan]) einzuleiten.1 Diese bringt einen Überlebensvorteil im Vergleich zu anderen systemischen Chemotherapien (z.B. ECF/ECX) bei Patient:innen mit lokal fortgeschrittenem, resektablem Adenokarzinom des ösophagogastralen Übergangs.2 Aufgrund der nach wie vor fehlenden Evidenz eines Überlebensvorteils durch eine präoperative Behandlung mit Trastuzumab bei HER2-exprimierenden Tumoren wird keine zielgerichtete Therapie hinzugefügt.3
Weitere Therapie
Über einen peripheren Verweilkatheter (PAC) erhält der Patient vier Zyklen FLOT, die er gut verträgt. In der Restaging-CT nach der Therapie zeigt sich ein gutes Tumoransprechen, mit weiterhin vergrößerten lokoregionären Lymphknoten. Vier Wochen nach Beendigung der präoperativen Therapie erfolgt eine Hybrid-Ivor-Lewis-OP mit einer laparoskopischen Magenschlauchbildung und anschließender Minithorakotomie, die problemlos verläuft. Auch der postoperative Verlauf gestaltet sich problemlos, der Patient kann nach acht Tagen das Krankenhaus verlassen.
Die endgültige Histologie ergibt folgenden Befund: Residuen eines Adenokarzinoms des gastroösophagealen Übergangs mit Infiltration der Submukosa, tumorfreier Resektionsrand, Tumorregressionsgrad nach Mandard: TRG 3 – ypT1b, N0 (0/21), L0, V0, R0, HER2-negativ, MSI-negativ. Der Patient wird daher abermals im Tumorboard vorgestellt.
Postoperativer Verlauf
Der Evidenz folgend wird beschlossen, eine adjuvante Therapie nach dem FLOT-Schema einzuleiten, welche von unserem Patienten allerdings nur schlecht vertragen wird. Basierend auf dem Wissen, dass 90% aller Rezidive in den ersten zwei Jahren nach der Operation auftreten, erfolgt alle drei bis sechs Monate eine CT-Untersuchung zusätzlich zur Abnahme eines großen Blutbildes und Bestimmung der Tumormarker.1
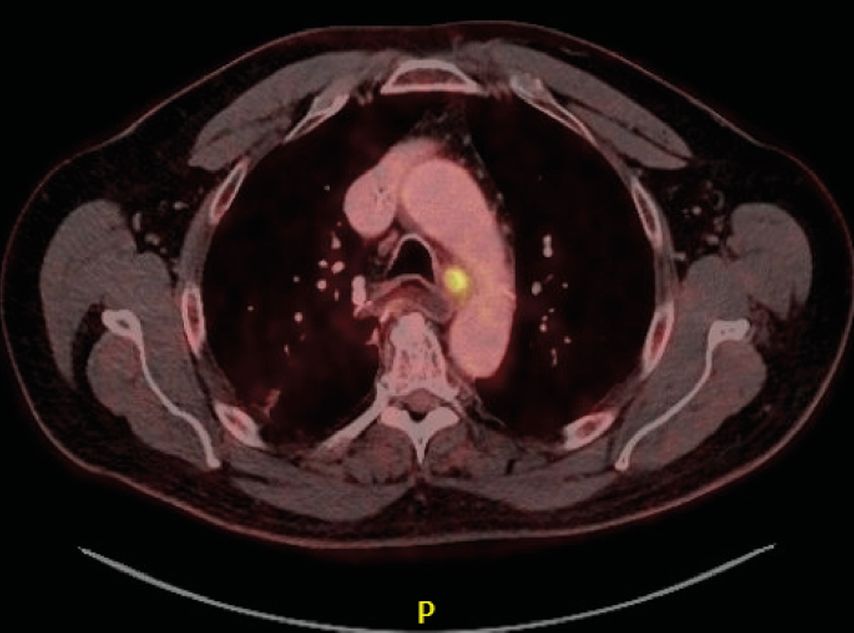
Ein Jahr nach der Operation wird ein PET-CT durchgeführt, in dem sich ein positiver Lymphknoten paratracheal links zeigt (Abb. 3). Zur Entscheidung bezüglich der weiteren Therapie erfolgt eine ultraschallgezielte Feinnadelbiopsie. Die histologische Untersuchung zeigt die Raumforderung passend zu einer Absiedelung des bekannten Adenokarzinoms, allerdings jetzt PD-L1-positiv, mit einem CPS-Score von 62.
Abb. 3: In der PET-CT zeigt sich 1 Jahr postoperativ ein positiver Lymphknoten paratracheal links
Nach Vorstellung im interdisziplinären Tumorboard erhält der Patient eine lokale Strahlentherapie (55Gy), eine dosisreduzierte Chemotherapie (FLOT, Capecitabin, FOLFOX) sowie eine Immuntherapie (Nivolumab).4 Die Immuntherapie wird als Erhaltungstherapie für ein weiteres Jahr fortgesetzt. Nach diesem Jahr zeigt sich der bestrahlte Lymphknoten allerdings abermals größenprogredient. Der Patient erhält daraufhin eine Protonentherapie (7Gy in 5 Fraktionen). Anschließend kann drei Jahre später eine radiomorphologische „complete response“ erzeugt werden. Im Lauf der weiteren Untersuchungen zeigen sich mehrere kleinere Rundherde pulmonal, weshalb die Verdachtsdiagnose einer Autoimmunpneumonitis gestellt wird – nach dem Pausieren der Immuntherapie verbessert sich diese wieder.
Zusammenfassung
Der Großteil (90%) der gastroösophagealen Tumoren mit kurativem Ansatz bedarf einer multimodalen Therapie. Die therapeutischen Möglichkeiten werden durch neue zielgerichtete Therapieoptionen (Strahlentherapie, Immuntherapie etc.) immer vielfältiger. Die ideale Therapie kann für diese Patient:innen ausschließlich im großen interdisziplinären Orchester, dem Tumorboard, erreicht werden. Wie bei unserem Patienten, der innerhalb von vier Jahren 15-mal im Tumorboard vorgestellt wurde, soll dies ein interdisziplinärer und die gesamte Krankheit begleitender Prozess sein.
Autor:innen:
Ap. Prof. PD Dr. Dagmar Kollmann, PhD
Univ.-Prof. Dr. Sebastian F. Schoppmann, F.A.C.S
Universitätsklinik für Allgemeinchirurgie
Klinische Abteilung für Viszeralchirurgie
Universitätsklinikum AKH Wien
E-Mail:
dagmar.kollmann@meduniwien.ac.at
sebastian.schoppmann@meduniwien.ac.at
Literatur:
1 Obermannova R et al.: Oesophageal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2022; 33: 992-1004 2 Al-Batran SE et al.: Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet 2019; 393(10184): 1948-57 3 Safran HP et al.: Trastuzumab with trimodality treatment for oesophageal adenocarcinoma with HER2 overexpression (NRG Oncology/RTOG 1010): a multicentre, randomised, phase 3 trial. Lancet Oncol 2022; 23: 259-69 4 Kelly RJ et al.: Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer. N Engl J Med 2021; 384: 1191-203
Clivuschordom
Patient, 6 Jahre bei Diagnosestellung
Onkologische Anamnese
Der Patient ist ein initial extern betreutes Kind, bei dem extern die Erstdiagnose eines rechtsseitigen Clivuschordoms gestellt wurde. Es wurde reseziert und der Patient wurde adjuvant protonenbestrahlt. Im Verlauf zeigte sich ein Rezidiv, weswegen eine Re-Resektion durchgeführt wurde.
Verlauf nach Re-Resektion
Es entwickelte sich eine Liquorrhö, welche nach Übernahme des Patienten an unser Zentrum innerhalb einer Reoperation mit Re-Resektion operativ gedeckt wurde.
Molekularpathologische Aufarbeitung
Eine NGS-Panelsequenzierung zeigte einen pathologisch signifikanten Gain des EGFR-Gens. Weitere potenziell pathologische Alterationen waren Gains von ALK und FGFR3 sowie CHEK2. Zudem zeigten sich Mutationen mit unklarer Signifikanz, unter anderem in ABL2, FGFR4 und MLH1.
Weiterer Verlauf und Tumordynamik
Danach erfolgte die Vorstellung des Patientenin unserem pädiatrisch-neuroonkologischen Precision Tumorboard. Basierend auf der Molekularpathologie wurde eine Empfehlung einer systemischen Therapie mit dem EGFR-Inhibitor Afatinib gegeben, der auch zur Therapie des nichtkleinzelligen Lungenkarzinoms (NSCLC) eingesetzt wird. Zudem wurde basierend auf Publikationen für pädiatrische Populationen eine Therapie mit dem Multikinase-Inhibitor Imatinib empfohlen, die vorangehen sollte. Diese wurde im Anschluss daran eingeleitet. Unter Imatinib zeigte sich das Chordom mit den extrakraniellen Anteilen wie auch einem vermehrten leptomeningealen Enhancement progredient.
Tumorboard und Rationale
In der erneuten Vorstellung im Tumorboard nach zwei Monaten wurde wegen der Tumorprogression unter Imatinib aufgrund der EGFR-Alteration die Umstellung auf Afatinib festgelegt. Zusätzlich wurde im Hinblick auf das mehrfache Rezidivgeschehen und unter Berücksichtigung erster präklinischer Arbeiten die Therapie um das Pyrimidinanalogon Gemcitabin im Abstand von vier Wochen erweitert.
Rezenter Therapieverlauf
Unter der systemischen Kombinationstherapie aus Afatinib und Gemcitabin zeigte sich das leptomeningeale Enhancement in der dreimonatlichen Kontroll-cMRT-Untersuchung rückläufig. Zudem verbesserte sich der klinische Zustand des Patienten. Somit wurde die Therapie mit Afatinib und Gemcitabin weitergeführt.
Fazit
Insgesamt präsentiert sich das konventionelle Chordom der Schädelbasis sehr variabel. Vor allem der rezdivierende Verlauf ist hinsichtlich weiterer Therapieoptionen herausfordernd. Oftmals ist die Re-Resektion oder -Bestrahlung aufgrund der Vorbestrahlung/-behandlung und des Wachstumsverhaltens nur eingeschränkt möglich, auch weil der Tumor bei Zustand nach vorhergegangener Bestrahlung resistenter rezidiviert. Der Fall zeigt den Stellenwert der molekulargenetischen Untersuchung und das Potenzial einer Off-Label-Behandlung mittels Kombinations- sowie zielgerichteter Therapien, die zunehmend im Rahmen von präklinischen und klinischen Studien untersucht werden.1–3
Autoren:
Univ.-Prof. DDr. Johannes Gojo
Dr. Abed Ahmadi
Leiter der Arbeitsgruppe Pädiatrische Neuro-Onkologie
Universitätsklinik für Kinder- und Jugendheilkunde
Universitätsklinikum AKH Wien
E-Mail:
ped_neurooncology@meduniwien.ac.at
Literatur:
1 Scheipl S et al.: EGFR inhibitors identified as a potential treatment for chordoma in a focused compound screen. JPathol 2016; 239(3): 320-34 2 Magnaghi P et al.: Afatinib is a new therapeutic approach in chordoma with a unique ability to target EGFR and brachyury. Mol Cancer Ther 2018; 17(3): 603-13 3 Stacchiotti S et al.: Phase II study on lapatinib in advanced EGFR-positive chordoma. Ann Oncol 2013; 24(7): 1931-6
Oligodendrogliom, CNS WHO Grad 3
Patient, 53 Jahre bei Erstvorstellung
Anamnese
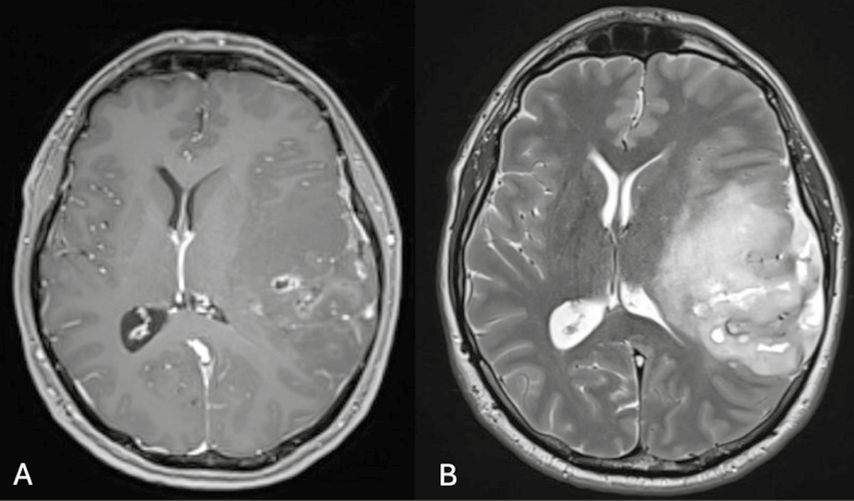
Aufgrund eines generalisierten epileptischen Anfallsgeschehens im Rahmen eines Schlafentzugs wurde der Patient an der Abteilung für Notfallmedizin im Krankenhaus Tulln vorstellig. Es erfolgte die stationäre Aufnahme an der neurologischen Abteilung zur weiteren Abklärung des epileptischen Anfalls. Im Rahmen der neurologischen Abklärung wurde ein EEG durchgeführt. Hier zeigten sich Zeichen einer erhöhten zerebralen Krampfbereitschaft. Es wurde daher mit einer antiepileptischen Therapie mit Levetiracetam 500mg 1-0-1 per os begonnen. In weiterer Folge erfolgte eine MRT des Schädels. Als auffälligster Befund zeigte sich links frontoparietal auf Höhe der Cella media eine ca. 6cm im Durchmesser haltende Raumforderung mit einer Mittellinienverlagerung von etwa 13mm und geringer Kontrastmittelaufnahme. Eine CT des Schädels zeigte ausgeprägte Verkalkungen. In Zusammenschau der Befunde entspricht die beschriebene Läsion neuroradiologisch am ehesten einem diffusen Gliom.
Es erfolgte eine Vorstellung an der Universitätsklinik für Neurochirurgie am AKH Wien und es wurde die Indikation zur Resektion der Raumforderung gestellt. Zur weiteren präoperativen Abklärung erfolgte eine Positronen-Emissions-Tomografie-(PET)-CT mit FET (18F-Fluorethylthyrosin), die einen erhöhten Aminosäurestoffwechsel im Bereich der bekannten linkshemisphärischen Raumforderung zeigte. Wegen der Lokalisation der Raumforderung in der Nähe der Sprachregion und Motorik wurde zur Optimierung der OP-Planung noch eine funktionelle MRT von Sprache und Motorik vorgenommen. Dabei zeigten sich eine eindeutig linkshemisphärisch lateralisierte Sprachfunktion und eine charakteristische Repräsentation des sensorischen und motorischen Handareals.
Neurochirurgische Resektion
Zur Reduktion des Risikos für ein permanentes motorisches Defizits (Hemiparese rechts) wurde die Resektion mit neurophysiologischem Monitoring inklusive kortikaler/subkortikaler Stimulation geplant. Zusätzlich wurde auch ein Navigationssystem mit Einbindung von MRT- und PET-Bilddaten einschließlich Inklusion von motorischen und sprachrelevanten MRT-Faserbahnen sowie der funktionellen MRT-Daten verwendet. Diese Daten wurden auch zur Planung des optimalen und sichersten Zugangs zum Tumor eingesetzt. Nach Einleitung der Narkose und Anlage des neurophysiologischen Monitorings wurde die Referenzierung des Patienten mit dem Neuronavigationsystem durchgeführt. Anschließend erfolgte die Resektion des Tumors über einen frontoparietalen Zugang.
Bereits nach Eröffnung der Dura war tumorös verändertes Gewebe im Bereich des Kortex erkennbar. Der Tumor wurde weitestgehend mittels Sauger und bipolarer Pinzette entfernt. Mit Unterstützung des neurophysiologischen Monitorings sowie der Navigation mit funktionellen Daten konnte die Resektion in Richtung Motorik und Sprache limitiert werden. Nach erfolgter sicherer Resektion kam der Patient für eine Nacht auf die neurochirurgische Intensivstation und erhielt am Folgetag vor Transferierung auf die Normalstation eine CT des Schädels. Es zeigten sich typische postoperative Veränderungen. Klinisch-neurologisch zeigte sich eine leichte Hemiparese rechts sowie eine diskrete Sprachstörung, die sich in den nächsten Tagen durch Physiotherapie und Logopädie vollständig zurückbildete.
Neuropathologische Diagnose
Die neuropathologische Aufarbeitung des Tumorgewebes zeigte eine ausgedehnte Formation eines hochgradigen anaplastischen klarzelligen Glioms, histologisch und immunhistochemisch entsprechend einem anaplastischen Oligodendrogliom (CNS WHO Grad 3). Zusätzlich erfolgte eine neuromolekularpathologische Diagnostik. Bei der DNS-Sequenzierung IDH1 (Kodon 132 [Exon 4]) und IHD2 (Kodon 172 [Exon 4)) konnte die Mutation R132H im IDH1-Gen nachgewiesen werden. Die MLPA-Analyse zeigt auf dem Chromosomenarm 19q in 11 der 11 analysierten Loci und auf Chromosomenarm 1p in 16 der 19 analysierten Loci einen Verlust von genetischem Material mit signifikanter Mitbeteiligung der Zentromer-nahen Chromosomenabschnitte auf 1p. Aufgrund dieses Befundes werden die Kriterien eines 1p/19q-Kodeletionsstatus erfüllt. Der MGMT-Promotor weist einen methylierten Status aus. Im Rahmen der integrierten histologisch-neuromolekularpathologischen Diagnostik zeigte sich ein anaplastisches Oligodendrogliom (CNS WHO Grad 3), IDH-mutiert, 1p/19q-kodeletiert, MGMT-Status methyliert, TERT-Status C228T-mutiert.
Abb. 1: Neuroradiologische Abklärung mittels MRT. (A) Auf den T1-gewichteten Sequenzen ist eine geringe Kontrastmittelaufnahme zu sehen.(B)Die T2-gewichteten Sequenzen zeigen den Tumor und die Infiltrationszone.
Abb. 2: FET-PET-MRT. (A) In der T1-gewichteten Sequenz zeigt sich eine deutliche Kontrastmittelaufnahme. (B) Eine deutliche Tracer-Mehrspeicherung ist im FET-PET-MRT im Bereich der Kontrastmittelaufnahme sichtbar.
Erste Vorstellung im Tumorboard und postoperative Therapie
In der interdisziplinären Tumorboard-Besprechung wurde eine postoperative Behandlung mittels Radiochemotherapie mit Temozolomid empfohlen. Der Patient erhielt über sechs Wochen eine Bestrahlung bis 60Gy bei 2Gy pro Fraktion links frontoparietal mittels eines Bestrahlungsplans in VMAT-Technik, maskenimmobilisiert und unter regelmäßiger Lagekontrolle mittels Cone-Beam-CT. Konkomitant zur Bestrahlung erhielt der Patient eine Chemotherapie mit Temozolomid 140mg eine Stunde vor Radiatio. Im Anschluss an die konkomitante Phase wurden sechs Zyklen Temozolomid durchgeführt.
Verlaufskontrollen und zweite Vorstellung im Tumorboard
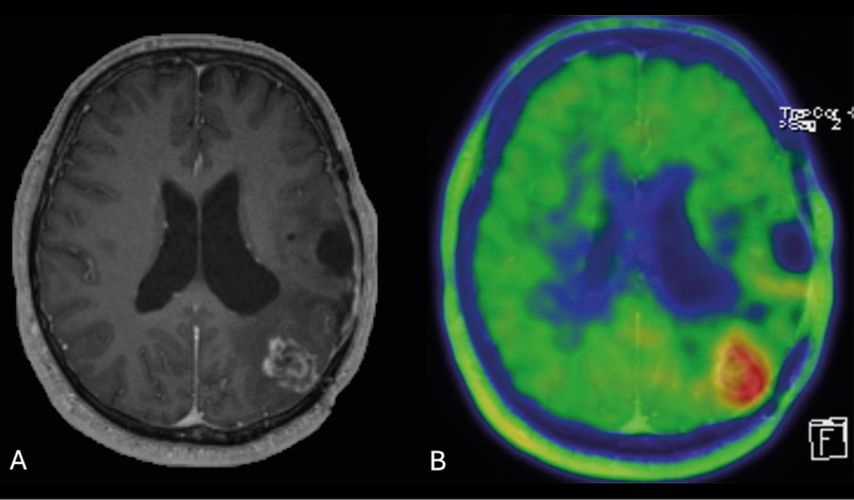
Nach Beendigung der Therapie wurden alle drei Monate MRT-Verlaufskontrollen vorgenommen. Diese waren über drei Jahre stabil ohne Hinweis auf ein Rezidivgeschehen. Etwa 3½ Jahre nach Beendigung der Chemotherapie zeigte sich in einer MRT-Kontrolle eine neue Raumforderung links okzipital mit deutlicher Kontrastmittelaufnahme von ca. 2cm Größe im Abstand von ungefähr 2cm von der ehemaligen Resektionshöhle. Bei Verdacht auf eine Tumorprogression wurde der Patientenfall neuerlich im neuroonkologischen Tumorboard besprochen. Im Tumorboard wurden eine weitere zeitnahe Abklärung mittels FET-PET-MRT und bei Bestätigung einer Progression eine anschließende Resektion empfohlen. Im Rahmen der PET-MRT-Bildgebung mit FET zeigte sich ein deutlich erhöhter Aminosäuretracer-Uptake im Bereich der Läsion und somit bestand der hochgradige Verdacht auf eine Progression. Das Ausmaß der Kontrastmittelanreicherung war deutlich progredient mit einem maximalen Durchmesser von 3,2cm und korrelierte gut mit dem Ausmaß der Tracermehranreicherung. Die Läsion war deutlich hyperperfundiert. Nach den Kriterien von PET RANO 1.0 zeigte sich eine messbare Krankheitsaktivität.
Neurochirurgische Resektion
Wie bereits beim ersten Eingriff erhielt der Patient 5-Aminolävulinsäure (5-ALA) für eine fluoreszenzgestützte Resektion. Die neuerliche Resektion wurde im mittlerweile verfügbaren intraoperativen MRT-OP geplant. Dabei wurde nach Einleitung der Narkose ein präoperatives MRT durchgeführt. Die MRT-Bilder wurden in die Neuronavigation eingespielt und eine automatische Registrierung des Patienten mit der Neuronavigation wurde vorgenommen. Für die Resektion wurde der präexistente Hautschnitt erneut eröffnet und nach medial und basal erweitert. Bereits nach Eröffnung der Dura war der Tumor an der Kortexoberfläche erkennbar. Auch unter Fluoreszenzlicht zeigte sich schon oberflächlich eine starke 5-ALA-Fluoreszenz. Intraoperativ wurde ein histopathologischer Schnellschnitt an die Neuropathologie geschickt, welche einen Verdacht auf ein höhergradiges Gliomgewebe äußerte. Es wurde ausreichend Material für die Histologie entnommen, der Tumor schrittweise ausgesaugt und die Tumorgrenzen wurden präpariert. Es zeigten sich noch klare fluoreszierende Areale, die schrittweise entfernt wurden, bis man schließlich den Eindruck einer kompletten Resektion der fluoreszierenden Anteile hatte. Nach provisorischem Wundverschluss erfolgte eine intraoperative MRT, in der sich nach Rücksprache mit dem zuständigen Neuroradiologen kein größerer solider Kontrastmittel-affiner Resttumor mehr zeigte. Nachdem der Patient zurück in den OP gebracht worden war, wurde die Wunde schichtweise verschlossen. Der Patient wurde auf die neurochirurgische Intensivstation transferiert. Am nächsten Tag erfolgte eine postoperative CT-Kontrolle, welche typische postoperative Veränderungen zeigte. Der Patient konnte in gutem Allgemeinzustand auf die Normalstation transferiert werden.
Neuropathologische Diagnose
Das neurochirurgische Untersuchungsmaterial zeigte Anteile des 2020 operierten Oligodendroglioms, 1p/19q-kodeletiert, CNS WHO Grad 3 mit ausgedehnten Infiltrationen. Im Rahmen der molekulargenetischen Untersuchungen zeigte sich nun im DNA-Methylierungsprofil ein hochgradiges Astrozytom. In der Literatur sind seltene Fälle von IDH-mutierten Gliomen mit dualem Oligodendrogliom-Astrozytom-Genotyp dokumentiert, eine Situation, wie sie eventuell in unserem Fall vorliegen könnte.
Dritte Vorstellung im Tumorboard
Im Zusammenschau mit dem histopathologischen Befund, der einen deutlich erhöhten Proliferationsindex (MIB-1) bis zu 56% aufwies, wurden eine Re-Radiatio und Chemotherapie empfohlen. Um potenzielle alternative Therapiemarker identifizieren zu können, wurde noch um die Erstellung einer molekulargenetischen Diagnostik (TSO-500 und EPIC) gebeten.
Therapieverlauf
Der Patient erhielt eine Radiochemotherapie, bestehend aus einer Bestrahlung links okzipital in VMAT-Technik nach CT-/MRT-gestützter Bestrahlungsplanung und Doppelmaskenimmobilisierung bis zu einer Dosis von 36Gy in 18 Fraktionen zu je 2Gy Einzeldosis und einer oralen Chemotherapie mit Temozolomid (75mg/m2 Körperoberfläche, 150mg). Nach Abschluss der konkomitanten Phase wurde die Indikation zur Maintenance-Therapie mit Temozolomid über sechs Zyklen gestellt und diese unter regelmäßigen MRT-Verlaufskontrollen (alle drei Monate) gestartet.
Autor:innen:
PD Dr. Barbara Kiesel
Assoc. Prof. PD Dr. Georg Widhalm
Universitätsklinik für Neurochirurgie
Universitätsklinikum AKH Wien
E-Mail:
georg.widhalm@meduniwien.ac.at
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...