Mammakarzinom: Was muss ich als Onkolog*in von der Lokaltherapie wissen?
Autorin:
Assoc. Prof. Priv.-Doz. Dr. Ruth Exner, F.E.B.S.
Fachärztin für Allgemein- und Viszeralchirurgie
Universitätsklinik für Allgemeinchirurgie
Klinische Abteilung für Viszeralchirurgie, Wien
E-Mail: ruth.exner@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der Lokaltherapie des Mammakarzinoms hat sich in den letzten Jahren aufgrund genauerer Diagnostik, interdisziplinärer Therapieplanung, zurückhaltender Chirurgie und Strahlentherapie und zunehmender genetischer Testung doch einiges geändert. Das Ergebnis ist ein besseres onkologisches und kosmetisches Outcome. Was für Onkolog*innen wichtig ist, soll hier beleuchtet werden.
Keypoints
-
Exaktes radiologisches Assessment, Biopsie aller suspekten Läsionen und Lymphknoten
-
Genetischer Test, wenn indiziert
-
Interdisziplinäre Therapieplanung durch Vorstellung im Tumorboard
-
Brusterhalt, wenn möglich!
-
Chirurgie in der Axilla immer zurückhaltender
-
Rekonstruktion: zunehmend Sofortrekonstruktion, präpektorale Implantate
-
Radiotherapie: 3 Wochen Standard, bei „low risk“ und älteren Patient*innen 5 Tage
Genaues diagnostisches Assessment und Besprechung im interdisziplinären Tumorboard
Goldstandard der Früherkennung sind nach wie vor die Mammografie und die Sonografie der Brust, in bestimmten Fällen wird als weiterführende Untersuchung eine MRT durchgeführt. Dies ist sinnvoll bei multiplen Herden, ausgedehntem Mikrokalk und unklarem Befund in der konventionellen Bildgebung. Es werden alle suspekten Läsionen biopsiert und auch klippmarkiert, um nach einer eventuellen neoadjuvanten Therapie die ehemals betroffenen Areale lokalisieren zu können. Suspekte Lymphknoten werden zunehmend auch biopsiert und markiert, um bei gutem Ansprechen auf eine neoadjuvante Therapie auch die Chirurgie der Axilla reduzieren zu können.
Wichtig ist bei positiver Familienanamnese und Erfüllung des Risikoprofils auch die Durchführung einer genetischen Beratung. Bei therapeutischer Analyse erhält man bereits nach einigen Tagen den Befund, eine Bestimmung von BRCA1, BRCA2 und eines ganzen Genpanels. Das ist relevant, wenn es um Brusterhaltung geht, und hilft bei der Entscheidung, ob eine oder beide Seiten operiert werden sollen. Bei Patient*innen mit einer BRCA1- oder BRCA2-Mutation kann dann eine beidseitige subkutane Mastektomie mit oder ohne Sofortrekonstruktion besprochen werden.
Chirurgische Techniken
Prinzipiell sollte immer eine brusterhaltende Resektion angestrebt werden. Auch bei multiplen Herden ist das oft durch sorgfältige Markierung aller suspekten und biopsierten Läsionen möglich. Bei ausgedehnten Resektionen kann durch Parenchymadaptationen bzw. -rotationen und onkoplastische Techniken ein gutes kosmetisches Ergebnis erzielt werden. Durch perimamilläre Schnittführung und schonenden Umgang mit dem Gewebe sind Narben oft schon nach kurzer Zeit kaum noch sichtbar.
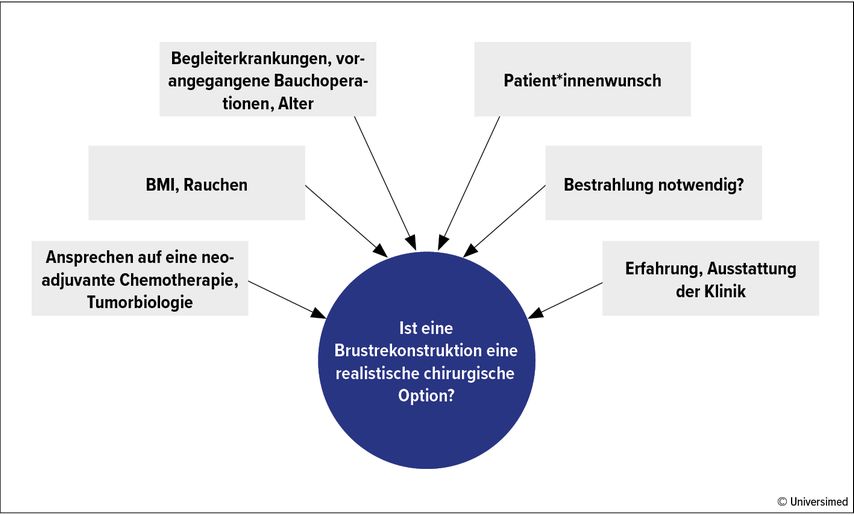
Wenn eine komplette Entfernung der Brust notwendig ist, wird in den letzten Jahren zunehmend eine Sofortrekonstruktion durchgeführt. Hier verwendet man immer mehr präpektorale Silikonimplantate mit gutem kosmetischem Ergebnis. Auch die perioperative Schmerzbelastung der Patient*innen ist durch die Platzierung unter der Haut geringer. Bei ausgedehnteren Resektionen kann auch zunächst ein auffüllbarer Expander hinter dem Musculus pectoralis eingesetzt werden, der erst in einem zweiten Schritt gegen das definitive Silikonimplantat ausgetauscht wird. Das hat den Vorteil, das Volumen schrittweise erhöhen zu können und das Gewebe somit langsam aufzudehnen.
Die autologe Rekonstruktion mittels Latissimus-Lappen wird zunehmend seltener, ein Aufbau vom Unterbauch (TRAM-Lappen) oder vom Schritt führt in erfahrenen Händen plastischer Chirurg*innen zu sehr guten kosmetischen Ergebnissen und subjektiver Zufriedenheit der Patient*innen. Außerdem sind diese Techniken notwendig bei Implantatverlust durch Infektion bzw. Nekrose und bei vorbestrahlter Brust. Voraussetzung dafür ist allerdings das Vorhandensein überschüssigen Gewebes.
Chirurgie der Lymphknoten
Die Axilladissektion Level I und II ist nach den Follow-up-Daten der ACOSOG- Z0011-Studie1 und der AMAROS-Studie2 heute seltener geworden und auch bei positivem Sentinel nur in bestimmten Fällen indiziert, da die Rate axillärer Rezidive niedrig ist und auch das Gesamtüberleben nicht signifikant beeinflusst wird. Nach neoadjuvanter Therapie wird jedoch bei Vorhandensein von Tumorzellen in der Axilla noch immer eine Axilladissektion durchgeführt und nur innerhalb kontrollierter Studien eine „targeted axillary dissection“ empfohlen.3 Durch Biopsie und Klipping der wenigen suspekten Lymphknoten kann nach erfolgter neoadjuvanter Therapie bei pathologischer Komplettremission im Lymphknoten eine komplette Axilladissektion vermieden werden.
Postoperative Strahlentherapie
Die 5-wöchige konventionelle Bestrahlung ist mittlerweile obsolet. Bei brusterhaltender Operation ist die adjuvante Strahlentherapie Standard,4 mit einer deutlichen Verringerung der 10-Jahres-Lokalrezidivrate (um 15,4% bei nodal negativen und 21,2% bei nodal positiven Patient*innen) und der brustkrebsspezifischen 15-Jahre-Mortalität (um 3,3% bei nodal negativen und 8,5% bei nodal positiven Patient*innen).
Goldstandard ist nach dem START-Trial B5, im hypofraktionierten Schema drei Wochen zu bestrahlen (15x2,67Gy, insgesamt 40Gy). Neue Möglichkeiten bietet nach dem englischen FAST-Forward-Trial6 bei niedrigem Risiko und älteren Patient*innen (>60a), nur eine Woche ultrahypofraktioniert (5x5,2Gy, gesamt 26Gy) zu bestrahlen, was den Komfort für die Patient*innen deutlich erhöht. Diese Therapie hat trotz höherer Einzeldosis wenig Nebenwirkungen, wird gut vertragen und sehr gerne angenommen.
Nach Mastektomie ist bei hohem Risiko der Patient*innen eine postoperative Bestrahlung Standard, unabhängig davon, ob oder welche Art der Rekonstruktion durchgeführt wurde. Die Bestrahlung kann auch moderat hypofraktioniert erfolgen.
Zusammenfassung
Exakte Diagnostik, Vorstellung im Tumorboard, interdisziplinäres Management inklusive neoadjuvanter Behandlung und zurückhaltende Chirurgie bestimmen die Lokaltherapie beim Mammakarzinom, sodass bessere onkologische und kosmetische Ergebnisse erzielt und starke Veränderungen in Körperbild, Symmetrie und Selbstwahrnehmung der Patient*innen minimiert werden können.
Literatur:
1 Giuliano A et al.: JAMA 2017; 318(10): 918-26 2 Donker M et al.: Lancet Oncol 2014; 15(12): 1303-10 3 Weber WP et al.: Breast 2021; 60: 98-110 4 Early Breast Cancer Trialists‘ Collaborative Group. Lancet 2011; 378(9804): 1707-16 5 START Trialists´ Group. Lancet 2008; 371(9618): 1098-107 6 Murray Brant A et al.: Lancet 2020; 395(10237): 1613-26
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...