Metastasiertes Mammakarzinom
Autor:
Univ.-Prof. Dr. Michael Seifert
Klinische Abteilung für allgemeine Gynäkologie und gynäkologische Onkologie
Universitätsklinik für Frauenheilkunde
Medizinische Universität Wien
E-Mail: michael.seifert@meduniwien.ac.at
Updates, Follow-ups und Interimsanalysen verschiedener Studien zum metastasierten Mammakarzinom wurden auf dem ASCO-Jahrestreffen 2024 präsentiert. Die Highlights werden im folgenden Artikel zusammengefasst.
PostMONARCH: Abemaciclib+ Fulvestrant vs. Fulvestrant alleine
Prof. Kevin Kalinsky, MD, MS, vom Winship Cancer Institute of Emory University, Atlanta, präsentierte diese Phase-III-Studie für Hormonrezeptor-positive (HR+) Patient:innen nach Progression des Mammakarzinoms nach Therapie mit einer CDK4/6-Inhibitor-Kombination mit einem Aromatasehemmer, die die Patient:innen entweder im adjuvanten oder im metastasierten Setting erhalten hatten.1
368 Teilnehmende wurden zwischen März 2022 und Juni 2023 in diese Studie eingeschlossen und erhielten 1:1 randomisiert entweder Placebo+Fulvestrant (n=186) oder Abemaciclib+Fulvestrant (n=182). Primärer Endpunkt war das vom Untersucher beurteilte progressionsfreie Überleben (PFS), sekundäre Endpunkte waren das PFS, das verblindet und zentral bestimmt wurde (BICR), und das Gesamtüberleben (OS), die objektive Ansprechrate (ORR) und die Sicherheit.
Die Kombination Abemaciclib+Fulvestrant zeigte bei der vom Untersucher durchgeführten primären Analyse nach 258 Ereignissen (117 für Abemaciclib+Fulvestrant und 186 für Fulvestrant) einen signifikanten Vorteil für die Kombination mit einer HR von 0,73 (0,57–0,95; p=0,02) und einer PFS-Rate nach sechs Monaten von 50% vs. 37% zugunsten der Kombinationstherapie. Dieser Effekt zeigte sich in allen relevanten Subgruppen, insbesondere bei Patient:innen mit ESR1- oder PIK3CA-Mutationen. PFS nach unabhängiger Beurteilung (BICR) zeigte ebenso einen Vorteil für Abemaciclib (HR: 0,55; 95% CI: 0,39–0,77). Die Ansprechraten, beurteilt von Untersuchern (RR), betrugen 17% vs. 7% (p=0,0145) und 23% vs. 8% (p=0,0008) zugunsten der Kombination. Das Gesamtüberleben (OS) ist bei einer Rate an Ereignissen von 20,9% noch nicht auswertbar. Die Sicherheitsanalyse zeigte keine neuen Erkenntnisse.
Young-PEARL:neue PFS- und OS-Ergebnisse
Prof. Yeon Hee Park vom Samsung Medical Center, Sungkyunkwan University, Seoul, zeigte Daten der Studie Young-PEARL, einer Phase-II-Untersuchung, in der prämenopausale Frauen mit Hormonrezeptor-positivem und HER2-neu-negativem Brustkrebs nach adjuvanter Gabe von Tamoxifen und Progression der Erkrankung eingebracht wurden.2
Primärer Endpunkt war das PFS, sekundäre Endpunkte waren das OS und die ORR sowie die Toxizität. Eine vorangegangene Chemotherapie war zugelassen. 184 Patient:innen wurden 1:1 randomisiert und erhielten entweder die Kombination aus Palbociclib und Exemestan oder Capecitabin (1250mg/m2 für zwei Wochen, dann eine Woche Pause). Das mittlere Alter betrug 44 Jahre (28–58 Jahre).
Die finale Analyse mit einem mittleren Nachbeobachtungszeitraum von 54,8 Monaten wurde an 174 Patient:innen durchgeführt und zeigte ein verlängertes progressionsfreies Überleben (19,5 Monate für Exemestan+Palbociclib mit GnRH-Agonist [OFS] gegenüber Capecitabin mit 14,0 Monaten; HR: 0,744; p=0,0357). Das mittlere Gesamtüberleben betrug 54,8 Monate für Palbociclib und 57,8 Monate für Capecitabin (HR: 1,021; p=0,919). Die objektiven Ansprechraten waren mit 33,3% vs. 33,7% vergleichbar.
INAVO120: Inavolisib/Placebo+ Palbociclib+Fulvestrant
Dr. Dejan Juric, MD, Medicine-Hematology and Medical Oncology am Massachusetts General Hospital Cancer Center, Boston, präsentierte die Studie INAVO120, in der 325 Patient:innen mit nachgewiesener PIK3CA-Mutation und Hormonrezeptor-positivem und HER2-neu-negativem Brustkrebs, die während oder innerhalb eines Jahres nach Abschluss der adjuvanten endokrinen Therapie Metastasen oder einen lokal fortgeschrittenen Tumor zeigten, entweder Inavolisib mit Palbociclib und Fulvestrant oder Placebo mit Palbociclib und Fulvestrant erhielten.3
Inavolisib, ein hochpotenter und selektiver Hemmer der Alpha-Isoform-Untergruppe des PI3-Komplexes, wurde täglich in einer Dosis von 9mg oral appliziert. Primärer Endpunkt der Studie war das progressionsfreie Überleben (PFS2); zusätzlich wurden weitere Endpunkte wie OS, ORR, Zeit bis zur ersten Chemotherapie (TTFC) und Nebenwirkungen erhoben.
Nach einer medianen Nachbeobachtungszeit von 21,3 Monaten zeigte sich das progressionsfreie Überleben unter Inavolisib signifikant verlängert mit einer HR von 0,59 (95% CI: 0,42–0,83). Die Zeit bis zur ersten Chemotherapie war ebenfalls länger (NE vs. 15,0 Monate; unstratified HR: 0,53 [95% CI: 0,37–0,78]). Hyperglykämien, Diarrhö, Stomatitis und Hautveränderungen waren in der Inavolisib-Gruppe häufiger, jedoch gut beherrschbar. Eine Patientin brach die Inavolisib-Therapie wegen Stomatitis ab. Andererseits war die Lebensqualität in dieser Therapiegruppe bezüglich Schmerzen und Beeinträchtigung der täglichen Aktivitäten verbessert.
SACI-IO HR+: Sacituzumab-Govitecan +/– Pembrolizumab
Dr. Ana Christina Garrido-Castro, MD, vom Dana-Farber Cancer Institute, Boston, präsentierte Ergebnisse einer Phase-II-Studie, in der 110 Patient:innen bei Hormonrezeptor-positivem (HR+, ER≥1% und/oder PR≥1%), HER2-neu-negativem metastasiertem oder lokal fortgeschrittenem Brustkrebs unabhängig von einer PDL-1-Mutation randomisiert die Kombination aus Pembrolizumab (200mg IV [d1], q21d) und Sacituzumab-Govitecan (SG; 10mg/kg IV [d1, d8]) oder lediglich Sacituzumab-Govitecan erhielten.4
Alle Patient:innen hattenim metastasierten Stadium bereits mindestens eine endokrine Therapie und maximal eine Chemotherapie erhalten. Patient:innen mit Hirnmetastasen waren in dieser Studie zugelassen, falls die lokale Therapie abgeschlossen war und Steroide für mindestens sieben Tage abgesetzt waren. Primärer Endpunkt war das PFS, sekundäre Endpunkte waren das PFS in der PD-L1-Subgruppe, das OS und die ORR sowie die Toxizität.
Das mittlere Alter betrug 57 Jahre (27–81), 102 der Teilnehmenden waren weiblich (98,1%), 80 (76,9%) hatten zuvor einen CDK4/6-Inhibitor in der metastasierten Phase erhalten, 46 (44,2%) waren chemotherapienaiv.
Nach einem medianen Nachbeobachtungszeitraum von 9,2 Monaten betrug das mediane PFS 8,4 Monate im Kombinationsarm und 6,2 Monate im Monotherapiearm (HR: 0,76 [0,47–1,23, p=0,26]); die ORR betrug 21,2% und 17,3%. Das progressionsfreie Überleben war, unabhängig vom PD-L1-Status, in beiden Therapiearmen vergleichbar (PD-L1-positiv: 11,05 und 6,68 Monate; HR: 0,62 [0,29–1,36; p=0,23]; PD-L1 negativ: 5,36 und 5,07 Monate; HR: 1,06 [0,59–1,90, p=0,84]) und die Berechnung des OS war wegen lediglich 26 Todesfällen verfrüht (16,9 bzw. 17,1 Monate; HR: 0,65 [0,30–1,41, p=0,28]) und nicht unterschiedlich.
Der Kombinationsarm zeigte im Vergleich zum Monotherapiearm folgende Toxizität (≥G2):
-
Neutropenie (69,2% und 59,6%)
-
Müdigkeit (38,5% und 34,6%)
-
Haarverlust (42,3% und 38,5%)
-
Anämie (34,6% und 26,9%)
-
Leukopenie (26,9% und 15,4%)
-
Diarrhö (23,1% und 38,5%)
-
Übelkeit (28,8% und 32,7%)
EV-202: Enfortumab-Vedotinbei TNBC und HR+/HER2– neu negativ
Dr. Antonio Giordano vom Dana-Farber Cancer Institute, Boston, zeigte Daten einer Kohorte von Brustkrebspatient:innen innerhalb der EV-202-Studie, die verschiedene metastasierte und lokal fortgeschrittene solide Tumoren umfasst.5
Enfortumab-Vedotin (EV) ist ein Nectin-4–gerichtetes Antikörper-Wirkstoff-Konjugat (ADC). Nectin-4 wird in zahlreichen soliden Tumoren exprimiert. Die vorliegende Untersuchung beschreibt Ergebnisse der EV-Monotherapie für tripelnegativen (TNBC) und Hormonrezeptor-positiven und HER-neu-negativen Brustkrebs. Die HR-positiven Patient:innen hatten aufgrund vonmetastasiertem oder lokal fortgeschrittenem Brustkrebs bereits einen CDK4/6-Inhibitor erhalten, tripelnegative Patient:innen eine oder zwei Chemotherapien und zusätzlich gegebenenfalls eine Therapie mit einem PD-L1/PD-1-Inhibitor.
Die Teilnehmer:innen erhielten EV 1,25mg/kg intravenös an den Tagen 1, 8 und 15 in einem 28-tägigen Zyklus bis zu Progression oder Abbruch wegen Toxizität. Als primärer Endpunkt war die ORR definiert. Sekundäre Endpunkte umfassten die Dauer des Ansprechens (DOR), die Krankheitskontrollrate (DCR), das PFS, das OS und die Toxizität.
Die Ansprechrate betrug für die 45 HR+/HER2– Patient:innen 15,6% und für die 42 tripelnegativen Patient:innen 19,0%; DCR: 51,1% und 57,1%. Die Dauer des Ansprechens betrug für HR+/HER2– Patient:innen durchschnittlich 7,23 Monate und für Frauen mit TNBC 3,78 Monate. Das mediane Gesamtüberleben betrug 19,75 Monate (HR+/HER2–) und 12,91 Monate (TNBC). Als Nebenwirkungen wurden Hautreaktionen, periphere Neuropathie und Hyperglykämie berichtet.
TROPION-Breast01: Datopotamab-Deruxtecan vs. Chemotherapie
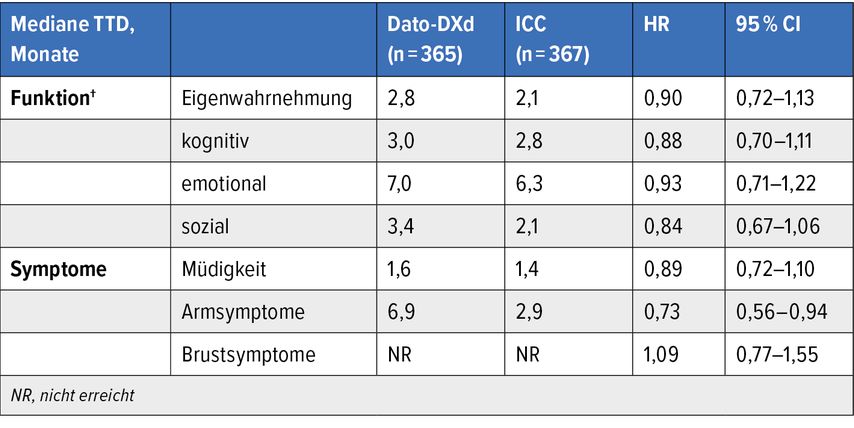
Dr. Sonia Pernas, MD, vom Institut Català d’Oncologia, IDIBELL, L’Hospitalet, Barcelona, berichtete Ergebnisse der Studie TROPION-Breast01 (Tab. 1). In dieser Phase-III-Studie erhielten 732 Patient:innen mit metastasiertem oder lokal fortgeschrittenem Hormonrezeptor-positivem, HER2-neu-negativem Brustkrebs nach ein bis zwei Linien Chemotherapie in diesem Setting und nach endokriner Therapie randomisiert Datopotamab-Deruxtecan (Dat-DXd, 6mg/kg q21d) oder eine Chemotherapie (Eribulin/Vinorelbin/Capecitabin/Gemcitabin).6
Tab. 1: TROPION-Breast01: Datopotamab-Deruxtecan vs. Chemotherapie (modifiziert nach Pernas S et al.)6
Primärer Endpunkt waren das PFS und das OS, sekundäre Endpunkte waren unter anderem die PRO, ein Sammelbegriff, der von Patient:innen genannte therapie- und krankheitsbedingte Nebenwirkungen und die Beeinträchtigung der Lebensqualität umfasst. Diese letztgenannten Daten wurden in einer primären Analyse präsentiert.
In der Dato-DXd-Population war die Zeit bis zur Verschlechterung („time to deterioration“ [TTD]) von physikalischer Aktivität und Schmerz und den meisten anderen die Lebensqualität beeinflussenden Faktoren länger als in der Chemotherapie-Gruppe.
JBCRG-M06/EMERALD
Dr. Toshinari Yamashita, MD, vom Kanagawa Cancer Center, Kanagawa, zeigte Daten der Studie EMERALD-3, einer multizentrischen Phase-III-Nichtunterlegenheits-Studie, in der HER2-neu-positive Patient:innen mit lokal fortgeschrittenem oder metastasiertem Brustkrebs als Erstlinientherapie entweder eine taxanbasierte Chemotherapie (Docetaxel 75mg/m2 am Tag 1 oder Paclitaxel 80mg/m2 an den Tagen 1, 8 und 15) oder eine Therapie mit Eribulin (1,4mg/m2 an den Tagen 1 und 8) alle 21 Tage und jeweils in Kombination mit Trastuzumab und Pertuzumab erhielten.7
Als primärer Endpunkt galt das PFS, sekundäre Endpunkte waren das OS, die Lebensqualität (QoL) und die Sicherheit. In der Studie wurden zwischen 2017 und 2021 446 Patient:innen mit einem mittleren Alter von 56 Jahren (29–70) 1:1 randomisiert, 54% waren Hormonrezeptor-positiv, 63% hatten viszerale Metastasen, 55,4% hatten primäre Metastasen, 44,6% wurden primär operiert und 30,9% hatten bereits perioperativ ein Taxan erhalten.
Das mediane PFS betrug 14,0 Monate im Studienarm und 12,9 Monate im Vergleichsarm (HR: 0,96; 95% CI: 0,77–1,20), dies entsprach den Nichtunterlegenheitskriterien. Das mediane Gesamtüberleben betrug 65,3 Monate im Vergleichsarm, das Gesamtüberleben im Studienarm wurde noch nicht erreicht. Nebenwirkungen wie febrile Neutropenie Grad ≥3, Diarrhö und Ödeme waren in der Studiengruppe seltener als im Standardarm (4,9% vs. 8,7%, 8,5% vs. 42,2% und 36,6% vs. 54,1%).
PATRICIA: Ergebnisse aus Kohorte C
Dr. Eva Ciruelos vom Hospital 12 de Octubre, Instituto de Investigación Sanitaria Hospital 12 de Octubre, Madrid, zeigte Daten der Studie PATRICIA (Cohort C), einer multizentrischen Phase-II-Studie mit luminal positiven, HER2-neu-positiven Patient:innen, die bereits mit mindestens einer HER2-gerichteten Therapie vorbehandelt waren und entweder randomisiert 1:1 Palbociclib mit Trastuzumab und endokrine Therapie (Palbociclib 125mg/Tag oral für 3 Wochen/1 Woche Pause+Trastuzumab+endokrine Therapie) erhielten oder TPC („treatment of physician’s choice“). Primärer Endpunkt war das PFS.8
Es sollten 102 Patient:innen für die Studie rekrutiert werden, eingeschlossen werden konnten jedoch nur 73. Jeweils 50% der Teilnehmer:innen erhielten Fulvestrant bzw. einen Aromatasehemmer als endokrine Therapie, 37,1% wurden mit TDM-1 behandelt, 45,7% mit Chemotherapie und Trastuzumab und 11,4% mit endokriner Therapie und Trastuzumab.
Die Kombination von Palbociclib+Trastuzumab mit endokriner Therapie zeigte ein verlängertes PFS im Vergleich zur Therapie nach Wahl der behandelnden Ärzt:innen (median 9,1 vs. 7,5 Monate; HR: 0,52 [95% CI: 0,29–0,94]; 2-sided p=0,031), das PFS über zwölf Monate betrug 43,7% und 21,4%. Ebenso waren die Ansprechraten (ORR) im Studienarm mit 18,9% (95% CI: 8,6–35,7) und 8,3% (95% CI: 1,4–28,5) besser als im Vergleichsarm.
Nebenwirkungen von Grad ≥3 traten häufiger im experimentellen Arm auf, insbesondere Neutropenien von Grad 3 oder 4 mit 53,8% und lediglich mit 15,6% im Vergleichsarm.
DESTINY-Breast07: Interimsanalyse
Dr. Fabrice André, MD, vom Institut Gustave Roussy, Université Paris-Saclay, präsentierte Ergebnisse einer Interimsanalyse der Studie DESTINY-Breast07, einer Phase-Ib/II-Studie, in der die Sicherheit und Tolerabilität sowie die Antitumor-Aktivität von T-Dxd als Monotherapie (T-DXd 5,4mg/kg i.v. alle drei Wochen) und in Kombination mit Pertuzumab (420mg i.v. alle drei Wochen mit einer initialen Dosis von 840mg als „loading dose“) als Erstlinientherapie in der metastasierten Phase untersucht wurde.9
Bei allen Teilnehmer:innen betrug der Abstand zur vorangegangenen HER2-gerichteten Therapiemindestens zwölfMonate. Taxane, Trastuzumab und Pertuzumab waren im neoadjuvanten oder adjuvanten Setting erlaubt. Primärer Endpunkt waren Sicherheit und Verträglichkeit, sekundäre Endpunkte ORR, PFS und DOR. 64% im T-DXd-Monotherapie-Arm hatten primäre Metastasen im Vergleich zu 60% im T-DXd+Pertuzumab-Arm, 62,7% bzw. 68,0% waren Hormonrezeptor-positiv. 75 Patient:innen erhielten T-DXd als Monotherapie und 50 die Kombination mit Pertuzumab. Das mittlere Alter betrug 57 Jahre.
Toxizitäten von Grad ≥3 traten mit 52,0% im Monotherapie-Arm und mit 62% im Kombinationsarm auf. 10,7% bzw. 16% der Nebenwirkungen führten zur Beendigung der Medikation. Pneumonitis von Grad 2 (2,7% bzw. 0%) und Grad 3 (0% und 2%) war selten. Übelkeit (71% bzw. 68%) und Erbrechen (36% und 40%) waren in beiden Gruppen vergleichbar häufig. Neutropenie von Grad 3 war in beiden Gruppen mit 27% und 24% ebenso vergleichbar. Diarrhö war signifikant seltener im Monotherapie-Arm mit 35% im Vergleich zu 62% im Kombinationsarm. Diarrhö von Grad 3 war mit 3% und 6% jedoch selten.
Die Rate des progressionsfreien Überlebens nach zwölf Monaten betrug 80,8% im Monotherapie-Arm und 89,4% im Kombinations-Arm, die DOR-Rate betrug 76,0% bzw. 84,0% und die Gesamtüberlebensrate 76,0% und 84,0%.
Literatur:
1 Kalinsky K et al.: Abemaciclib plus fulvestrant vs fulvestrant alone for HR+, HER2- advanced breast cancer following progression on a prior CDK4/6 inhibitor plus endocrine therapy: Primary outcome of the phase 3 postMONARCH trial. ASCO 2024; Abstr. LBA 1001 2 Park YH et al.: Palbociclib plus exemestane with GnRH agonist vs capecitabine in premenopausal patients with HR+/HER2- metastatic breast cancer: Updated survival results of the randomized phase 2 study Young-PEARL. ASCO 2024; Abstr. #1002 3 Juric D et al.: First-line inavolisib/placebo + palbociclib + fulvestrant (Inavo/Pbo+Palbo+Fulv) in patients (pts) with PIK3CA-mutated, hormone receptor-positive, HER2-negative locally advanced/metastatic breast cancer who relapsed during/within 12 months (mo) of adjuvant endocrine therapy completion: INAVO120 Phase III randomized trial additional analyses. ASCO 2024; Abstr. #1003 4 Garrido-Castro AC et al.: SACI-IO HR+: A randomized phase II trial of sacituzumab govitecan with or without pembrolizumab in patients with metastatic hormone receptor-positive/HER2-negative breast cancer. ASCO 2024; Abstr. #1004 5 Giordano A et al.: Enfortumab vedotin (EV) in triple-negative breast cancer (TNBC) and HR+/HER2- breast cancer (BC) cohorts of EV-202. ASCO 2024; Abstr. #1005 6 Pernas S et al.: Datopotamab deruxtecan (Dato-DXd) vs chemotherapy (CT) in previously treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Patient-reported outcomes (PROs) from the TROPION-Breast01 study. ASCO 2024; Abstr. #1006 7 Yamashita T et al.: Trastuzumab and pertuzumab in combination with eribulin mesylate or a taxane as first-line chemotherapeutic treatment for HER2-positive, locally advanced or metastatic breast cancer: Results of a multicenter, randomized, non-inferiority phase 3 trial in Japan (JBCRG-M06/EMERALD). ASCO 2024; Abstr. #1007 8 Ciruelos E et al.: Primary results from PATRICIA cohort C (SOLTI-1303), a randomized phase II study evaluating palbociclib with trastuzumab and endocrine therapy in pretreated HER2-positive and PAM50 luminal advanced breast cancer. ASCO 2024; Abstr. #1008 9 André F et al.: DESTINY-Breast07: Dose-expansion interim analysis of T-DXd monotherapy and T-DXd + pertuzumab in patients with previously untreated HER2+ mBC. ASCO 2024; Abstr. #1009
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...