Neuroendokrine Tumoren
Bericht:
Dr. Corina Ringsell
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das aktuelle Cancer Update des Comprehensive Cancer Center Vienna bot einen umfassenden Überblick über Pathologie, Diagnostik und Therapie neuroendokriner Neoplasien (NEN). Der zweite Teil der Fortbildung widmete sich dem Schilddrüsenkarzinom, das in einer der nächsten Ausgaben von JATROS Hämatologie & Onkologie thematisiert wird. Durch die Veranstaltung führten Ap. Prof. Barbara Kiesewetter-Wiederkehr und Univ.-Prof. Christian Scheuba.
Unverzichtbar: die Pathologie
Univ.-Prof. Peter Mazal, Klinisches Institut für Pathologie, MedUni Wien/Universitätsklinikum AKH Wien, leitete das Thema mit Key Facts aus der Pathologie der neuroendokrinen Neoplasien (NEN) ein. NEN entstehen aus neuroendokrinen Zellen, die überall im Körper vorkommen. Sie umfassen zwei embryologisch determinierte Gruppen: Die epithelialen NEN mit epithelialem Immunphänotyp sind stark mit anderen Karzinomen und Adenomen verwandt. Die neuroektodermalen NEN sind dagegen eher mit Tumoren der Nervenzellen vergleichbar.
Bei den epithelialen NEN werden zwei Tumorfamilien unterschieden, die höher differenzierten neuroendokrinen Tumoren (NET) und die niedrig diffenzierten neuroendokrinen Karzinome (NEC). Diese werden wiederum unterteilt in SCNEC („small cell NEC“) und LCNEC („large cell NEC“). NEC treten bevorzugt in der Lunge auf, gefolgt von der Haut und dem Urogenitaltrakt. Im Gegensatz zu den NET sollte bei den NEC heutzutage kein Grading mehr angegeben werden.
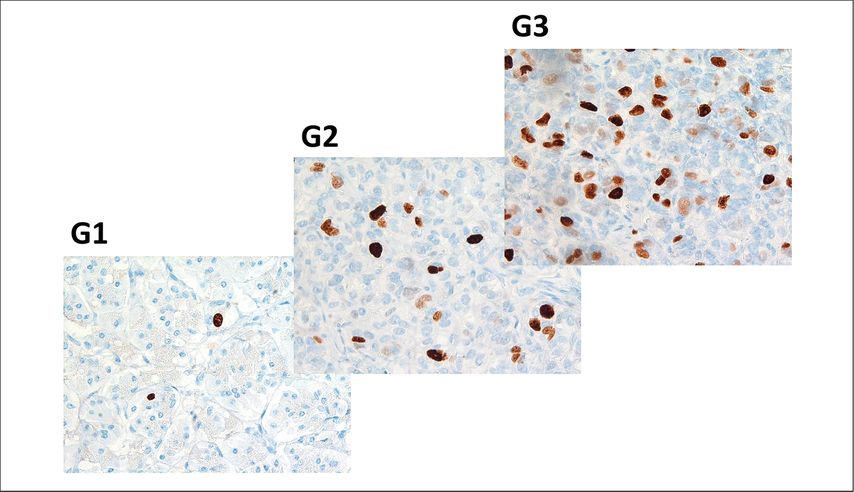
Obwohl NET überall im Körper auftreten können, wo neuroendokrine Zellen vorkommen, finden sie sich sehr oft (ca. 75%) gastrointestinal und im Pankreas (GEP-NET); etwa 20% entstehen in der Lunge. Das Grading der NET (G1–G3) wurde zunächst für GEP-NET etabliert und beruht auf dem Proliferationsindex (Ki-67-Index). Dabei bedeutet NET G1, dass der Ki-67-Index <3% der Tumorzellen beträgt, bei NET G2 liegt er bei 3–20% und bei NET G3 >20% (Abb. 1). Dieses System solle nach und nach auf NET in anderen Organsystemen übertragen werden, sagte Mazal.
Abb. 1: Der ki-67-Index zeigt deutlich die unterschiedlich hohe Proliferation bei G1-, G2- und G3-NET
Da NET und NEC unterschiedliche Mutationsmuster zugrunde liegen, findet in der Regel kein Übergang von NET zu NEC statt. Gemeinsam ist beiden, dass sie typische Markerprofile und einen typischen histomorphologischen Phänotyp besitzen. Mit einer Inzidenz von 2–5/100000/Jahr sind sie sehr selten, haben aber alle malignes Potenzial.
Biochemische Diagnostik
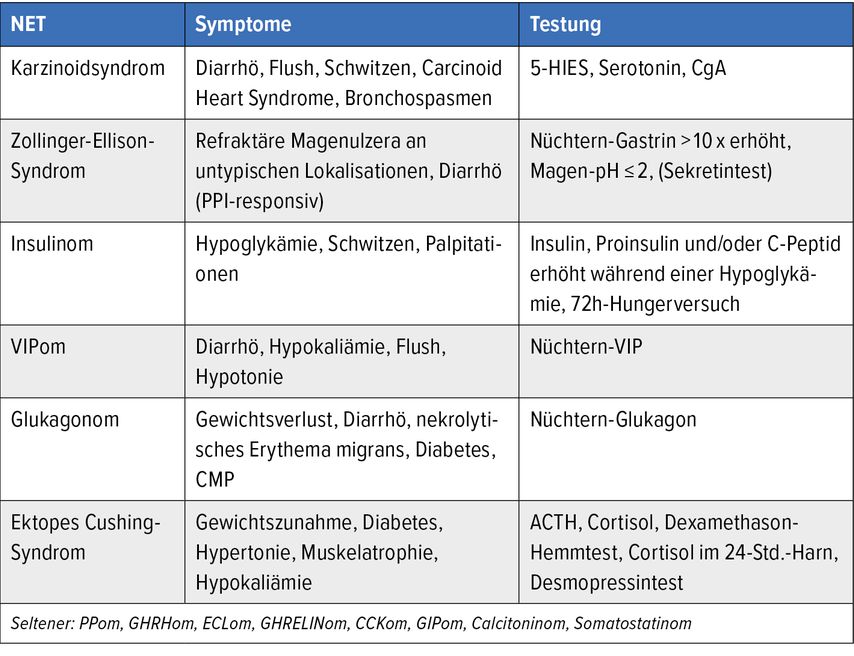
Prof. Marie Helene Schernthaner-Reiter, Universitätsklinik für Innere Medizin III/Universitätsklinikum AKH Wien, klärte über die biochemische Diagnostik von NET auf. Unterschieden werden hormonaktive und hormoninaktive NET. Hormonaktive NET machen etwa 20% aus und verursachen typische Symptome. Hier erfolge die biochemische Testung in Abhängigkeit von der Symptomatik, sagte die Endokrinologin. Einen Überblick gibt Tabelle 1. Einer der wichtigsten biochemischen Parameter ist die 5-Hydroxyindolessigsäure (5-HIES; Infobox).5 Ein unspezifischer, dennoch wichtiger neuroendokriner Marker ist das Chromogranin A, das nicht zum Screening, sondern eher zur Verlaufsbeobachtung bei bekanntem NET geeignet ist (Infobox).6
Tab. 1: Testung bei hormonaktiven/symptomatischen NET (modifiziert nach Hofland J 2022, Manneh Kopp R 2022, Pavel M 2020, Hofland J 2023)1–4
Die Mehrzahl der NET sind jedoch nicht hormonaktiv und verursachen daher unspezifische Beschwerden infolge des Tumorwachstums, beispielsweise Bauchschmerzen, Ileus, gastrointestinale Blutungen oder rezidivierende Pneumonien. Oft seien sie Zufallsbefunde bei Endoskopien oder bildgebenden Untersuchungen, sagte Schernthaner-Reiter. Die biochemischen Untersuchungen richten sich dabei nach der Tumorlokalisation.1,2 Diese Parameter sind ebenfalls für Verlaufsbeobachtungen geeignet. Eine Ausnahme sind bekannte Tumorprädispositionen wie die multiple endokrine Neoplasie Typ 1, für die es spezifische Screeningempfehlungen gibt.
Schernthaner-Reiter ging auch auf die genetische Testung ein. Etwa 17% der panNET seien genetisch bedingt, sagte sie. Anzeichen für eine genetische Ursache seien multiple NET im selben oder in verschiedenen Organen, ein Erkrankungsalter unter 40 Jahren und eine positive Familienanamnese.2,3 Bei der multiplen endokrinen Neoplasie Typ 1 (MEN1) und Typ 4 (MEN4) treten primärer Hyperparathyreoidismus, panNET, lungNET, thymusNET, Hypophysenadenome und Nebennierentumoren auf. Allerdings warnte die Endokrinologin davor, bei einer negativen Familienanamnese MEN1 auszuschließen. Etwa 10% der MEN1 beruhten auf Neumutation, betonte sie.
5-Hydroxyindolessigsäure (5-HIES)
Abbauprodukt von Serotonin
Bestimmung durch 24-Stunden-Sammlung von angesäuertem Harn
vor Sammlung des Harns 48 bis 72 Stunden auf bestimmte Nahrungsmittel und Medikamente verzichten, da sie die Testergebnisse verfälschen
Nahrungsmittel: z.B. Avocados, Tomaten, Bananen, Pflaumen, Walnüsse, Kaffee und Alkohol sowie Nikotin
Medikamente: u.a. ASS, Paracetamol, MAO-Hemmer, L-Dopa etc.
Fallstricke des chirurgischen Managements
Assoc. Prof. Philipp Riss, Universitätsklinik für Allgemeinchirurgie/AKH Wien, erläuterte, worauf es bei der chirurgischen Behandlung der NET ankommt. Grundsätzlich seien radikales chirurgisches Vorgehen, eine adäquate Lymphadenektomie und die Suche nach eventuellen Zweittumoren angezeigt, sagte er.
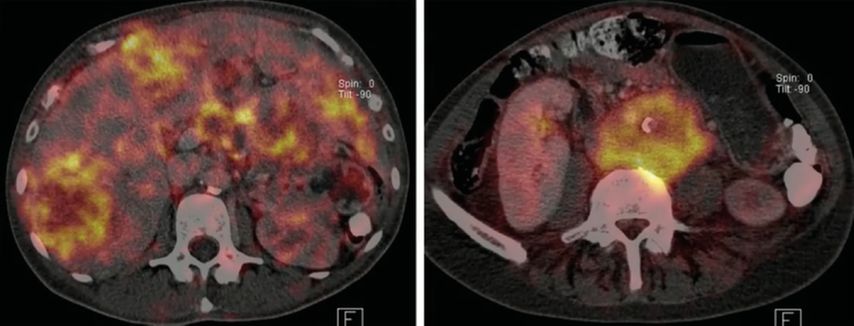
Für den Erfolg der Operation sind Tumorpathologie, Bildgebung (Gallium-PET/CT, FDG-PET/CT, Abb. 2) und die Bestimmung von Tumormarkern (z.B. 5-HIES, Chromogranin A) essenziell.7 Die Pathologie bestimme, welche Parameter untersucht werden, sagte Riss. Außerdem müsse er wissen, welche Stoffe der Tumor produziert, zum Beispiel Insulin, Serotonin etc., denn dies beeinflusse die OP-Vorbereitung und das intraoperative Management. Die am häufigsten auftretenden NET im Dünndarm produzieren Serotonin und können, vor allem im fortgeschrittenen Stadium mit Lebermetastasen, zu einer Serotoninkrise führen.7 Dies kann auch intraoperativ infolge der Manipulation am Tumor geschehen und dramatische Folgen wie Tachykardie, Hypotonie und Flush haben.7 Die Beatmung wird aufgrund eines Bronchospasmus ebenfalls schwieriger. Die Gabe eines Somatostatin-Analogons einen Tag vor dem Eingriff kann möglicherweise diese Komplikationen verhindern. Eine ausreichende Evidenz dafür liege nicht vor, erklärte Riss. Intraoperativ wird die Karzinoidkrise mit hoch dosiertem (500µg/h) Octreotid behandelt.8
Abb. 2: Die Bildgebung, hier ein FDG-PET/CT, liefert den Chirurg:innen wertvolle Hinweise für die Operation von NET
Nicht zuletzt ist auch die kardiovaskuläre Situation der Patient:innen wichtig, um zu klären, ob eine karzinoide Herzkrankheit (CHD) vorliegt. Diese geht mit fibrotischen Plaques an den Herzklappen und im Lumen des rechten Ventrikels einher. Die CHD kommt bei mehr als 50% der Patient:innen mit Karzinoidsyndrom vor, ist aber oft asymptomatisch. Diagnostiziert wird sie mittels Kardioechografie. Einen Hinweis geben auch hohe 5-HIES-Werte im 24-Stunden-Harn und mehr als drei Flush-Episoden pro Tag. Der Marker Chromogranin A ist dagegen nur relevant, wenn er positiv ist, denn dann weist er auf die Tumorlast hin.7
Systemische Therapie: meistpalliativ
Die systemische Therapie zur Behandlung von NET stellte Univ.-Prof. Markus Raderer, Klinische Abteilung für Onkologie, Universitätsklinik für Innere MedizinI/AKH Wien, vor. Therapieziele sind:
-
Tumorwachstum hemmen
-
Symptome lindern
-
Komplikationen verhindern
-
Überleben verlängern
-
Lebensqualität erhalten
Wie der Chirurg Riss, so betonte auch der internistische Onkologe Raderer die Bedeutung der Pathologie für die Therapie. Und während die Chirurg:innen die Tumoren entfernen und die Patient:innen heilen könnten, seien systemische Maßnahmen eine palliative Behandlung, so Raderer. Daher sei es nicht angezeigt, nach einer kompletten Tumorresektion eine adjuvante Therapie zu geben. Dies verursache nur Nebenwirkungen, ohne das Leben der Betroffenen zu verlängern.
Ist eine systemische Therapie jedoch angebracht, dann entscheiden die Art und der Differenzierungsgrad des NET über die Behandlung. Die ESMO-Guidelines zeigen die verschiedenen Behandlungspfade auf:9 In den Stadien G1 und G2 werden in der Erstlinie Somatostatin-Analoga (SSA) empfohlen.9 Ursprünglich wurden sie zur symptomatischen Therapie des Karzinoidsyndroms eingesetzt. In Studien zeigte sich jedoch, dass sie im Vergleich zu Placebo auch das progressionsfreie (PFS) und das Gesamtüberleben (OS) bei NET verlängern.10,11 Raderer wies darauf hin, dass sie zum Eindämmen des Tumorwachstums immer in der höchsten zugelassenen Dosierung verabreicht werden müssen. Darüber hinaus sind SSA auch in der Therapie des Karzinoidsyndroms etabliert. Allerdings lässt die Wirkung nach 18 bis 24 Monaten nach. In solchen Fällen können Telotristat oder Ondansetron als Add-on gegeben werden.
Für Patient:innen mit wenigen Somatostatinrezeptoren oder mit KI-67 >10% steht der mTOR-Inhibitor Everolimus zur Verfügung.12 NET-G3-Tumoren werden mit einer Kombination aus Capecitabin und Temozolomid behandelt, wobei PFS und OS kürzer sind als in den Stadien G1/G2.
Chromogranin A
nicht als Screening-Parameter geeignet
zur Verlaufsbeobachtung bei diagnostiziertem NET
erhöht bei GEP-NET, LungNET, medullären Schilddrüsenkarzinomen, Nebenschilddrüsenadenomen, Phäochromozytomen
erhöht bei Gastrinomen (100%), siNET (80%), hormonaktiven panNET (69%), MTC (50%)
bei 30–50% der NET im Normbereich
falsch positiv bei A-Gastritis, PPI-Einnahme, Niereninsuffizienz, M. Crohn, Colitis ulcerosa, rheumatoider Arthritis, M. Parkinson, Herzinsuffizienz, unkontrollierter Hypertonie, Steroidtherapie
PPI sollten vor Testung mindestens 7 Tage pausiert werden.
H2-Blocker 24 Stunden vor Testung pausieren
Während es bei den NET Fortschritte in der systemischen Therapie gab, hat sich beim NEC laut Raderer in den vergangenen 40 Jahren kaum etwas verändert. „Das NEC ist ein Killer mit einer Lebenserwartung von sieben Monaten“, betonte er. Hier ist der Standard noch immer Platin/Etoposid. Zweitlinientherapien seien wenig erfolgversprechend und hätten lediglich eine Ansprechdauer von zwei bis drei Monaten, erklärte der Onkologe.
Die Rolle der Peptidrezeptor-Radiotherapie (PRRT)
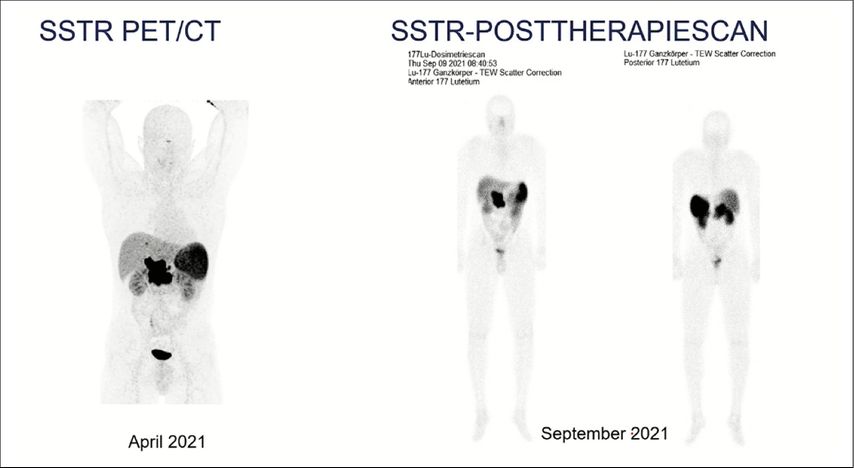
Dr. Elisabeth Kretschmer-Chott, Universitätsklinik für Radiologie und Nuklearmedizin/AKH Wien, beantwortete in ihrem Vortrag die Fragen, wer wann und wo eine Peptidrezeptor-Radiotherapie (PRRT) bekommen sollte. „Nuklearmedizin ist Theranostik“, sagte sie und erklärte diesen Kunstbegriff aus Therapie, Diagnostik und Gnosis (Wissen). So können mit dem [68Ga]-Gallium-DOTA-NOC-PET/CT Somatostatinrezeptor-positive Tumoren visualisiert werden und durch Austausch des Positronenstrahlers gegen den β-Strahler 177Lutetium mit [177Lu]-DOTA-TATE die Therapie erfolgen. [177Lu] emittiert zusätzlich ca. 10% γ-Strahlen. Dies wird genutzt, um 24 bis 48 Stunden nach der Therapie einen Post-Therapie-Scan anzufertigen (Abb. 3.)
Abb. 3: Links: ein Patient mit einem NET des Pankreas, der in die Leberpforte einwächst; rechts: Post-Therapie-Scan des Patienten nach der Radionuklidbehandlung (mit Lutetium-177-DOTA-TATE)
Wer erhält eine PRRT?
Die PRRT oder Radioligandentherapie ist geeignet für Patient:innen mit Somatostatinrezeptor-positiven NET. Voraussetzungen sind eine ausreichende Nierenfunktion (GFR mind. 30ml/min, besser 40ml/min), eine ausreichende Knochenmarkreserve sowie eine Lebenserwartung von mindestens drei Monaten. Besonders wichtig aus strahlenhygienischen Gründen sei, dass die Patient:innen selbstständig und mobil sind, da sie durch die Therapie zur Strahlenquelle werden, betonte Kretschmer-Chott.
Wann ist eine PRRT indiziert?
Die PRRT wird unter anderem eingesetzt in der Erstlinie bei kolorektalen NET G1/G2 mit hoher Tumorlast, in der Zweitlinie bei midgutNET G1/G2 (Ki-67 <10%), panNET G2 (Ki-67 >10%) sowie bei kolorektalen NET G1/G2 mit geringer Tumorlast, außerdem in der Drittlinie bei panNET G1/G2 (Ki-67 <10%) und panNET G3 (Ki-67 >20%).
Wo wird mit PRRT behandelt?
Die PRRT kann ausschließlich in spezialisierten nuklearmedizinischen Therapieeinrichtungen verabreicht werden. An der Universitätsklinik für Radiologie und Nuklearmedizin/AKH Wien wird sie als Infusion über 15 Minuten gegeben. Anschließend wird eine Aminosäuren-Koinfusion verabreicht, um die potenzielle Nephrotoxizität des Medikaments zu mindern.
Dieser Vortrag rundete den Einblick in eine ebenso seltene wie interessante Entität ab, deren Diagnostik und Therapie in die Hände von darin erfahrenen Ärzt:innen gehört.
Abb. 4: Freuen sich über einen gelungenen Fortbildungsabend (v.l.): Dr. Elisabeth Kretschmer-Chott, Dr. Philipp Melhorn, Prof. Marie Helene Schernthaner-Reiter, Dr. Teresa Binter, Assoc. Prof. Philipp Riss, Dr. Oana Kulterer, Prof. Barbara Kiesewetter-Wiederkehr, Prof. Christian Scheuba, Prof.Markus Raderer, Prof. Peter Mazal
Quelle:
CCC Vienna Cancer Update: Neuroendokrine Tumoren und Schilddrüsenkarzinome, 21. Mai 2024 (hybrid)
Literatur:
1 Hofland J et al.: Endocr Rev 2020; 41(2): 371-403 2 Manneh Kopp R et al.: Cancers (Basel) 2022; 14(10): 2514 3 Pavel M et al.: Ann Oncol 2020; 31(7): P844-60 4 Hofland J et al.: J Neuroendocrinol 2023; 35(8): e13318 5 Kocha W et al.: Curr Oncol 2010; 17(3): 49-64 6 Gut P et al.: Arch Med Sci 2016; 12(1): 1-9 7 Rinke A et al.: Z Gastroenterol 2018; 56: 583-681 8 Kaltsas G et al.: Neuroendocrinology 2017; 105: 245-54 9 Pavel M et al.: Ann Oncol 2020; 31(7): 844-60 10 Rinke A et al.: J Clin Oncol 2009; 27(28): 4656-63 11 Caplin ME et al.: N Engl J Med 2014; 371(3): 224-33 12 Yao JC et al.: Lancet 2016; 387(10022): 968-77
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...