Nachrückende Therapiestandards bei diversen Targets
Bericht:
Dr. Judith Moser
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine Vielzahl an klinisch relevanten Daten zu neuen Behandlungsoptionen stand im Fokus der World Conference on Lung Cancer (WCLC) 2024 der International Association for the Study of Lung Cancer (IASLC). Im frühen und fortgeschrittenen Setting konnten mit einer Reihe innovativer Substanzen vielversprechende Ergebnisse generiert werden.
Perioperatives Setting: NeoCOAST-2
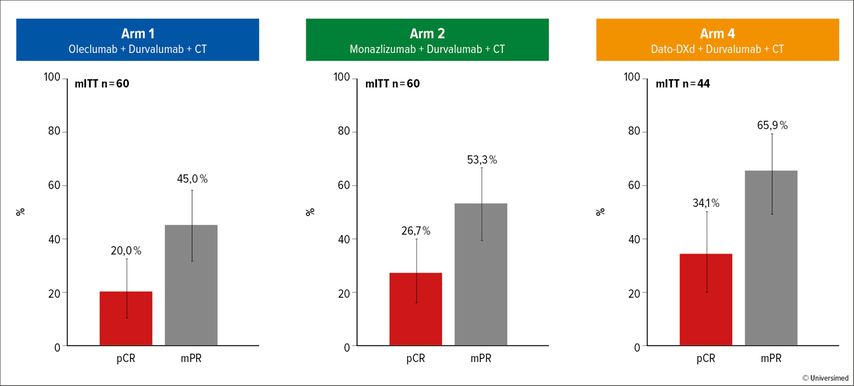
Beim operablen nichtkleinzelligen Lungenkarzinom (NSCLC) im Stadium IIA–IIIB wurde die offene Phase-II-Plattformstudie NeoCOAST-2 initiiert, um verschiedene innovative Schemen in der perioperativen Situation zu evaluieren. Bei der WCLC 2024 präsentierten Cascone et al. die Ergebnisse für die Studienarme 1, 2 und 4.1 In den Armen 1 und 2 bildeten der PD-L1-Antikörper Durvalumab und eine platinbasierte Kombinationschemotherapie das neoadjuvante Backbone; zusätzlich kam entweder der CD73-Antikörper Oleclumab (Arm 1; n=76) oder der NKG2A-Antikörper Monalizumab zum Einsatz (Arm 2; n=72). Postoperativ erfolgte eine adjuvante Therapie mit Oleclumab/Durvalumab (Arm 1) bzw. Monalizumab/Durvalumab (Arm 2). Arm 4wurde mit dem gegen TROP2 gerichteten Antikörper-Wirkstoff-Konjugat (ADC) Datopotamab Deruxtecan (Dato-DXd) zusätzlich zu Durvalumab und einer Platin-Monochemotherapie behandelt (n=54). Hier kam adjuvant nur Durvalumab zum Einsatz. Die neoadjuvante Therapie wurde über vier Zyklen verabreicht, die adjuvante über maximal ein Jahr. Tatsächlich legten die Kombinationsschemen eine vielversprechende Wirksamkeit an den Tag. Die Raten an pathologischen Komplettremissionen (pCR) bewegten sich im Bereich von 20,0% bis 34,1%, jene der pathologischen „Major“-Remissionen von 45,0–65,9%, wobei das T-DXd-basierte Schema in Bezug auf beide Endpunkte am besten abschnitt (Abb. 1). Zwischen den pCR-Raten und der PD-L1-Expression fand sich in allen Armen eine direkte Korrelation, allerdings sollten diese Daten aufgrund der geringen Patient:innenzahlen mit Vorsicht interpretiert werden. Alle Kombinationen zeigten ein beherrschbares Sicherheitsprofil, und die Operationsraten waren mit jenen unter den aktuell zugelassenen Regimes vergleichbar.2–4 In der neoadjuvanten Phase dominierten Übelkeit, Anämie, Neutropenie und Schwäche, wobei die Nebenwirkungsraten in allen Therapiephasen niedrig ausfielen und nur in geringen Prozentsätzen zu Behandlungsabbrüchen führten.
Abb. 1:Pathologische Komplettremissionen und pathologische „Major“-Remissionen unter verschiedenen Schemen im perioperativen Setting von Patient:innen mit operablem NSCLC im Stadium IIA–IIIB in der Phase-II-Plattformstudie NeoCOAST-2 (modifiziert nach Casone T et al.)1
Ivonescimab beim PD-L1-positiven NSCLC
Als erste randomisierte Phase-III-Studie konnte HARMONi-2 beim fortgeschrittenen NSCLC klinisch signifikante Verbesserungen durch eine neue Therapie im Vergleich zu Pembrolizumab zeigen. HARMONi-2 evaluiert im Erstlinien-Setting den bispezifischen Antikörper Ivonescimab (AK112), der einerseits an PD-1 und andererseits am vaskulären endothelialen Wachstumsfaktor (VEGF) Typ A ansetzt. Patient:innen mit PD-L1-positiven Tumoren(TPS ≥1%) im Stadium IIIB–IV wurden eingeschlossen; 198 erhalten Ivonescimab und 200 Pembrolizumab.
Nach einem medianen Follow-up von 8,67 Monaten zeigte sich im Prüfarm bereits eine signifikante Verlängerung des medianen progressionsfreien Überlebens (PFS) um 5,3 Monate, was einer 49%igen Risikoreduktion entspricht (11,14 vs. 5,82 Monate; HR: 0,51; p<0,0001).5 Der PFS-Vorteil wurde unabhängig von PD-L1-Expression und Histologie dokumentiert. Vorteile manifestierten sich auch in Bezug auf die Gesamtansprechrate (ORR; 50,0% vs. 38,5%) und die Krankheitskontrollrate (89,9% vs. 70,5%). Als Nebenwirkungen (AE) traten hauptsächlich Laboranomalien zutage (Proteinurie, AST-Auslenkungen, Hypercholesterinämie, Erhöhungen der Serumbilirubinspiegel). Alle VEGF-bedingten AE wurden als Grad 1–3 eingestuft. Mit 1,5% vs. 3,0% waren die Raten an behandlungsassoziierten Therapieabbrüchen sehr niedrig. Immunbedingte AE (irAE) der Grade ≥3 traten in beiden Armen mit vergleichbarer Häufigkeit auf (7,1% vs. 8,0%). Es wurden keine Todesfälle aufgrund von irAE verzeichnet. Wie die Autor:innen festhalten, kommt Ivonescimab beim fortgeschrittenen PD-L1-exprimierenden NSCLC als neue Erstlinienoption infrage.
TROPION-Lung01: finales OS und prädiktiver Marker
Im Rahmen der randomisierten, offenen Phase-III-Studie TROPION-Lung01 verbesserte Dato-DXd bei vorbehandelten Patient:innen im Stadium IIIB, IIIC und IV mit oder ohne onkogene Driver im Vergleich zu Docetaxel das PFS (4,4 vs. 3,7 Monate; HR: 0,75; p=0,004).6 Dabei fußte der PFS-Vorteil in erster Linie auf der Subgruppe ohne Plattenepithelhistologie (5,6 vs. 3,7 Monate; HR: 0,63).
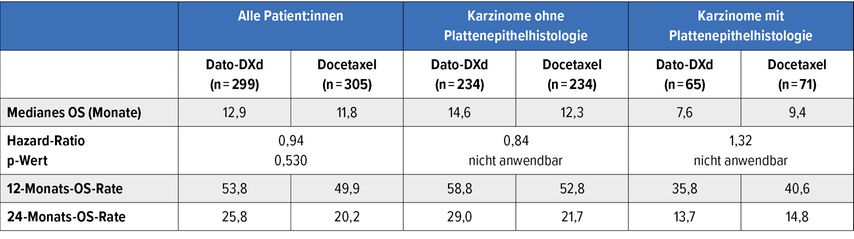
Bei der WCLC 2024 präsentierten Sands et al. die finale Analyse zum Gesamtüberleben (OS; dualer Endpunkt). Diesbezüglich fand sich in der ITT-Population eine nicht signifikante Verlängerung unter Dato-DXd vs. Docetaxel (12,9 vs. 11,8 Monate; HR: 0,94; p=0,530; Tab. 1).7 Ein deutlicherer Benefit resultierte in der Gruppe mit nicht squamöser Histologie (14,6 vs. 12,3 Monate; HR: 0,84). Dieser Vorteil war vom Vorliegen onkogener Driver-Alterationen und anderer Faktoren unabhängig. Im Gegensatz dazu schnitt das Kollektiv mit Plattenepithelhistologie unter Dato-DXd schlechter ab als unter Docetaxel (7,6 vs. 9,4 Monate; HR: 1,32). Für den Einsatz von Dato-DXd beim vorbehandelten nicht squamösen NSCLC sprechen auch die Verträglichkeitsdaten. Es wurden keine Langzeittoxizitäten dokumentiert, und trotz längerer Behandlungsdauer im Prüfarm unterschritt die Rate an therapiebezogenen AE der Grade ≥3 jene im Kontrollarm (26% vs. 42%). Seit der letzten Analyse war es zu keinen neuen Fällen einer interstitiellen Lungenerkrankung (ILD) gekommen.
Tab. 1:Gesamtüberleben in TROPION-Lung01 in der ITT-Population sowie je nach Histologie (modifiziert nach Sands J et al.)7
Zudem wurde bei der WCLC 2024 eine exploratorische Analyse der TROPION-Lung01-Studie vorgestellt, die TROP2 QCS-NMR („TROP2 Normalized Membrane Ratio“ laut quantitativem kontinuierlichem Scoring) als möglichen ersten Biomarker für die Vorhersage des Ansprechens auf Dato-DXd identifizierte.8 TROP2 QCS-NMR erwies sich als prädiktiv für den PFS-Benefit und wird derzeit in den Erstlinienstudien AVANZAR (NCT05687266) und TROPION-Lung10 (NCT06357533) geprüft.
Osimertinib plus Savolitinib
Präklinischen Daten zufolge setzt die Koexistenz von EGFR-Mutationen und MET-Amplifikation/-Überexpression die Sensibilität gegenüber EGFR-Tyrosinkinase-Inhibitoren (TKI) herab und bildet einen zentralen Mechanismus primärer Resistenzen gegenüber Erstlinien-EGFR-TKI.9–11 Die randomisierte, offene Phase-II-Studie FLOWERS evaluierte die Erstlinienkombination aus Osimertinib und dem hochselektiven MET-TKI Savolitinib bei Patient:innen mit Lungenkarzinomen, die sowohl EGFR-Mutationen als auch eine MET-Überexpression und/oder MET-Amplifikation aufwiesen. Im Kontrollarm gelangte Osimertinib zur Anwendung.
Nach einem medianen Follow-up von 8,2 Monaten bewirkte die Kombination gegenüber der Osimertinib-Monotherapie eine Steigerung der als primärer Endpunkt definierten bestätigten ORR (90,5% vs. 60,9%).12 Eine Krankheitskontrolle wurde in 95,2% vs. 87,0% erzielt, und das Ansprechen hielt im Median 18,6 vs. 8,4 Monate an. Die Daten zum PFS waren noch nicht reif, wiesen jedoch auf einen Trend zugunsten der Kombination hin (19,6 vs. 9,3 Monate; HR: 0,59). Osimertinib plus Savolitinib zeigte ein erwartbares und tolerables Verträglichkeitsprofil. Therapiebezogene AE umfassten primär Hautausschläge, Thrombozytopenie, periphere Ödeme sowie ALT-Anstiege und waren in den meisten Fällen niedriggradig. Laut Einschätzung der Autor:innen hat die Kombination das Potenzial, sich beim fortgeschrittenen NSCLC mit konkomitanten EGFR-Mutationen und De-novo-MET-Aberrationen als neue Erstlinienoption zu etablieren.
HER2-mutiertes NSCLC: Zongertinib
Auch beim HER2-mutierten NSCLC besteht ein hoher Bedarf an zielgerichteten Optionen, da das Ansprechen auf die Chemotherapie zu wünschen übrig lässt.13,14 Der HER2-selektive TKI Zongertinib wird in der offenen Phase-Ia/Ib-Studie Beamion LUNG-1 bei fortgeschrittenen, HER2-positiven soliden Tumoren untersucht. In die Phase Ib gingen ausschließlich Patient:innen mit NSCLC ein. Bei der WCLC 2024 präsentierten Ruiter et al. Daten aus Kohorte 1, die nach ≥1 platinbasierter Kombinationschemotherapie Zongertinib 120mg (n=75) bzw. 240mg (n=57) erhielt.15 Die meisten Personen waren massiv vorbehandelt, und in beiden Dosisgruppen lagen in hohen Prozentsätzen asymptomatische unbehandelte Hirnmetastasen vor.
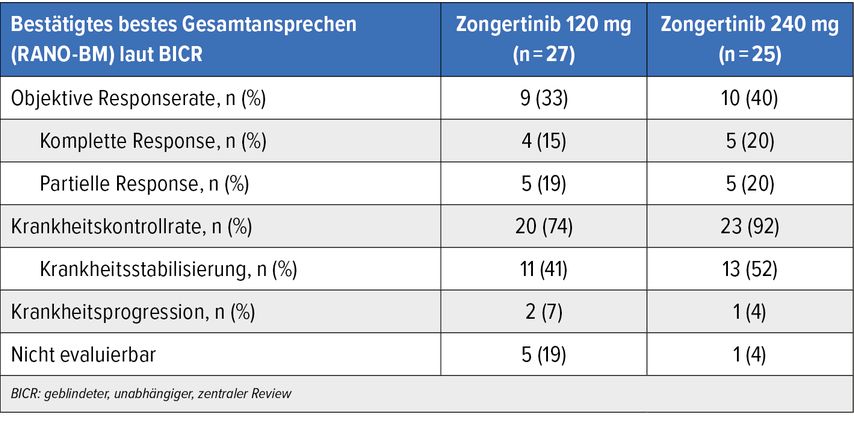
Nach ca. 13 Wochen erreichten alle mit Zongertinib 120mg behandelten Patient:innen den primären Endpunkt (bestätigte ORR: 66,7%). Eine Tumorschrumpfung war bei 94% eingetreten. Zusätzlich zeigte die Substanz vielversprechende Effektivität im ZNS (Tab. 2). Als häufigste therapiebezogene AE fand sich Diarrhö, die meisten AE erwiesen sich jedoch als mild und beherrschbar. Niemand entwickelte eine Grad-4-Diarrhö, und die Raten an therapiebedingten Dosisreduktionen sowie Therapieabbrüchen blieben niedrig.
Tab. 2: Intrakranielles Ansprechen auf Zongertinib beim HER2-positiven vorbehandelten NSCLC (modifiziert nach Ruiter G et al.)15
ADC bei Patient:innen mit SCLC
Im Setting des kleinzelligen Lungenkarzinoms (SCLC) im ausgedehnten Stadium testet die Phase-II-Studie IDeate-Lung01 das B7-H3(CD276)-gerichtete ADC Ifinatamab Deruxtecan (I-DXd) in zwei Dosierungen (8mg/kg bzw. 12mg/kg alle drei Wochen) nach Vortherapie. Asymptomatische behandelte und unbehandelte Hirnmetastasen sind erlaubt.
Gemäß der bei der WCLC 2024 vorgestellten Interimsanalyse konnten für I-DXd vielversprechende Daten generiert werden.16 Beide Dosisschemen bewirkten ein rasches Ansprechen, wobei die als primärer Endpunkt definierte ORR unter der 12mg/kg-Dosis höher ausfiel als unter der 8mg/kg-Dosis (54,8% vs. 26,1%). Ebenso resultierten numerische Vorteile in Bezug auf PFS (5,5 vs. 4,2 Monate) und OS (11,8 vs. 9,4 Monate). Auch Patient:innen mit ZNS-Metastasen profitierten in Bezug auf das systemische und das intrakranielle Ansprechen. Die Nebenwirkungen der I-DXd-Gabe umfassten hauptsächlich Übelkeit, Appetitminderung, Anämie und Neutropenie. Zur Entstehung von therapieassoziierten ILD/Pneumonitiden kam es in 11,9% vs. 8,7%, wobei der Schweregrad meist als 1 oder 2 eingeschätzt wurde. I-DXd 12mg/kg wird derzeit in der Phase-III-Studie IDeate-Lung02 bei Patient:innen mit SCLC-Rezidiv nach einer Vortherapie untersucht (NCT06203210).
Quelle:
IASLC World Conference on Lung Cancer 2024, 7.–10. September 2024, San Diego, USA + virtuell
Literatur:
1 Cascone T et al.: WCLC 2024; Abstr. #PL02.07 2 Wakelee H et al.: N Engl J Med 2023; 389(6): 491-503 3 Forde PM et al.: N Engl J Med 2022; 386(21): 1973-85 4 Heymach JV et al.: N Engl J Med 2023; 389(18): 1672-84 5 Zhou C et al.: WCLC 2024; Abstr. #PL02.04 6 Lisberg A et al.: ESMO 2023; Abstr. #LBA12 7 Sands J et al.: WCLC 2024; Abstr. #OA08.03 8 Garassino M et al.: WCLC 2024; Abstr. #PL02.11 9 Lai G et al.: J Clin Oncol 2019; 37(11): 876-84 10 Yang M et al.: Int J Cancer 2013; 132(2): E74-84 11 Shi P et al.: Cancer Lett 2016; 380(2): 494-504 12 Yang JJ et al.: WCLC 2024; Abstr. #PL04.10 13 Wang Y et al.: BMC Cancer 2018; 18(1): 326 14 Uy NF et al.: Cancers (Basel) 2022; 14(17): 4155 15 Ruiter G et al.: WCLC 2024; Abstr. #PL04.04 16 Rudin CM et al.: WCLC 2024; Abstr. #OA04.03
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...