Totale neoadjuvante Therapie und klinisch komplettes Ansprechen bei lokal fortgeschrittenen Rektumkarzinomen
Autorin:
OÄ Dr. Gudrun Piringer, MSc
Hämatologie und internistische Onkologie
Kepler Universitätsklinikum Linz
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Standardtherapie des lokal fortgeschrittenen Rektumkarzinoms umfasst die präoperative Radiochemotherapie gefolgt von der totalen mesorektalen Exzision sowie der adjuvanten Chemotherapie. Bei der totalen neoadjuvanten Therapie wird die adjuvante Therapie in das präoperative Setting vorverlegt. Das verbessert das Ansprechen sowie die Prognose und findet zunehmend Umsetzung im klinischen Alltag.
Keypoints
-
Die totale neoadjuvante Therapie des lokal fortgeschrittenen Rektumkarzinoms verdoppelt die pathologischen Remissionsraten, verlängert das krankheitsfreie Überleben und stellt die bevorzugte Alternative zur Standard-Radiochemotherapie bei fitten Patienten dar.
-
Verschiedene Konzepte der totalen neoadjuvanten Therapie sind derzeit Gegenstand der Forschung. Die Bestrahlung gefolgt von Konsolidierungstherapie und TME zeigte in zwei Studien Vorteile gegenüber der Induktionschemotherapie gefolgt von Bestrahlung und TME.
-
Die „Watch and wait“-Strategie bei klinisch kompletter Remission erfordert ein aktives Surveillance-Programm, welches die digitale rektale Untersuchung, ein MRI des kleinen Beckens, eine Endosonografie sowie CEA-Bestimmung umfasst.
Seit 2004 stellen die präoperative Langzeit-Radiochemotherapie gefolgt von Rektumresektion unter kompletter Mitnahme des Mesorektums (totale mesorektale Exzision, TME) und eine 5-FU-hältige adjuvante Chemotherapie die Standardtherapie des lokal fortgeschrittenen Rektumkarzinoms des mittleren und unteren Rektumdrittels dar.1 Die präoperative Radiochemotherapie (RCT) ist der postoperativen RCT hinsichtlich höherer R0-Resektionsraten, niedrigerer Lokalrezidivraten und geringerer Toxizitäten überlegen. Diese multimodale Therapie hat das Lokalrezidivrisiko nach 5 und 10 Jahren auf unter 10% gesenkt. Das Gesamtüberleben der Patienten bleibt davon unverändert und etwa 35% entwickeln Fernmetastasen. Die Verabreichung einer adjuvanten 5-FU-hältigen Chemotherapie nach präoperativer RCT findet nur in etwa der Hälfte der Patienten statt. Aufgrund von Complianceproblemen, Komplikationen nach TME oder chronischen Toxizitäten nach RCT wird häufig keine adjuvante Chemotherapie durchgeführt. Bei hohem Rezidivrisiko kann bei jüngeren, fitten Patienten auch die Zugabe von Oxaliplatin in der adjuvanten Therapie diskutiert werden. Das Auftreten von Fernmetastasen bei einem Drittel der Patienten trotz Durchführung der Standardtherapie ist nach wie vor ein ungelöstes Problem. Die Intensivierung der präoperativen RCT durch Zugabe von Oxaliplatin oder Antikörpern verbessert zwar das Ansprechen, jedoch auf Kosten höherer Toxizitäten.
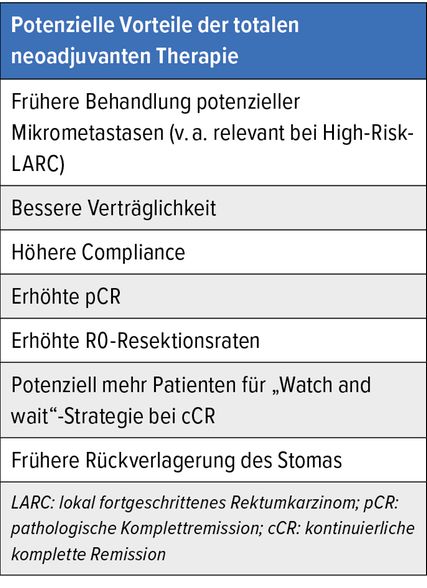
Jüngste Studien untersuchen die Rolle der sog. totalen neoadjuvanten Therapie (TNT). Bei diesem Konzept wird vor oder nach einer Kurzzeitbestrahlung oder Langzeit-RCT eine Induktions- oder Konsolidierungstherapie verabreicht. Die adjuvante Chemotherapie wird in das präoperative Setting vorverlegt. In den Studien werden unterschiedliche Konzepte der TNT untersucht. Kleinere Phase-II-Studien haben höhere Raten an pathologischer Komplettremission (pCR) sowie eine bessere Compliance gezeigt. Am ASCO 2020/21 wurden drei große prospektive randomisierte Studien (RAPIDO, PRODIGE 23, OPRA)2–4 präsentiert. Potenzielle Vorteile dieses Konzeptes sind die frühzeitige Behandlung potenzieller Mikrometastasen, bessere Verträglichkeit, höhere Compliance, erhöhte Raten an kompletten pathologischen Remissionen, frühere Rückverlagerungen des Stomas und potenziell mehr Patienten für eine „Watch and wait“-Strategie bei klinisch kompletter Remission (Tab. 1).
TNT-Strategie im Vergleich zur Standardbehandlung
RAPIDO-Studie
In der Phase-III-Studie RAPIDO2 wurde eine Kurzzeitbestrahlung mit 5x5 Gy gefolgt von 9 Gaben FOLFOX oder 6 Gaben CAPOX-Chemotherapie und TME („TNT-Konzept“) mit einer Capecitabin-basierten RCT gefolgt von TME und optionaler postoperativer Chemotherapie (Standardgruppe) verglichen. Eingeschlossen wurden 920 Patienten mit MRI-definierten High-Risk-Faktoren (T4, Infiltration der mesorektalen Faszie, N2, extramurale Gefäßinfiltration und/oder positive laterale Lymphknoten). Der primäre kombinierte Endpunkt „disease-related treatment failure“ (DrTF) war definiert als lokoregionäres Versagen (Lokalrezidiv, R2-Resektion, lokale Progression ohne Resektionsmöglichkeit), Auftreten von Fernmetastasen, kolorektaler Zweittumor oder therapieassoziierter Tod. Eine adjuvante Chemotherapie im Standardarm erhielten weniger als die Hälfte der Patienten. Der primäre Endpunkt zeigte eine signifikante Überlegenheit der experimentellen TNT-Gruppe gegenüber der Standardgruppe. Das DrTF betrug 23,7% versus 30,4% (p=0,019). Die Rate an pathologischen kompletten Remissionen konnte in der TNT-Gruppe verdoppelt werden (28% versus 14%; p<0,001). Das Auftreten von Fernmetastasen war bei Patienten, welche die TNT erhielten, signifikant niedriger (nach 3 Jahren 20,0% versus 26,8%; p=0,005). Die 3-Jahres-Lokalrezidivrate war nummerisch im experimentellen Arm höher als in der Standardgruppe (8,7% versus 6,0%; p=0,09). Bei noch kurzem Follow-up ist das Gesamtüberleben nicht unterschiedlich.
PRODIGE-23
Die französische Phase-III-Studie PRODIGE-233 hat eine Induktionschemotherapie mit 6 Gaben FOLFIRINOX gefolgt von einer Capecitabin-basierten RCT, TME und adjuvanter Chemotherapie über 3 Monate (Capecitabin oder FOLFOX) („TNT-Konzept“) mit der Capecitabin-basierten RCT (Standardgruppe) gefolgt von TME und einer adjuvanten FOLFOX- oder Capecitabin-Therapie über 6 Monate verglichen. Die Einschlusskriterien waren nicht so genau definiert wie in der RAPIDO-Studie und umfassten Patienten mit T3- (mit erhöhtem Risiko für ein Lokalrezidiv) oder T4-Tumoren. Der primäre Endpunkt war das 3-Jahres-„disease-free survival“ (DFS) und betrug im experimentellen Arm 75,7% versus 68,5% in der Standardgruppe. Das Metastasen-freie Überleben war in dieser Studie signifikant zugunsten der TNT-Gruppe verbessert (78,8% versus 71,7%). Ähnlich wie in der RAPIDO-Studie zeigte sich mehr als eine Verdoppelung der pCR-Raten in der experimentellen Gruppe (27,8% versus 12,1%).
OPRA
Die randomisierte Phase-II-Studie OPRA4 verfolgte das Ziel, die optimale Sequenz der TNT mit Hinblick auf DFS als primären Endpunkt und den Organerhalt als sekundären Endpunkt zu evaluieren. Die Patienten erhielten entweder über 4 Monate eine Induktionschemotherapie (CAPOX oder FOLFOX) gefolgt von einer RCT (Capecitabin oder 5-FU+25x2 Gy) oder RCT gefolgt von einer Konsolidierungstherapie über 4 Monate (CAPOX oder FOLFOX). Patienten, welche nach klinischer Evaluierung eine klinisch komplette Remission aufzeigten, wurde eine „Watch and wait“-Strategie mit aktiver Surveillance angeboten. Die Studie war nicht auf einen formalen Vergleich der beiden Arme ausgelegt. Das 3-Jahres-DFS (77% versus 78%) und das Metastasen-freie Überleben (82% versus 84%) waren nahezu identisch. Es zeigte sich jedoch eine signifikant höhere Rate an Organerhalt bei Patienten, welche die Konsolidierungstherapie erhielten. Das 3-Jahres-„TME-free-survival“ lag bei 59% in der Konsolidierungsgruppe versus 43% in der Gruppe, welche die Induktionstherapie erhielt. Zur Frage der Sequenz Induktions- oder Konsolidierungstherapie liegen nun die Daten der amerikanischen OPRA-Studie sowie die Daten der deutschen CAO/ARO/AIO-12-Studie5 vor. Diese Studien geben Hinweise, dass die RCT gefolgt von Konsolidierungstherapie besser hinsichtlich Compliance, Wirksamkeit, Toxizität, pCR-Raten und „TME-free survival“ ist.
Die „Watch and wait“-Strategie bei Patienten, die auf eine präoperative RCT eine klinisch komplette Remission erreichen, ist Gegenstand klinischer Untersuchungen. Eine Metaanalyse zeigt Lokalrezidivraten bis zu 25%.6 Der Großteil des lokalen „Re-Growth“ ist in den ersten 3 Jahren aufgetreten. Bei mindestens 88% dieser Patienten konnte in dieser Analyse eine Salvage-Operation mit R0-Resektion erreicht werden. Das Auftreten von Fernmetastasen während des aktiven Surveillance-Programms wird mit ca 4–8% angegeben. Je nach Studie betrug das 3-Jahres-DFS 80–90%.
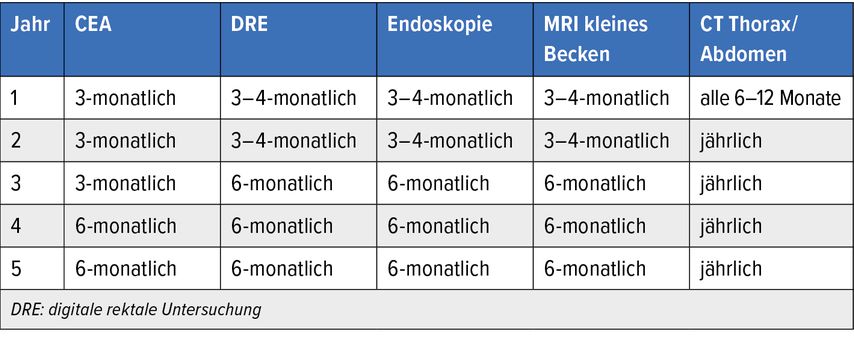
Die ungefähr verdoppelte pCR-Rate durch TNT-Konzepte (RAPIDO-Studie, PRODIGE-23-Studie) zusammen mit den Daten zum „TME-free survival“ aus der OPRA-Studie mit Organerhalt in etwa 60% der Patienten erlauben eine breitere Umsetzung des „Watch and wait“-Konzeptes im klinischen Alltag. Bei diesen Patienten ist ein aktives Surveillance-Programm notwendig. Eine rezent publizierte internationale Konsensusempfehlung schlägt eine regelmäßige digitale rektale Untersuchung, eine Endoskopie, ein MRI des kleinen Beckens sowie die Bestimmung des CEA-Spiegels, wie in Tabelle 2 dargestellt, vor.7
Fazit
Zusammenfassend erreicht man durch die TNT im Vergleich zur Standardradiochemotherapie eine Verdoppelung der pCR-Raten, ein geringeres „disease-related treatment failure“ (RAPIDO-Studie), ein längeres DFS (PRODIGE-23-Studie) bzw. die Option einer „Watch and wait“-Strategie bei klinisch kompletter Remission. Das „TNT-Konzept“ stellt somit die bevorzugte Alternative zur RCT vor allem bei fitten Patienten mit einem fortgeschrittenen Rektumkarzinom entsprechend den Einschlusskriterien, wie in der RAPIDO-Studie definiert, dar und wird zunehmend in den Zentren umgesetzt. Bei Patienten, denen eine „Watch and wait“-Strategie außerhalb von Studien angeboten wird, ist eine interdisziplinäre Diskussion sowie eine ausführliche Besprechung der Vor- und Nachteile mit dem Patienten notwendig. Diese Patienten müssen in einem wie oben definierten Surveillance-Programm eingeschlossen werden.
Literatur:
1 Sauer R et al.: Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351: 1731-40 2 Bahadoer R et al.: Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021; 222: 29-42 3 Conroy T et al.: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22: 702-15 4 Thompson H et al.: Survival and organ preservation according to clinical response after total neoadjuvant therapy in locally advanced rectal cancer patients: a secondary analysis from the organ preservation in rectal adenocarcinoma (OPRA) trial. J Clin Oncol 2021; 39(15_Suppl): 3509 5 Fokas E et al.: Randomized phase II trial of chemoradiotherapy plus induction or consolidation chemotherapy as total neoadjuvant therapy for locally advanced rectal cancer: CAO/ARO/AIO-12. J Clin Oncol 2019; 37: 3212-22 6 Dattani M et al.: Oncological and survival outcomes in watch and wait patients with a clinical complete response after neoadjuvant chemoradiotherapy for rectal cancer: a systematic review and pooled analysis. Ann Surg 2018; 268: 955-67 7 Fokas E et al.: International consensus recommendations on key outcome measures for organ preservation after (chemo)radiotherapy in patients with rectal cancer. Nat Rev Clin Oncol 2021; doi: 10.1038/s41571-021-00538-5 (online ahead of print)
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...