Diagnostik und Therapie der Hüftkopfnekrose
Autoren:
Dr. Klemens Vertesich
O. Univ.-Prof. Dr. Reinhard Windhager
Universitätsklinik für Orthopädie und Unfallchirurgie
Medizinische Universität Wien
Korrespondierender Autor:
Dr. Klemens Vertesich
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die avaskuläre Hüftkopfnekrose repräsentiert eine devastierende und einschränkende Erkrankung des Hüftgelenks, die häufig junge Patient:innen betrifft. Die Erkennung von Risikofaktoren, die lückenlose Abklärung und die umgehende Therapieeinleitung können die Prognose fürden Gelenkserhalt deutlich verbessern.
Keypoints
-
Erkennung von Risikofaktoren und rasche Einleitung einer Abklärung mittels Röntgen und MRT sind essenziell in der Diagnostik der Hüftkopfnekrose.
-
Die Einleitung der Therapie in Frühstadien der Hüftkopfnekrose hat prognostische Vorteile für den Erhalt des Gelenks.
-
Die retrograde Hüftkopfbohrung mit multiplen Bohrungen kleinen Durchmessers repräsentiert das Verfahren mit der höchsten Evidenz und guten Ergebnissen.
Die avaskuläre, femorale Kopfnekrose (aFKN) oder Hüftkopfnekrose ist eine Erkrankung hervorgerufen durch eine gestörte Durchblutung des femoralen Kopfes, den folgenden Niedergang knochenbildender Zellen und den damit einhergehenden Einbruch der femoralen Gelenksfläche. Häufig betroffen sind Patient:innen mittleren Alters. Die Inzidenz der Erkrankung wird mit 1 Fall je 15000–20000 angegeben.1,2 Ein rasches Fortschreiten der aFKN kann bereits in jungem Alter die Notwendigkeit des Hüftgelenksersatzes mit sich bringen.
Die Ätiologie der Erkrankung geht mit dem Vorhandensein von Risikofaktoren einher. Im klinischen Alltag ist es essenziell, diese Faktoren zu erkennen, um hier bereits Einfluss nehmen zu können.3
Die Medikation mit Kortikosteroiden ist der häufigste kausale Grund für das Auftreten einer aFKN. In der Literatur werden hier unterschiedliche Inzidenzen von 30% bis 50% beschrieben.4 Die Einnahme von Kortikosteroiden führt auf molekularer Ebene zu einer Apoptose der Osteozyten, einer Reduktion der Osteoblasten-Differenzierung und einer Steigerung der intramedullären Adipogenese. Das zunehmende Vorkommen von Lipozyten im femoralen Kopf und die Zunahme des Volumens von lipogenen Zellen führen zu einer lokalen Steigerung des Drucks auf das mikrovaskuläre, knochenversorgende Blutsystem und in weiterer Folge zu lokalen Thromben sowie einer Unterbrechung der Blutversorgung für das knochenaufbauende System.5
Die exzessive Einnahme von Alkohol führt zu einer Veränderung des zellulären Signalverhaltens des blutversorgenden Systems und knochenbildenden Systems mit Änderung des Expressionsmusters insbesondere von „vascular endothelial growth factor“ (VEGF).5 Dies führt wiederum zu einem gesteigerten Risiko von Mikrothromben und dadurch zur Unterbrechung der lokalen Blutversorgung. Alkoholabusus ist kausal in circa 20% der aFKN.
Nikotinabusus, Sichelzellanämie, systemischer Lupus erythematodes (SLE), Morbus Goucher, Hämoglobinopathien und Fettstoffwechselstörungen stellen weitere Risikofaktoren dar.6–8 In bis zu 15% der Fälle kann von einer idiopathischen aFKN ausgegangen werden, bei der kein Risikofaktor identifiziert werden kann.
Diagnostik und Früherkennung sind essenziell für die hüftgelenkerhaltende Behandlung
Die frühe Erkennung einer aFKN ist wichtig, um eine umgehende Therapie einzuleiten. Bei präsenten Schmerzen eines oder beider Hüftgelenke und dem Vorhandensein von Risikofaktoren ist die initiale Abklärung mittels Röntgen unumgänglich. Aufgrund des oftmals beidseitigen Auftretens der aFKN werden Beckenübersichts-Aufnahmen sowie axiale oder Lauenstein-Aufnahmen beider Hüftgelenke empfohlen. Fortgeschrittene Stadien der aFKN können im Röntgen sicher erkannt werden. Ebenso ist die Abgrenzung zu Differenzialdiagnosen wie Koxarthrose, femoroazetabulärem Impingement, Hüftgelenksdysplasie, Osteolysen, Knochentumoren oder Arthritiden möglich.9
Frühe Stadien der aFKN können im Röntgen häufig nicht erkannt werden. Goldstandard und essenzielle Untersuchung zur Einteilung der aFKN stellt die Magnetresonanztomografie (MRT) dar. Sie erlaubt die Darstellung von Knochenmarködemen im femoralen Kopf und den Ausschluss eines etwaigen Gelenksergusses, beides wichtige prognostische Faktoren der aFKN. Die Einteilung der aFKN erfolgt anhand der Association-Research-Circulation-Osseous- (ARCO)-Klassifikation (Tab. 1).10 Diese wurde basierend auf der ursprünglichen Veröffentlichung, mit Einbindung der computertomografischen (CT) Morphologie, durch technische Neuerungen und Verbesserung der MR-Bildgebung mehrfach adaptiert. Insbesondere bietet die Einteilung anhand des MRT eine eindeutige Unterscheidung des Stadiums I und II durch das Vorhandensein von subchondraler Nekrose mit reaktivem Randsaum und Flüssigkeitssignal.11,12 Die Unterscheidung des Stadiums II von III ist hingegen anhand der Röntgenbildgebung, mit fleckiger Strukturverdichtung, beziehungsweise einer CT-Untersuchung, mit sklerotischen Randsäumen und Strukturverlust, möglich. Eine sichere Einteilung anhand der ARCO-Klassifikation bietet die Möglichkeit der evidenzbasierten Einleitung von Behandlungsstrategien.
Tab. 1: Überblick über die Klassifikation und Stadieneinteilung gemäß der Association Research Circulation Osseous (ARCO) mit den entsprechenden radiologischen Zeichen
Zusätzliche bildgebende Verfahren mittels Single-Photon Emission Computerized Tomography (SPECT) oder Positron-Emission-Tomography(PET)-CT sind, wie Studien zeigen, ebenfalls hilfreich in der frühen Detektion der aFKN beziehungsweise können sie hinweisend für ein Fortschreiten der Erkrankung sein. Ein standardisierter Einsatz dieser Verfahren ist derzeit nicht empfohlen.13
Therapieeinleitung in Frühstadien der aFKN führt zu einer besseren Prognose bei hüftgelenkerhaltenden Maßnahmen
Nicht chirurgische oder konservative Maßnahmen gehen einher mit der strikten Entlastung des betroffenen Hüftgelenks mittels Krücken oder anderer Gehbehelfe, um einen Kollaps des femoralen Kopfes zu verhindern und das Fortschreiten der Erkrankung zu verlangsamen. Die aktuelle Literatur bietet jedoch Evidenz, dass diese Therapie keine suffiziente Verbesserung der aFKN bietet und den Erkrankungsfortschritt nicht verhindert.4,14
Die zusätzliche medikamentöse Therapie mit Vasodilatatoren, wie zum Beispiel Iloprost, soll zu einer Reduktion des Schmerzes und des Knochenmarködems führen. Eine rezente Metaanalyse zeigte, dass der Einsatz von Iloprost zu einer Verbesserung der Beschwerden und der Funktion führen kann.15 Jedoch waren sämtliche eingeschlossenen Studien Single-Center-Studien ohne Randomisierung und ohne Kontrollgruppe. Eine evidente Aussage im Vergleich zu Placebo oder anderen Behandlungsstrategien ist nur eingeschränkt zu treffen.
Der Einsatz von Bisphosphonaten findet in der Literatur ebenfalls nur eingeschränkte Evidenz in der Behandlung der aFKN. Durch die Inhibition der Osteoklasten-Aktivität und einen daraus resultierenden Überhang der knochenaufbauenden Zellen soll hier die Knochenstruktur verbessert und Einbrüche des femoralen Kopfes verhindert werden. Einige Single-Center-Studien zeigen hier das gewünschte Verhindern des Einbruches und damit eines Fortschreitens der aFKN, andere zeigen keinen Unterschied in den Behandlungsgruppen.4
Andere nicht operative Maßnahmen umfassen Antikoagulanzien, Lipidsenker, extrakorporale Stoßwellentherapie (ESWT) oder Magnetfeldtherapie. Sämtliche Studien zu den erwähnten Methoden bieten geringe Level an Evidenz mit kleinen Versuchsgruppen und häufig inkonklusiven Resultaten.4,16
Die am häufigsten zur Anwendung kommende Methode zur Behandlung der aFKN stellt die retrograde Hüftkopfbohrung oder „core decompression“ (CD) dar. Die retrograde Anbohrung des Femurkopfes und insbesondere des von avaskulärer Nekrose betroffenen Areals führt zu einer Reduktion des internen Drucks und dadurch zu einer Verbesserung der lokalen Mikrovaskularisation. Eine rezente Metaanalyse mit 2441 eingeschlossenen Hüften zeigt, dass die CD die Methode mit den besten Erfolgsaussichten bei aFKN darstellt mit einer Erfolgsrate von 65% bei einem mittleren Follow-up von 4,5 Jahren.17 Ebenso führten Daten aus einem systematischen Review von 159 Arbeiten von Roth et al. zur Ausarbeitung der deutschen Konsensus-Leitlinien, welche die operative Methode der CD konservativen Methoden bei aFKN, welche weniger als 30% des Femurkopfes einnimmt und noch ohne Einbruch der femoralen Kalotte einhergeht, vorzieht.9
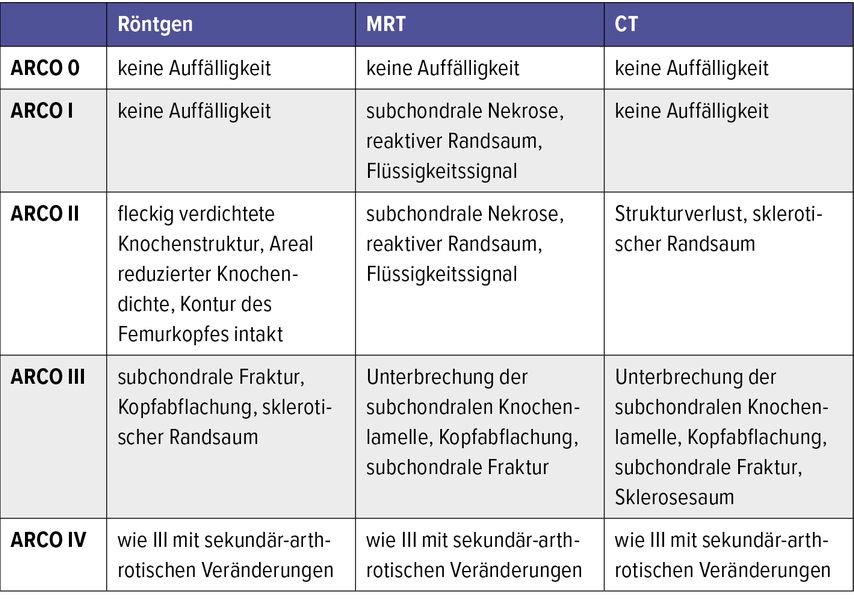
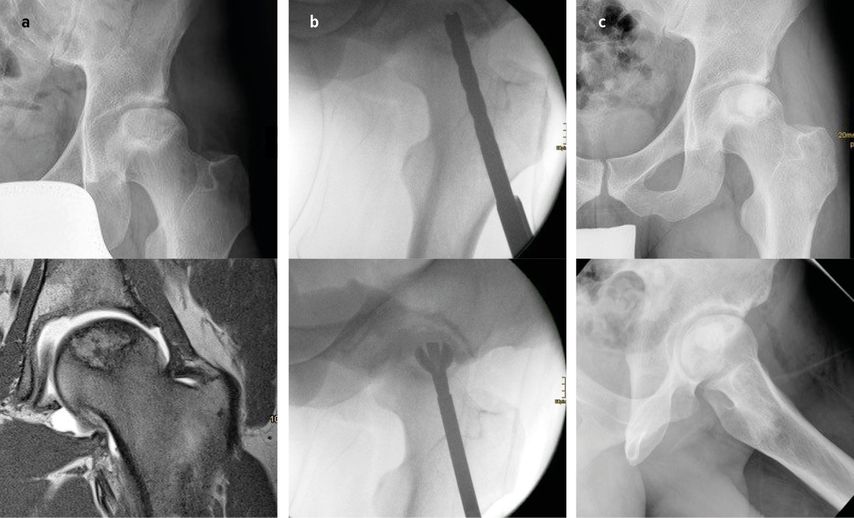
Die technische Durchführung der CD hat über die Zeit ihrer Anwendung Änderungen erfahren. War es die typischerweise unter Bildwandlerkontrolle durchgeführte singuläre Bohrung mit größerem Bohrdurchmesser, zeigen rezentere Arbeiten mit multiplen Bohrungen mit Bohrdrähten oder Bohrern kleineren Durchmessers (3mm bis 8mm) äquivalente Ergebnisse mit deutlich vermindertem Frakturrisiko (Abb. 1).18–20 Neue Literatur berichtet zusätzlich über die Möglichkeiten der lokalen Applikation von Stammzellen bei CD. Die vielversprechendsten Arbeiten zeigen hier ein verbessertes Hüftkopfüberleben und eine niedrigere Konversionsrate zu einer Totalendoprothese nach Injektion von Knochenmarkaspirat aus dem Beckenkamm im Rahmen der CD.21,22
Abb. 1a–c: Präoperative Bildgebung (MRT) eines Patienten mit ARCO-Stadium II nach Chemotherapie und Kortikosteriodtherapie bei akuter lymphatischer Leukämie (a). Es erfolgte eine „core decompression“ (CD) mit multiplen Bohrlöchern kleinen Durchmessers, wie zu sehen an der intraoperativen Bildgebung (b). Das Verlaufs-MRT (c) zeigt eine vollkommene Regredienz des Ödems mit Erhalt des Femurkopfes
Den guten Ergebnissen bei ARCO-Stadium I oder II steht jedoch in diversen Aufarbeitungen eine hohe Versagensrate von über 60% bei ARCO III gegenüber. Gerade bei diesem fortgeschrittenen Stadium der aFKN können invasivere Verfahren mit Ausräumungen des Nekroseareals und einer Auffüllung des Defekts durchgeführt werden. Das „trap-door procedure“ mit Eröffnung des Femurkopfes am Schenkelhals-Hüftkopf-Übergang über einen anterioren Zugang und einer Ausräumung des Defektareals bietet die Möglichkeit zur Auffüllung des Defekts mit autologem Knochen. Diese Operationsmethode, ebenso wie andere invasive Methoden mit Defektauffüllung, werden als sogenannte „advanced core decompression“ (ACD) bezeichnet. Die Überlebensraten des femoralen Kopfes nach Auffüllung mit autologem, nichtvaskularisiertem Knochen waren ähnlich den Ergebnissen der CD.23,24
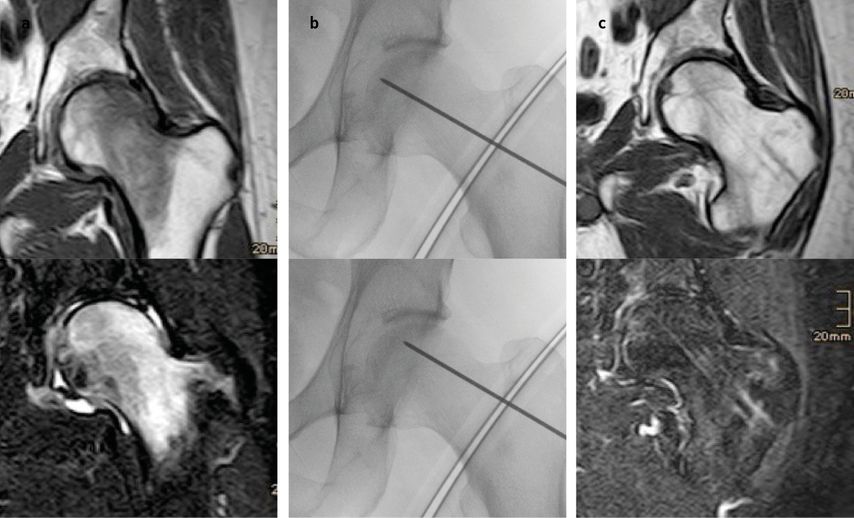
Rezente Literatur beschreibt den Einsatz der sogenannten „modified advanced core decompression“ (mACD).25 Hier kommen auf Basis der zuvor beschriebenen CD expandierbare Fräsen zum Einsatz, wobei schrittweise und gezielt das Nekroseareal ausgefräst werden kann. Über den Bohrkanal wird Knochenersatzmaterial, Kalziumphosphat oder andere Verbindungen beziehungsweise autologe Knochenspongiosa mit Beckenkammaspirat oder anderen Stammzelladjuvantien zur Defektfüllung eingebracht, um somit den subchondralen Knochen zu stabilisieren (Abb. 2). Mittelfristige Untersuchungen zeigten vielversprechende Ergebnisse des Einsatzes von Knochenersatzmaterial bei aFKN bis ARCO III und kleineren Nekrosearealen.26,27 Langfristige Nachuntersuchungen der mACD mit Knochenersatzmaterial sind derzeit noch ausständig.
Abb. 2a–c: Präoperative Bildgebung (a) eines Patienten mit Hüftkopfnekrose ARCO III nach hoch dosierter Kortikosteroidtherapie. Aufgrund des umschriebenen Nekroseareals erfolgte die Durchführung einer „modified advanced core decompression“ (mACD). Bild b zeigt die intraoperativen Bilder der Ausräumung des Nekroseareals mit expandierbaren Fräsen. Bild c zeigt die postoperative Situation nach Auffüllung mit Knochenersatzmaterial
Bei fortgeschrittenem Stadium ARCO IV mit subchondralen Frakturen und zusätzlich sekundär-arthrotischen Veränderungen ist ein gelenkserhaltendes Verfahren nicht mehr anzustreben. Die Implantation einer Hüftgelenktotalendoprothese ist hier die Option der Wahl. Rezent veröffentlichte Literatur zeigt, bei einem minimalen Follow-up von 10 Jahren, keine erhöhte Revisionshäufigkeit der endoprothetischen Versorgung von Patient:innen mit aFKN im Vergleich zu Patient:innen mit Koxarthrose.28,29 Dennoch ist bei notwendiger Endoprothese bei aFKN im Rahmen seltener Entitäten wie Sichelzellanämie, Morbus Goucher oder nach Organtransplantation Vorsicht geboten, da hier höhere Revisionsquoten beschrieben wurden.30 Ebenso ist die Wahl der endoprothetischen Gleitpaarung aufgrund des häufig jüngeren Alters der Patient:innen mit aFKN mit höherem Aktivitätsgrad entscheidend, um eine lange Standzeit der endoprothetischen Versorgung zu gewährleisten.31,32
Literatur:
1 Mankin HJ: N Engl J Med 1992; 326(22): 1473 2 Moya-Angeler J et al.: World J Orthop 2015; 6(8): 590 3 Guggenbuhl P et al.: Morphologie 2021; 105(349): 80 4 Mont MA et al.: J Bone Joint Surg Am 2020; 102(12): 1084 5 Shah KN et al.: Curr Rev Musculoskelet Med 2015; 8(3): 201 6 Li X et al.: Biol Blood Marrow Transplant 2014; 20(4): 587 7 Khan A: J Bone Miner Res 2012; 27(8): 1839 8 Borges ÁH et al.: Clin Infect Dis 2017; 64(10): 1413 9 Roth A et al.: Arch Orthop Trauma Surg 2016; 136(2): 165 10 Gardeniers JWM, Rijnen WHC: The ARCO staging system: generation and evolution since 1991. New York: Springer, 2014 11 Zhang YZ et al.: J Orthop Surg Res 2018; 13(1): 167 12 Zibis AH et al.: Eur J Radiol 2007; 63(1): 3 13 Dasa V et al.: Clin Orthop Relat Res 2008; 466(5): 1081 14 Mont MA et al.: Clin Orthop Relat Res 1996; (324): 169 15 Zippelius T et al.: J Pers Med 2022; 12(11): 1757 16 Konarski W et al.: Int J Environ Res Public Health 2022 Jun 15; 19(12): 7348 17 Hua KC et al.: J Orthop Surg Res 2019; 14(1): 306 18 Marker DR et al.: Clin Orthop Relat Res 2008; 466(5): 1093 19 Brown PJ et al.: Surg Technol Int 2016; 29: 247 20 Li J et al.: Chin Med J (Engl) 2017; 130(12): 1435 21 Piuzzi NS et al.: J Arthroplasty 2017; 32(5): 1698 22 Hernigou P et al.: Int Orthop 2018; 42(7): 1639 23 Stulberg BN et al.: Clin Orthop Relat Res 1991; (268): 140 24 Mont MA et al.: J Bone Joint Surg Br 1998; 80(1): 56 25 Landgraeber S, Jager M: Oper Orthop Traumatol 2020; 32(2): 96 26 Landgraeber S et al.: BMC Musculoskelet Disord 2017; 18(1): 479 27 Landgraeber S et al.: Arch Orthop Trauma Surg 2015; 135(10): 1357 28 Hart A et al.: J Bone Joint Surg Am 2019; 101(17): 1563 29 Miladi M et al.: Int Orthop 2018; 42(7): 1669 30 Ilyas I et al.: J Arthroplasty 2018; 33(2): 477 31 Sechriest VF, 2nd, et al.: J Arthroplasty 2007; 22(1): 39 32 Min BW et al.: J Arthroplasty 2020; 35(3): 805
Das könnte Sie auch interessieren:
Mehr kardiovaskuläre Ereignisse und Malignome?
Mit Tofacitinib, einem Strukturanalogon von ATP, wurde 2013 erstmals ein Januskinase-Inhibitor (JAKi) in der Schweiz zugelassen. Die Vertreter dieser Medikamentenklasse haben sich gut ...
Seltene Kleingefässvaskulitiden im Fokus
Bei Vaskulitiden der kleinen Gefässe liegt eine nekrotisierende Entzündung der Gefässwand von kleinen intraparenchymatösen Arterien, Arteriolen, Kapillaren und Venolen vor. Was gilt es ...
Elektive Hüft-TEP bei Adipositas Grad III
Übergewichtige Patient:innen leiden früher als normalgewichtige Personen an einer Hüft- oder Kniearthrose. Allerdings sieht die aktuelle S3-Leitlinie zur Behandlung der Coxarthrose in ...