Fortschritte & Deeskalationsstrategien in der Therapie von Hoden- & Penistumoren
Autoren:
Dr. Andreas Banner1,3
Prim. Univ.-Prof. Dr. Stephan Madersbacher, FEBU1,2
1 Abteilung für Urologie
Klinik Favoriten
2 Sigmund Freud Privatuniversität, Wien
3Medizinische Universität Wien
Am EAU-Kongress 2024 in Paris waren in den Vorträgen zur Therapie des Hoden- und Peniskarzinoms Langzeittoxizität und Deeskalation zwei der häufigsten Stichwörter. U.a. wurden mögliche Therapiealgorithmen bei „small testicular mass“ diskutiert und eine neue Risikogruppierung für Seminome im Stadium I wurde vorgestellt. Die Rolle der inguinalen Lymphadenektomie wurde im klinischen Stadium N0 beim Peniskarzinom infrage gestellt und LYMPHA als potenziell Komplikationen verringernder Eingriff im Rahmen der Lymphadenektomie hervorgehoben. Als neues Target beim metastasierten Peniskarzinom könnte sich das bereits bekannte Oberflächenprotein TROP-2 behaupten.
Keypoints
-
Kleine Hodentumoren <2cm können anhand sonografischer Merkmale für hodenerhaltende Strategien ausgewählt werden.
-
Eine neue Risikogruppierung bei Seminomen im klinischen Stadium I definiert eine neue Hochrisikopopulation.
-
Deeskalationsstrategien bei Seminomen im klinischen Stadium IIa/b müssen ihre onkologische Sicherheit noch unter Beweis stellen.
-
Die inguinale Lymphadenektomie nach positiver Sentinellymphknotenbiopsie bleibt weiter Therapiestandard.
-
Der LYMPHA könnte ein interessanter Ansatz zur Verringerung der Morbidität bei inguinaler Lymphadenektomie sein.
-
TROP-2 ist ein potenzielles Target und Marker in der Therapie metastasierter Plattenepithelkarzinome des Penis.
Hoden- und Peniskarzinome sind beides seltene Karzinome mit Inzidenzen von 3–10/100000 bzw. 0,94/100000. Beide können theoretisch in jeder Altersgruppe vorkommen, haben aber klare Inzidenzgipfel in der 3.–4. Lebensdekade (Hodentumor) und 5.–6. Lebensdekade (Peniskarzinom). Aufgrund des hervorragenden Ansprechens der Hodentumoren auf Platin-basierte Kombinationstherapien und einer Langzeitüberlebensrate von über 90% sind zuletzt die Spätfolgen durch die Langzeittoxizität der Chemotherapie in den Fokus gerückt. Bei der Therapie des Peniskarzinoms stehen die Verschlechterung der Sexual- und Miktionsfunktion durch amputative penile Eingriffe sowie dieMorbidität der inguinalen Lymphadenektomie im Vordergrund. Im Sinne der Verbesserung der Lebensqualität betroffener Patienten standen die Vorträge zu Hodentumoren und zum Peniskarzinom am vergangenen EAU-Kongress 2024 unter einem gemeinsamen Motto: Deeskalation.
Hodentumoren
„Small testicular mass“
Mit dem breiten Einsatz der Sonografie in der Urologie können vermehrt kleine, nicht palpable testikuläre Raumforderungen gefunden werden (engl. „small testicular mass“, STM). Histologisch sind 50–80% dieser STM benigne. Empfehlungen zu einer nichthistologischen Dignitätsbeurteilung liegen zurzeit allerdings nicht vor. In einem thematischen Vortrag zu „unveiling the unseen“ wurden auf dem vergangenen EAU-Kongress 2024 verschiedene Strategien zur Behandlung von STM diskutiert. In einer mehrfach zitierten, retrospektiven Analyse zu Patienten mit STM (<2cm) wurden 307 Patienten eingeschlossen, die entweder eine aktive Überwachung(52%) oder eine inguinale Hodenfreilegung mit einer Exzisionsbiopsie (27%) bzw. eine primäre Ablatio (20%) erhalten hatten. Die Selektion erfolgte anhand sonografischer Merkmale wie Tumorgröße und Durchblutung, die von den Autoren in einem Algorithmus zusammengefasst wurden. Danach können STM <5mm primär unter Active Surveillance (AS) behandelt und von STM zwischen 5 und 10mm kann eine Exzisionsbiopsie entnommen werden. Bei einer Tumorgröße von 10–20mm könnte bei nicht vaskularisierten Tumoren ebenfalls eine Biopsie entnommen werden, während bei vaskularisierten Tumoren die primäre Ablatio das sicherste Vorgehen zu sein scheint. Dennoch werden nach dieser Einteilung knapp 40% der STM mit einer primären Ablatio übertherapiert. In Präsentationen zu Abstracts von Hodentumoren wurden u.a. die miRNA-371-3p und das MRT als alternative Ansätze zur Dignitätsbeurteilung von STM thematisiert.
Risikogruppierung bei Stadium-I-Seminomen
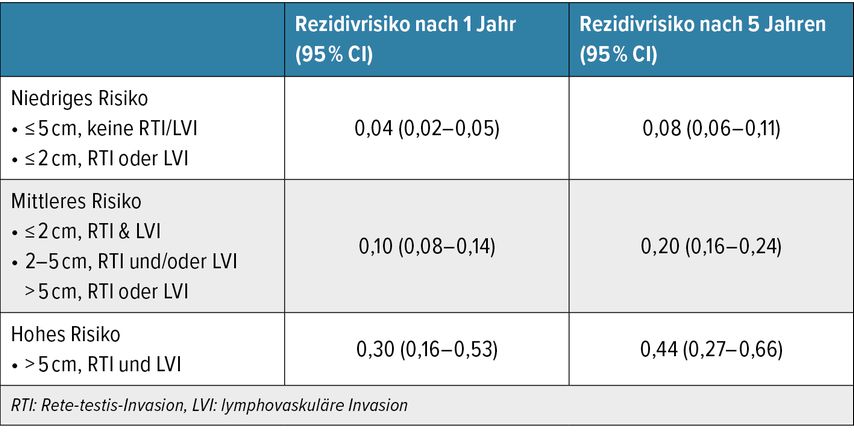
Die EAU-Leitlinien zu Hodentumoren empfehlen aktuell die AS als bevorzugte Strategie in der adjuvanten Therapie des Seminoms im klinischen Stadium I (pT1–4, cN0, cM0, S0). Diese Empfehlung beruht u.a. auf der schwachen und kontroversen Datenlage zu den klassischen Risikofaktoren bei Seminomen (Tumorgröße ≥4cm und Rete-testis-Invasion, RTI). In einer Analyse des EAU-Leitlinienpanels zu Hodentumoren wurde eine neue Risikogruppierung vorgestellt, die insbesondere eine neue Hochrisikopopulation (Tumoren >5cm mit RTI und lymphovaskulärer Invasion) mit einem kumulativen Rezidivrisiko von 30% nach einem Jahr und 44% nach 5 Jahren identifiziert (Tab. 1). Die Autoren schlussfolgern, dass die adjuvante Systemtherapie dieser Hochrisikogruppe vorbehalten sein sollte und für Patienten mit niedrigem bis mittlerem Risiko die AS weiterhin bevorzugt empfohlen wird.
Tab. 1: Neue Risikogruppierung des EAU-Leitlinienpanels zu Seminomen im klinischen Stadium I (nach Boormans JL et al.: Eur Urol Oncol 2023)
Therapie von Stadium-IIa/b-Seminomen
Zurzeit empfehlen die EAU-Leitlinien eine Systemtherapie mit 3–4 Zyklen einer Cisplatin-haltigen Kombination bei Seminomen im Stadium IIa/b (N1/N2, Lymphknoten <2cm/2–5cm). Aufgrund der Langzeittoxizität der Chemotherapie (Kardiotoxizität, Zweittumoren) und der dadurch nachweislich eingeschränkten Lebenserwartung von Überlebenden werden alternative Therapieansätze wie z.B. die retroperitoneale Lymphadenektomie (RLA) bei Seminomen im Sinne einer Deeskalation untersucht. Die Rezidivraten lagen in den derzeit vorliegenden Studien zur RLA bei Seminomen zwischen 5 und 30%, was u.a. den sehr heterogenen Studiendesigns geschuldet sein dürfte. In der EAU-Hauptsession zu Hodentumoren wurden dieses Jahr keine neuen Daten zur RLA bei Seminomen vorgestellt, allerdings wurden zwei zurzeit rekrutierende, prospektive Studien vorgestellt: die PRIMETEST-II-Studie und die SAKK01/18-Studie. Als Folgestudie zur PRIMETEST werden in der PRIMETEST-II-Studie Risikofaktoren für ein Rezidiv nach robotischassistierter RLA untersucht und Patienten mit einem hohen Rezidivrisiko können sich optional für einen adjuvanten BEP-Zyklus (Bleomycin, Etoposid und Cisplatin) entscheiden. Da die RLA beim Seminom als komplexer Eingriff vorrangig in spezialisierten Zentren durchgeführt werden sollte, untersucht die SAKK01/18-Studie als Folgestudie zur negativ ausgefallenen SAKK01/10-Studie die potenziell auch dezentralisiert anwendbare sequenzielle Radiochemotherapie. Die ersten Ergebnisse dieser beiden Studien dürfen wir voraussichtlich 2026 erwarten.
Peniskarzinom
Stadium cN0: Rolle von DSNB und ILND
Im bereits erwähnten thematischen Vortrag „Unveiling the unseen“ wurde die Rolle der dynamischen Sentinellymphknotenbiopsie (DSNB) und der inguinalen Lymphadenektomie (ILND) beim Peniskarzinom im Stadium cN0 (keine inguinalen Lymphknoten palpabel) diskutiert. Ab einem Primum ≥pT1b-Tumorstadium liegt das Risiko für eine okkulte Lymphknotenmetastasierung (LNM) bei 20–25%. Die EAU-Leitlinie empfiehlt ein invasives Lymphknotenstaging mittels DSNB. Sollte der Sentinellymphknoten tumorbefallen sein, sollte die DSNB mit einer ILND komplettiert werden, welche allerdings in >80% der Fälle keine weiteren LNM detektiert. Mit verlässlichen Prädiktoren für das Vorliegen weiterer LNM könnte die Morbidität der ILND aufgrund ihrer hohen Komplikationsrate von 21–55% einigen Patienten erspart bleiben. In diesem Kontext wurde eine retrospektive Analyse von 407 ILND nach positiver DSNB präsentiert. Die ILND zeigte auch in dieser Analyse in den meisten Fällen (84%) keine weiteren LNM nach positiver DSNB. Es konnte zwar ein Zusammenhang zwischen der Zahl der positiven Lymphknoten in der DSNB (Odds-Ratio [OR]: 2,19) und dem größten LNM-Durchmesser (OR: 1,06) gezeigt werden, ein prädiktiver Wert ergab sich daraus allerdings nicht. Im Sinne der onkologischen Sicherheit sollte die DSNB bei positivem Befund also auch weiterhin mit einer ILND komplettiert werden. In der Diskussion der Studienergebnisse am Kongress bestand ein deutlicher Konsens über die Wichtigkeit, Patienten gut über Nutzen und Risiken des Eingriffs zu informieren sowie vorliegende Komorbiditäten zu berücksichtigen.
Lymphovenöser Bypass während ILND
Durch die Modernisierung der ILND als (robotischassistierte) videoendoskopische ILND, auch (RA)VEIL, können zwar unmittelbare Komplikationen wie Wundheilungsstörungen bei gleichbleibender LN-Ausbeute verringert werden, die Rate der Langzeitkomplikationen und insbesondere die Entstehung von Lymphödemen der unteren Extremität bleiben dadurch allerdings unverändert. In einem Videoabstract einer Schweizer Arbeitsgruppe wurde hierzu der „Lymphatic Microsurgical Preventive Healing Approach“ (LYMPHA) vorgestellt. Im Rahmen der ILND wurde bei diesem Eingriff Indocyaningrün (ICG) subkutan in den Zehenzwischenräumen appliziert, um die abführenden Lymphgefäße anschließend unter einer ICG-Kamera darzustellen. Diese wurden dann mikrochirurgisch unter einem Operationsmikroskop mit einer parallel verlaufenden Vene anastomosiert, um den Lymphabfluss auch nach Unterbrechung der proximalen Lymphgefäße zu gewährleisten. Es wurden bisher zwar nur drei Patienten mit dieser Methode behandelt, doch die Ergebnisse sind vielversprechend: Keiner der Operierten hatte 30 Tage postoperativ ein Lymphödem und bei keinem kam es bis 90 Tage postoperativ zu einer Zellulitis.
Metastasiertes Plattenepithelkarzinom des Penis
Als Erstlinientherapie bei metastasiertem Peniskarzinom empfiehlt die EAU-Leitlinie Platin-basierte Kombinationstherapien, die Datenlage zu effektiven Zweitlinientherapien ist allerdings schwach. In einem deutschen Abstract wurde das bereits von anderen Tumorentitäten bekannte Oberflächenprotein TROP-2 als potenzielles Target und Marker beim metastasierten Peniskarzinom vorgestellt. In dieser Analyse konnte eine hohe immunhistochemische Expression von TROP-2 sowohl im Primum als auch in Rezidiven und Metastasen nachgewiesen werden. Gleichzeitig konnte eine Analyse der Serum-TROP-2-mRNA unterschiedliche Expressionen bei Patienten mit metastasiertem Peniskarzinom und einer gesunden Kontrollgruppe zeigen. Demnach könnte das TROP-2-gerichtete Antibody-Drug-Konjugat Sacituzumab-Govitecan, welches bereits im SMART-Trial bei seltenen urogenitalen Tumoren untersucht wird, eine potenzielle Therapieoption bei metastasiertem Peniskarzinom sein.
Literatur:
bei den Verfassern
Das könnte Sie auch interessieren:
Welche Rolle spielt Spermien-DNA-Fragmentierung bei Kinderwunsch?
Ein unerfüllter Kinderwunsch betrifft 15–20% der Paare weltweit.1 Die Ursachen der Unfruchtbarkeit sind gleichmäßig auf beide Geschlechter verteilt.2 In den vergangenen Jahren hat das ...
„PSMAddition muss die Therapie des mHSPC in Österreich verändern“
Die PSMAddition-Studie könnte die Behandlung des metastasierten hormonsensitiven Prostatakarzinoms grundlegend verändern. Was die Studie, die mit maßgeblichem Beitrag von ...
ESMO 2025: neue Therapiekonzepte beim Urothelkarzinom
Der diesjährige ESMO stand ganz im Zeichen des Urothelkarzinoms. Neue Studiendaten beim nichtmuskelinvasiven, muskelinvasiven und metastasierten Urothelkarzinom eröffnen Perspektiven für ...

.jpg)
