Nierenzellkarzinom: Update zu Diagnostik, Therapie und translationaler Forschung
Autorin:
Dr. Katharina Reiter, PhD
Urologische Abteilung mit Ambulanz und Spezialambulanzen, Klinik Ottakring
Am diesjährigen EAU-Kongress in Paris fanden zahlreiche Sitzungen, Vorträge und Diskussionen zum Nierenzellkarzinom (RCC) statt. Es wurden Kontroversen in der initialen Diagnostik sowie zum Stellenwert der Chirurgie, Strahlentherapie und systemischen Therapie im lokal fortgeschrittenen und oligometastasierten Setting aufgezeigt. Besonders interessant waren die klinischen Überlegungen und neuesten Erkenntnisse zur Immuntherapie sowie zur Grundlagenforschung beim RCC. Die kommenden Jahre versprechen eine Übertragung dieser Ergebnisse in die klinische Praxis.
Keypoints
-
Die Anwendung von Radiomics und künstlicher Intelligenz wird zukünftig vermehrt in die Diagnostik einfließen.
-
Die Wirksamkeit von adjuvantem Pembrolizumab (KEYNOTE-564) bleibt unumstritten – eine patientenorientierte Abwägung der potenziellen (lebensverändernden) Nebenwirkungen ist essenziell.
-
Beim oligometastasierten RCC hat eine zytoreduktive Nephrektomie nach wie vor Berechtigung und in diesem Setting wird auch die Strahlentherapie vermehrt zur Anwendung kommen.
-
Neue Studienergebnisse raten von wiederholter Gabe von Immuntherapeutika beim mRCC eher ab und zeigten die Effektivität einer Therapiedeeskalation.
-
Translationale Forschung liefert vielversprechende Ergebnisse zu zirkulierender Tumor-DNA, künstlicher Intelligenz und neuen therapeutischen Ansätzen.
Diagnostik und initiales Staging beim RCC
Grundsätzlich weisen konventionelle Verfahren der Bildgebung wie Computertomografie (CT) oder Magnetresonanztomografie (MRT) in der Detektion von Raumforderungen der Niere eine akzeptable Spezifität von 88% (CT und MRT) und eine Sensitivität von 75% bzw. 89% auf (CT bzw. MRT ).1 Die Genauigkeit der konventionellen Verfahren dürfte bei der Detektion von Lymphknotenbeteiligungen oder bei pT3a-Erkrankungen limitiert sein. Ein zukünftiger Einsatz von maschinellem Lernen und künstlicher Intelligenz (KI) könnte die Ergebnisse von CT und MRT verbessern. Die Extraktion großer vorhandener Datenmengen zu Form, Größe, Textur etc. wird unter dem Begriff Radiomics zusammengefasst. Diesewird verwendet, um durch Informationen über diese Eigenschaften beispielsweise ein RCC von Onkozytomen zu unterscheiden.2 In Zukunft könnten diese Algorithmen in Vorhersagemodelle einfließen, um weitere Informationen aus konventionellen Schnittbildern zu erhalten und somit die Sensitivität und Genauigkeit zu verbessen.3
Außerdem wurden Neuerungen der molekularen Bildgebung vorgestellt. Girentuximab, ein Antikörper der CarboanhydraseIX, dürfte als Positronen-Emissions-Tomografie(PET)-Tracer mit einer hohen Genauigkeit kleine Nierentumoren erkennen. Die multizentrische, internationale Studie ZIRCON zum klinischen Einsatz dieser PET-Bildgebung vor partieller oder kompletter Nephrektomie zeigte bei Tumoren ≤7cm (cT1) eine Sensitivität von 85,5% und eine Spezifität von 87%. Da durch die zunehmende Anwendung von Schnittbildverfahren die Inzidenz von kleineren Tumoren der Niere ansteigt, könnte der PET-Tracer Girentuximab zur Beurteilung der Malignität und für weitere Therapieentscheidungen herangezogen werden.4
Lokalisiertes RCC: Chirurgie und adjuvante Immuntherapie
In kurzen Pro- und Kontra-Sitzungen wurde zur Therapie des lokalisierten RCCs diskutiert: Wie sollte man die Nachsorge bei pT1a-Tumoren mit positiven Resektionsrändern gestalten? Und welchen Stellenwert hat die Entfernung der Lymphknoten beim Hochrisiko-RCC? Die Diskussionen zu diesen Fragen drehten sich schließlich auch um die aktuell existierenden Risiko-Scores wie IMDC-Kriterien oder Leibovich-Scoring-System, welche Limitationen in der prognostischen Genauigkeit aufweisen dürften. Hier wünschen sich die Vortragenden weitere Forschung an Biomarkern, die Rezidive zuverlässiger vorhersagen könnten.
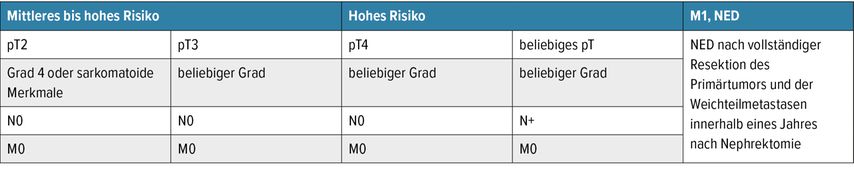
Vor allem aber standen Fragen und Austausch rund um die praxisverändernde KEYNOTE-564-Studie im Mittelpunkt. Es wurde die Wirksamkeit von adjuvanter Immuntherapie mit Pembrolizumab bei Patienten mit erhöhtem Rezidivrisiko bestätigt. Da sich sowohl das krankheitsfreie Überleben als auch das Gesamtüberleben in allen Risikogruppen (Tab. 1) verbesserten, fand die adjuvante Gabe von Pembrolizumab Einzug in die Leitlinien.5 Vor Therapiebeginn ist es wichtig, dass eine patientenorientierte Aufklärung stattfindet. Diese sollte beinhalten, dass eine Reduktion des relativen Risikos von etwa 40% (HR: 0,63) einem absoluten Benefit von lediglich 5–10% entspricht und Gruppen mit höherem Risiko einen größeren Vorteil im krankheitsfreien Intervall haben dürften.5 Des Weiteren ist anzumerken, dass Immuntherapien auch mit Toxizitäten verbunden sind, die sich mitunter lebensverändernd auswirken können. Die dementsprechende Anzahl benötigter Behandlungen, um einen Todesfall zu verhindern, beträgt 16 Patienten. Etwa 3 dieser 16 Patienten entwickeln jedoch etwa eine Grad-3- oder -4-Nebenwirkung. Nach wie vor bleibt bei den Diskussionen rund um die adjuvante Immuntherapie offen, warum bisherige Studien mit ähnlichem Design (CheckMate 914, IMmotion010, PROSPER) keinen Vorteil zeigen konnten und ob sich zukünftige Forschung vermehrt auf Biomarker konzentrieren sollte, um „den richtigen Patienten für die richtige Therapie“ zu finden.
Tab. 1: Einschlusskriterien nach Risikogruppen für die KEYNOTE-564-Studie; NED: kein Nachweis von Krankheit („no evidence of disease“); (modifiziert nach Choueiri TK et al. 2024)5
Zytoreduktive Therapie beim oligometastasierten RCC
Auch Jahre nach den Publikationen CARMENA und SURTIME wird der Stellenwert der zytoreduktiven Nephrektomie in Zeiten von Immuncheckpoint-Inhibitoren (ICI) diskutiert. Patienten, welche eine Upfront-Nephrektomie und später ICI erhielten, hatten eindeutig Vorteile im Gesamtüberleben (HR: 0,61; 54 Monate vs. 22 Monate ohne zytoreduktive Nephrektomie).6 Die Entscheidung, ob bei intermediärem Risiko die Nephrektomie direkt oder erst verzögert stattfinden soll, sollte individuell getroffen werden. Nicht jeder Patient benötigt eine sofortige systemische Therapie, weil die Art und das Verhalten einzelner Metastasen ebenfalls Therapieentscheidungen beeinflussen sollten.
Weitere therapeutische Ansätze erscheinen im oligometastasierten Setting interessant. Eigentlich galt das RCC als strahlenresistentes Karzinom. Eine Metaanalyse zur stereotaktischen Radioablation zeigte jedoch nach einem Jahr eine ca. 90%ige lokale Tumorkontrolle sowohl von intra- als auch extrakraniellen Läsionen beim oligometastasierten RCC.7 Entscheidungen und Indikationen zur Radiatio können sich ergeben:
-
aus der Alternative zur systemischen Therapie, wenn z.B. nur singuläre Metastasen vorliegen,
-
aus der Kombination mit einer Immuntherapie, da es hierunter zu einem Synergismus kommt: Die Freisetzung von Tumorantigenen und Zytokinen transformiert die Tumormikroumgebung und lockt zytotoxische T-Zellen an,8 und
-
aus Gründen einer Verzögerung der nächsten systemischen Therapie bei langsam fortschreitender Erkrankung.
In Zukunft werden dazu vor allem Studien zur Kombination aus Radiatio mit Immuntherapie erwartet.
Zukunft der Immuntherapie
In mehreren Sitzungen wurden die Vorteile, Limitationen und zukünftigen Anwendungsgebiete der Immuntherapie diskutiert. In den letzten 17 Jahren hat die Kombinationstherapie mit ICI zur Verdopplung der Überlebenszeit beim metastasierten RCC (mRCC) beigetragen. Eine aktuelle Frage, die es zu klären gilt, ist, ob ein ICI in späteren Therapielinien neuerlich zur Anwendung kommen kann. Ergebnisse der CONTACT-03-Studie lassen von einer weiteren Erhaltungstherapie nach Progression mit Atezolizumab abraten.9 Allerdings hatten in retrospektiven Studien etwa 20% der Patienten ein Ansprechen bei einer neuerlichen Behandlung mit ICI.10,11
Ein Vorschlag zur Verbesserung der Ansprechraten für ICI wäre eine Therapieintensivierung. In der Studie COSMIC-313 zeigte die Triple-Therapie bestehend aus Cabozantinib, Nivolumab und Ipilimumab zwar einen Vorteil im progressionsfreien Überleben, die Nebenwirkungen und hohen Abbruchraten dürften allerdings die Anwendung limitieren (Grad-3–4-Nebenwirkungen in 79% vs. 56% in der Kontrollgruppe; Abbruchrate 12% vs. 5%).12 Konträr zu dieser Studie wurden auch Schemata zur Therapiedeeskalation diskutiert. Die PRISM-Studie konnte bei einer Aufweitung der Therapieintervalle von 3 auf 12 Wochen eine Reduktion der Grad-3- und -4-Toxizität ohne Einbußen der Effektivität erreichen.13
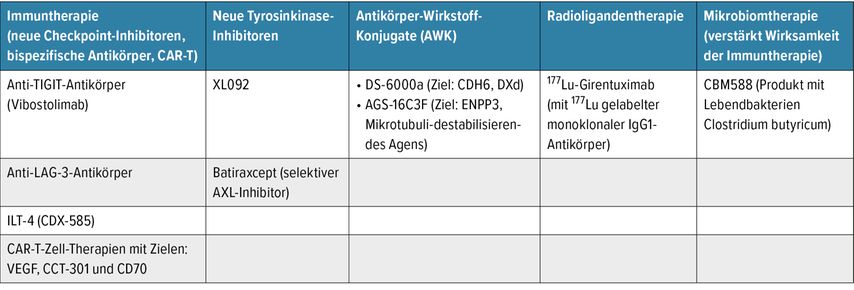
Zukünftig werden beim mRCC neue Immuntherapeutika sowie weitere Wirkstoffkombinationen mit ICI erwartet (Tab. 2).14 Auch in Hinsicht auf personalisierte Medizin erhofft man sich durch Bestimmung molekularer Subtypen oder der Tumormutationslast eine bessere Vorhersage über die Wirksamkeit der ICI.
Tab. 2: Laufende Studien in frühen Phasen mit neuen Wirkstoffen und Medikamentenklassen für die Behandlung des mRCC (modifiziert nach EAU 2024, Präsentation Vogl U: Immune checkpoint therapy in kidney cancer. Have we reached the limit?)14
Aktuelle translationale Forschungsschwerpunkte
Zahlreiche Abstracts widmeten sich auch der Schnittstelle zwischen Grundlagenforschung und Übertragung in die klinische Praxis. Hier sind 3 Ansätze hervorzuheben:
Die Rolle der zirkulierenden Tumor-DNA (ctDNA) beim mRCC
Eine nichtinvasive Methode zur Detektion von genetischen Alterationen ist die LiquidBiopsy. Hierbei kann ctDNA im Patientenblut mittels Next-Generation-Sequencing untersucht werden. Eine Gruppe aus Japan entdeckte, dass bei mRCC-Patienten Alterationen in bestimmten Genen (DNMT3A, TP53, VHL, TET2, BAP1, TERT, PBRM1) häufiger auftreten. Weiters dürften diese DNA-Veränderungen mit einem verkürzten Gesamtüberleben, einer schlechteren Prognose und kürzerer Zeit bis zum Fortschreiten der Erkrankung zusammenhängen.15
Künstliche Intelligenz zur Beurteilung von Nierentumoren
Ein Forschungsteam aus Shanghai entwickelte mit mehr als 13000 Mehrphasen-CTs ein Deep-Learning-Modell, welches zwischen malignen und benignen Nierentumoren sowie deren Aggressivitätspotenzial unterscheiden kann. Die Befunde der KI zeigten eine höhere prognostische Genauigkeit verglichen mit den Ergebnissen erfahrener Radiologen. Weiters wurde durch das KI-Modell die Überlebensrate genauer vorhergesagt als durch bisher verfügbare Tools (Radiomics, RENAL Nephrometry Nomogramm, ISUP-Grad oder TNM-Stadium). Zukünftig könnten also KI-gestützte CT-Analysen in Behandlungsentscheidungen einfließen.16
Therapieansatz mittels modifizierter zytotoxischer T-Lymphozyten
In einem orthotopen Mausmodell untersuchten Forscher aus München die Wirksamkeit der adoptiven T-Zell-Therapie (ATT) zur Behandlung des RCC. Chimäre kostimulatorische Schaltproteine (CSPs) wurden entwickelt, um T-Zellen zu aktivieren. Die Mäuse entwickelten nach Implantation von RCC-Tumorzellen solide Tumoren. Jene Mäuse, die mit CSP-modifizierten T-Zellen behandelt wurden, zeigten eine signifikante Größenreduktion der Tumormasse. Vor einer klinischen Anwendung am Patienten sind hier noch weitere Analysen angezeigt. Die verbesserte Wirkung der ATT könnte allerdings einer Vielzahl an Patienten mit soliden Tumoren zugutekommen.17
Fazit und Ausblick
Die Diskussionen und Sitzungen am EAU-Kongress 2024 verdeutlichen den Stellenwert von Forschung und Innovationen beim RCC. Uroonkolog:innen können dank neuer Technologien und zahlreicher laufender Studien zu therapeutischen und translationalen Ansätzen in Zukunft eine Verbesserung der Behandlung von Patienten mit RCC erwarten.
Literatur:
1 Vogel C et al.: Imaging in suspected renal-cell carcinoma: systematic review. Clin Genitourin Cancer 2019; 17(2): e345-e5 2 Coy H et al.: Deep learning and radiomics: the utility of Google TensorFlow Inception in classifying clear cell renal cell carcinoma and oncocytoma on multiphasic CT. Abdom Radiol (NY) 2019; 44(6): 2009-20 3 Garnier C et al.: A CT-based clinical, radiological and radiomic machine learning model for predicting malignancy of solid renal tumors (UroCCR-75). Diagnostics (Basel) 2023; 13(15): 2548 4 Shuch BM et al.: Results from phase 3 study of 89Zr-DFO-girentuximab for PET/CT imaging of clear cell renal cell carcinoma (ZIRCON). J Clin Oncol 2023; 41(6_suppl): LBA602-LBA 5 Choueiri TK et al.for the KEYNOTE-564 Investigators: Overall survival with adjuvant pembrolizumab in renal-cell carcinoma. N Engl J Med 2024; 390(15): 1359-71 6 Bakouny Z et al.: Upfront cytoreductive nephrectomy for metastatic renal cell carcinoma treated with immune checkpoint inhibitors or targeted therapy: an observational study from the International Metastatic Renal Cell Carcinoma Database Consortium. Eur Urol 2023; 83(2): 145-51 7 Zaorsky NG et al.: Stereotactic ablative radiation therapy for oligometastatic renal cell carcinoma (SABR ORCA): a meta-analysis of 28 studies. Eur Urol Oncol 2019; 2(5): 515-23 8 Siva S et al.: Stereotactic radiotherapy and short-course pembrolizumab for oligometastatic renal cell carcinoma-the RAPPORT Trial. Eur Urol 2022; 81(4): 364-72 9 Pal SK et al.: Atezolizumab plus cabozantinib versus cabozantinib monotherapy for patients with renal cell carcinoma after progression with previous immune checkpoint inhibitor treatment (CONTACT-03): a multicentre, randomised, open-label, phase 3 trial. Lancet 2023; 402(10397): 185-95 10 Ravi P et al.: Evaluation of the safety and efficacy of immunotherapy rechallenge in patients with renal cell carcinoma. JAMA Oncol 2020; 6(10): 1606-10 11 Vauchier C et al.: REchallenge of NIVOlumab (RENIVO) or nivolumab-ipilimumab in metastatic renal cell carcinoma: an ambispective multicenter study. J Oncol 2022; 2022: 3449660 12 Choueiri TK et al.: Cabozantinib plus nivolumab and ipilimumab in renal-cell carcinoma. N Engl J Med 2023; 388(19): 1767-78 13 Vasudev NS et al.: Standard versus modified ipilimumab, in combination with nivolumab, in advanced renal cell carcinoma: arandomized phase II trial (PRISM). J Clin Oncol 2024; 42(3): 312-23 14 Vogl U: Thematic Session: Immune checkpoint therapy in kidney cancer: Have we reached the limit?, präsentiert am 5. April 2024, 39th Annual EAU Congress, Paris2024 15 Kato T et al.: A0705 - Genomic profiling and clinical utility of circulating tumor DNA in metastatic renal cell carcinoma: nationwide SCRUM-Japan MONSTAR SCREEN project. Eur Urol2024; 85: S1665 16 Xiong Y et al.: A0458 - Artificial intelligence links pre-operative multi-phase CT images to pathologic features, survival outcomes and biological behaviors of renal masses using real-world data. Eur Urol 2024; 85: S1320 17 Linxweiler J et al.: A0271 - Enhancing immunotherapy in renal cell carcinoma by engineering cytotoxic T lymphocytes with chimeric costimulatory switch proteins. Eur Urol 2024; 85: S1059
Das könnte Sie auch interessieren:
Kinderurologie Linz: Bekanntes Gesicht übernimmt Primariat
Seit 1. Juli hat die Kinderurologie des Ordensklinikums Linz Barmherzige Schwestern mit Prim. Priv.-Doz. Dr. Dr. Bernhard Haid, FEAPU, FEBU, einen neuen Abteilungsleiter.
Einblicke in die Rolle von „large language models“ in der urologischen Bildung
Die rasante Entwicklung der künstlichen Intelligenz (KI) hat auch das Feld der Medizin erfasst. In einer vergleichenden Analyse wurden große Sprachmodelle wie ChatGPT und BingAI anhand ...
Rolle der KI bei Steinleiden: Ist dies die Zukunft?
Künstliche Intelligenz hat mittlerweile Einzug in die moderne Medizin gehalten. Von computergestützter Patientenselektion und -aufklärung, über die Diagnostik bis zu Therapiealgorithmen ...