PCR-Diagnostik bei akuten pulmonalen Infektionen
Autoren:
Med. pract. Subhash Manguluri1
Dr. med. Jonathan Röcken2
Dr. med. Andrei Darie2
1Klinik für Pneumologie, Luzerner Kantonsspital
2Klinik für Pneumologie, Universitätsspital Basel
Korrespondenz:
E-Mail: andrei.darie@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Pneumonie ist eine der führenden Ursachen für Morbidität und Mortalität weltweit. Eine frühzeitige und adäquate Therapie ermöglicht jedoch häufig einen günstigen Verlauf. Um eine zielgerichtete Behandlung etablieren zu können, bedarf es einer präzisen und schnellen mikrobiologischen Diagnostik, wobei neuere diagnostische Verfahren, wie die PCR-Untersuchung, die konventionell erhobene mikrobiologische Kultur ergänzen kann.
Keypoints
-
Die «stille Pandemie» der Antibiotikaresistenz ist ein weltweit drängendes Gesundheitsproblem, weshalb eine rigorosere Leitlinienadhärenz anzustreben ist.
-
Im Vergleich zu traditionellen (Bakterien-)Kulturen bietet die Multiplex-PCR eine schnellere und sensitivere Identifizierung von Erregern.
-
Durch Integration in bestehende Antibiotic-Stewardship-Programme kann die Multiplex-PCR zu einer Reduktion inadäquater Antibiotikatherapien führen und somit zur Eindämmung bakterieller Resistenzentwicklungen beitragen.
Basierend auf den Daten des Bundesamtes für Statistik wurden in der Schweiz im Jahr 2022 fast 30000 Patienten aufgrund einer Pneumonie hospitalisiert. Neben einer zeitnahen Erkennung der zugrunde liegenden Erreger verbessert vor allem eine frühzeitige Therapie die Prognose, weshalb die internationalen Richtlinien zu einer initialen empirischen Therapie raten. Dabei muss beachtet werden, dass potenzielle Erreger, seien es Bakterien, Viren oder Pilze, häufig zu überlappenden klinischen Krankheitsbildern führen können. Bei der Therapiewahl muss nicht nur die lokale epidemiologische Lage berücksichtigt werden, sondern auch der Immunstatus des Patienten. Risikofaktoren, wie eine kürzlich erfolgte Antibiotikatherapie oder Hospitalisationen, erhöhen die Gefahr einer durch gramnegative Bakterien verursachten Pneumonie und erfordern die Abdeckung eines breiteren antimikrobiellen Spektrums. Da eine unangemessene Therapie zu einer zunehmenden bakteriellen Resistenzentwicklung führen kann, sollte die empirische breit aufgestellte Antibiotikatherapie anhand eingehender mikrobiologischer Diagnostik, wo möglich, frühzeitig angepasst werden. Neben Methicillin-resistentem Staphylococcus aureus (MRSA) stellen multiresistente gramnegative Bakterien wie Enterobakterien, Pseudomonas und Acinetobacter eine erhebliche Bedrohung für die öffentliche Gesundheit dar.
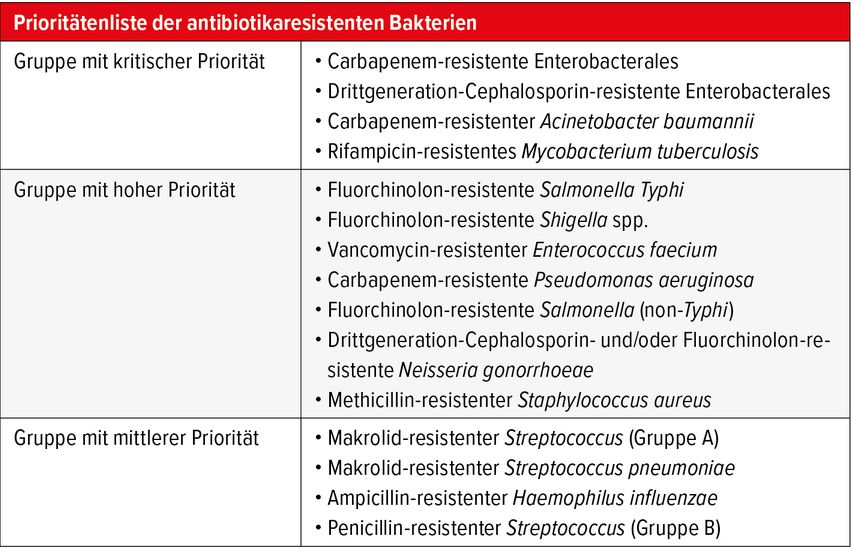
Im Mai 2024 präsentierte die Weltgesundheitsorganisation (WHO) die Herausforderungen, welche durch antimikrobielle Resistenzen entstehen, und zeigte die weltweite Verbreitung von resistenten Bakterienstämmen sowie die daraus resultierenden Konsequenzen für die öffentliche Gesundheit.1 Zudem haben die Autoren die Prioritätenliste der gefährlichsten Bakterienstämme aktualisiert, wobei ein besonderer Fokus auf gramnegativen Bakterien liegt (Tab. 1). Die ergänzende Arbeit der Antimicrobial Resistance Collaborators verdeutlichte die weltweite Belastung durch antimikrobielle Resistenzen. Demnach wurden im Jahr 2019 weltweit 4,95 Millionen Todesfälle durch resistente Bakterien verzeichnet, wovon 1,27 Millionen ausschliesslich auf die Resistenz zurückzuführen waren.2 Infektionen der unteren Atemwege waren dabei mit 1,5 Millionen Todesfällen an erster Stelle.
Tab. 1: WHO-Prioritätsliste der antibiotikaresistenten Bakterien (adaptiert nach der WHO Bacterial Priority Pathogens List, 2024)1
Aufgrund der klinischen Relevanz, der Dimensionen sowie der damit einhergehenden sozioökonomischen Auswirkungen, wird auch von der «stillen Pandemie» der antimikrobiellen Resistenz gesprochen. Um Resistenzen vorzubeugen und die Wirksamkeit von Antibiotika zu erhalten, werden Antibiotic-Stewardship-Programme implementiert, wobei neben der Richtlinienadhärenz auch die rechtzeitige Deeskalation der Therapie zentral ist. Eine zielgerichtete Behandlung mit schmalerem Wirkungsspektrum wird jedoch oft erst dann möglich, wenn die mikrobiologische Diagnostik zur Identifizierung des Erregers führt.
Konventionelle vs. PCR-Diagnostik
In einer amerikanischen Studie untersuchten Jain et al. bei hospitalisierten Patienten mit ambulant erworbener Pneumonie die diagnostische Qualität verschiedener Diagnostikverfahren, einschliesslich Sputum- und Blutkulturen, viralen PCR-Abstrichs und Urin-Antigen-Tests. Eine ätiologische Einordnung der Pneumonie war dabei in 38% der Fälle möglich. Ein bakterieller Erreger wurde nur in 14% detektiert.3 Erwähnenswert ist, dass hier nur bei 3% der Patienten eine Bronchoskopie durchgeführt wurde. Ranzani et al. zeigten in ihrer Studie, dass in spezifischen Situationen, insbesondere bei Patienten mit schwerer Pneumonie oder bei immunsupprimierten Patienten, invasivere Methoden wie die Bronchoskopie die Identifizierung von Erregern deutlich verbessern können (56% vs. 39%).4 Obwohl hier die Sensitivität der mikrobiologischen Kultur durch invasiveres Sampling verbessert wird, bleibt fast die Hälfte der Patienten ohne Erregernachweis. Ein weiterer Nachteil der Kultur ist die zeitliche Latenz von circa 48 Stunden bis zum Erhalt der Ergebnisse.
Die Leitlinien der American Thoracic Society (ATS) sowie die Stellungnahme der Infectious Diseases Society of America (IDSA) betonten den zunehmenden Bedarf an präziseren und schnelleren Diagnoseverfahren, um das Outcome für Patienten mit Pneumonien zu verbessern und das Risiko für die Entwicklung von Antibiotikaresistenzen durch eine gezieltere antimikrobielle Therapie zu verringern.5,6
Die Covid-19-Pandemie hat die Bekanntheit und den Einsatz der Polymerase-Kettenreaktion (PCR) erheblich gefördert. Bereits seit einigen Jahren ist die PCR als ergänzende Methode zur Diagnose bakterieller Pneumonien etabliert. Sie ermöglicht es, spezifische DNA-Sequenzen von Erregern schnell und sensitiv nachzuweisen. Anhand von Multiplex-PCR-Analyseverfahren können zeitgleich multiple erregerspezifische Sequenzen aus einer Probe wie z.B. einer bronchoalveolären Lavage (BAL) innerhalb von 2 bis 4 Stunden mit hoher Sensitivität nachgewiesen und damit verschiedene Erreger (z.T. inklusive Resistenzmuster) identifiziert werden.
PCR-Diagnostik und Antibiotic Stewardship
Obwohl die PCR innerhalb von Stunden spezifische Erreger identifizieren kann, führt dies im klinischen Alltag nicht automatisch zu einer optimierten Antibiotikatherapie. In einer Kohorte mit vorwiegend immunsupprimierten Patienten untersuchten Salina et al. die BAL mittels konventioneller Kultur und in zwei Drittel der Fälle auch mit einer PCR.7 Trotz des vorzeitigen Vorliegens der PCR-Resultate konnte kein signifikanter Unterschied in der Therapiedauer und der Anzahl der verschriebenen Antibiotika festgestellt werden. In einer darauffolgenden Studie bei Patienten mit Pneumonie und Risikofaktoren für eine Infektion mit gramnegativen Erregern wurde das PCR-Resultat aus der BAL an eine Therapieempfehlung gekoppelt. Dies führte zu einer Reduktion der inadäquaten Antibiotikatherapien (Anpassung des Therapiespektrums) um 45% sowie einer Reduktion der antibiotischen Therapie insgesamt um 22%.8 Das unterstreicht die Komplexität des Antibiotic Stewardship im klinischen Alltag, die über die PCR-Technologie hinausgeht. Zusätzlich sind eine sorgfältige Interpretation der PCR-Ergebnisse im klinischen Kontext, klare Richtlinien sowie Schulungen für das medizinische Personal erforderlich.
PCR-Diagnostik auf der Intensivstation
Insbesondere auf Intensivstationen (IPS) könnten die Vorteile der PCR-Diagnostik optimal genutzt werden, da bei kritisch kranken Patienten kombinierte Antibiotikatherapien frühzeitig initiiert werden und in der Regel die Ressourcen vorhanden sind für eine aufwendigere Diagnostik und die rasche Umsetzung der Resultate.
Es wurde geschätzt, dass die PCR-Diagnostik in 40% der Fälle zu einer Anpassung der Antibiotikatherapie führen könnte.9 In einer darauffolgenden Studie wurden 200 IPS-pflichtige Patienten mit einer Pneumonie hinsichtlich einer PCR oder konventionellen mikrobiologischen Testung randomisiert.10 Die Patienten in der PCR-Gruppe bekamen deutlich früher eine ergebnisangepasste Therapie (2,3 vs. 46,1Std.). Zudem konnte die Antibiotikatherapie in der PCR-Gruppe schneller (4,8 vs. 46,5Std.) und häufiger (42% vs. 8%) deeskaliert werden. Die 2023 herausgegebenen Leitlinien der Europäischen Gesellschaften für Pneumologie, Intensivmedizin, Mikrobiologie und Infektiologie empfehlen, entnommene Proben aus den unteren Atemwegen für eine Multiplex-PCR-Testung einzusenden, sobald Breitspektrumantibiotika für eine schwere Pneumonie verschrieben oder in Betracht gezogen werden.11
Zusammenfassend kann festgehalten werden, dass die Multiplex-PCR eine schnellere und empfindlichere Diagnostik von Infektionen der unteren Atemwege im Vergleich zu herkömmlichen Methoden ermöglicht. Diskrepante Resultate zwischen PCR-Diagnostik und Bakterienkultur bleiben herausfordernd, benötigen bei der Interpretation klinische Expertise und sollten unter Berücksichtigung der Stärken und Grenzen jeder Methode gewertet werden. Zukünftig gilt es, die Genauigkeit und Bandbreite der Multiplex-PCR weiter zu optimieren und diese mit einer unmittelbaren Resistenztestung zu verknüpfen, um eine bestmögliche Patientenversorgung zu gewährleisten.
Literatur:
1 World Health Organization; Impact Initiatives and Research Coordination (IRC): WHO bacterial priority pathogens list, 2024: Bacterial pathogens of public health importance to guide research, development and strategies to prevent and control antimicrobial resistance. WHO 2024 2 Antimicrobial Resistance Collaborators: Lancet 2022; 399: 629-55 3 Jain S et al.: N Engl J Med 2015; 373: 415-27 4 Ranzani OT et al.: Crit Care 2019; 23: 51 5 Hanson KE et al.: Clin Infect Dis 2020; 71: 2744-51 6 Metlay JP et al.: Am J Respir Crit Care Med 2019; 200: e45-e67 7 Salina A et al.: ERJ Open Res 2022; 8: 00595-2021 8 Darie AM et al.: Lancet Respir Med 2022; 10: 877-87 9 Lee SH et al.: J Microbiol Immunol Infect 2019; 52: 920-8 10 Poole S et al.: J Infect 2022; 85: 625-33 11 Martin-Loeches I et al.: Intensive Care Med 2023; 49: 615-32
Das könnte Sie auch interessieren:
Telemonitoring bei CPAP-Patienten:Begleitung von Anfang an
Inder Therapie schlafbezogener Atmungsstörungen bietet Telemonitoring (TM) die Möglichkeit, Probleme insbesondere in der Gewöhnungsphase, aber auch später auftretende Therapieprobleme ...
Pathobiologie und Genetik der pulmonalen Hypertonie
Für die 7. Weltkonferenz für pulmonale Hypertonie (World Symposium on Pulmonary Hypertension; WSPH) 2024 beschäftigten sich zwei Task-Forces aus 17 internationalen Experten allein mit ...