Prostatakarzinom: Screening, Diagnostik, Bildgebung, Biopsie und Optionen im lokalisierten und metastasierten Setting
Autor:innen:
Dr. Heidemarie Ofner
Univ.-Prof. Dr. Gero Kramer
Universitätsklinik für Urologie
Comprehensive Cancer Center (CCC)Medizinische Universität Wien
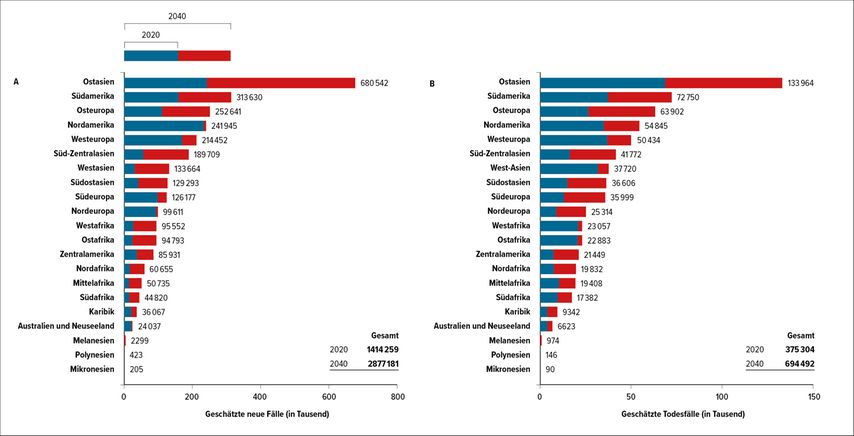
Im April 2024 wurde ein Bericht der Lancet Commission on prostate cancer veröffentlicht, in welchem ein Anstieg der Prostatakarzinominzidenz von 1,4 Millionen 2020 auf 2,9 Millionen im Jahr 2040 prognostiziert wird (Abb. 1).1 Die Zahlen betonen die Relevanz von nötigen Maßnahmen und Innovationen. Fortschritte wurden im Rahmen des EAU-Kongresses 2024 präsentiert.
Keypoints
-
Es ist ein deutlicher Anstieg der Prostatakarzinomfälle weltweit zu erwarten, dies unterstreicht die Bedeutung effektiver Screeningprogramme und optimierter Therapien.
-
Studien wie das schwedische Früherkennungsprogramm und die Göteborg-Trials zeigen Fortschritte bei der Reduktion von Überdiagnostik und Übertherapie klinisch nicht signifikanter Karzinome.
-
Neue Bildgebungs- und Biopsiemethoden tragen zur verbesserten und klinisch intelligenteren Diagnostik bei.
-
Neue systemische Therapieansätze bietenpotenziell verbesserte Überlebenschancen.
-
Kontinuierliche klinische Forschung und Adaption sind nötig, um den steigenden Inzidenzraten effektiv zu begegnen.
Abb. 1: Geschätzte Anzahl von neu diagnostizierten Prostatakarzinomfällen (A) und Todesfällen aufgrund eines Prostatakarzinoms (B) bei Männern zwischen 0 und 85 Jahren in 2020 (blau) und 2040 (blau + rot); (modifiziert nach „The Lancet Commission on prostate cancer“ 2024)1
Als Hauptursache für diesen Anstieg wird die immer älter werdende Bevölkerung angenommen und ein Verhindern dieses Anstieges durch Lebensstiländerungen oder Interventionen der öffentlichen Gesundheitssysteme wird als unwahrscheinlich eingeschätzt. Diese Zahlen betonen die Relevanz von einerseits adäquaten und klinisch intelligenten Screeningprogrammen, andererseits auch der weiteren Optimierung der Aufklärung der Bevölkerung, der Versorgung ab dem Auftreten der Erkrankung im lokalen Stadium sowie der Therapie der Erkrankung im fortgeschrittenen Stadium und der Weiterentwicklung von personalisierten Therapiemöglichkeiten.1
In diesem Sinne galt ein Großteil der Präsentationen am EAU 2024 dem Prostatakarzinom: Die Schwerpunkte lagen auf neuen Erkenntnissen im Bereich des Screenings, der Diagnostik und Bildgebung sowie der Biopsiemethoden, jedoch auch der Therapieoptionen im lokalisierten und metastasierten Setting.
Screening, Diagnostik, Active Surveillance
Obwohl das Prostatakarzinom nach wie vor zu den häufigsten Krebstodesursachen in Europa zählt, gibt es in den meisten Ländern weiterhin keine einheitliche Screeningstrategie und es kommt in vielen Fällen zur Problematik der Überdiagnostik und Übertherapie.
Screening und Active Surveillance
2020 wurde in Schweden ein national organisiertes Programm eingeführt, bei welchem Männer ab 50 Jahren zur PSA-Testung eingeladen wurden und ihnen bei einem PSA von über 3ng/mL ein biparametrisches MRT der Prostata empfohlen wurde. Je nach PI-RADS-Klassifikation der Läsion im MRT und PSA-Dichte wurde eine Indikation zur Biopsie gestellt. Die Ergebnisse des Programms wurden rezent publiziert: 35% der eingeladenen Männer nahmen an der Studie teil; bei weniger als der Hälfte (44%) der Teilnehmenden mit erhöhtem PSA zeigte sich tatsächlich eine Indikation zur Biopsie. 28% der biopsierten Männer wurden in ein Programm zur aktiven Überwachung (Active Surveillance) eingeschlossen. Zusammengefasst zeigte sich eine hohe Compliance der Behandler:innen mit den Leitlinienempfehlungen in Rahmen der Studie und bei mehr als 50% der Patienten mit PSA-Erhöhung konnte eine Biopsie vermieden werden – die Zahl der Fälle von Überdiagnostik und folgender Übertherapie könnte mit diesem Ansatz somit verringert werden.2
Des Weiteren wurden beim EAU 2024 Langzeitdaten der Göteborg-1-Studie vorgestellt: In der untersuchten Kohorte betrug das Prostata-spezifische Überleben nach 15 Jahren 98% und die Daten zeigten, dass die Todesursache in den seltensten Fällen das Prostatakarzinom war, auch bei Männern unter initialer Active Surveillance. Die Studie begann 1995 mit der Rekrutierung und insgesamt wurden 488 Patienten in ein Active-Surveillance-Programm im Rahmen der Studie eingeschlossen, 78% der Patienten hatten ein Low-Risk-Prostatakarzinom nach EAU-Definition, 22% ein Intermediate-Risk-Prostatakarzinom. Nach 15 Jahren zeigte sich ein Gesamtüberleben der Patienten von 63%. Innerhalb des medianen Beobachtungszeitraums von 15,1 Jahren erhielten 47% eine aktive Therapie nach Beendigung der Active Surveillance. Somit lässt sich rückschließen, dass Männer mit einer hohen Lebenserwartung über die Wahrscheinlichkeit des Umstieges von der Active Surveillance auf eine aktive Therapie aufgeklärt werden sollten. Dennoch kam es im Göteborg-1-Trial zu einer niedrigen Anzahl an Todesfällen aufgrund des Prostatakarzinoms in einem langen Beobachtungszeitraum von 25 Jahren.3
Bildgebung
Ein weiterer inhaltlicher Fokus im Bereich des Prostatakarzinom-Screenings wurde beim EAU 2024 auf neue Erkenntnisse im Bereich der Bildgebung gelegt. Die prospektiv durchgeführte PRIME-Studie vergleicht das biparametrische Prostata-MRT mit dem multiparametrischen – prinzipiell spricht die raschere, kostengünstigere und somit breitere Durchführbarkeit für das biparametrische Prostata-MRT ohne Kontrastmittel. Die vorläufigen Daten der ersten Analyse zeigen, dass sich das biparametrische Prostata-MRT nicht als untergeordnet in der Identifizierung von klinisch signifikanten Karzinomen erweisen könnte und es in der untersuchten Kohorte nicht zu einem Anstieg von Prostatabiopsien gekommen ist.4
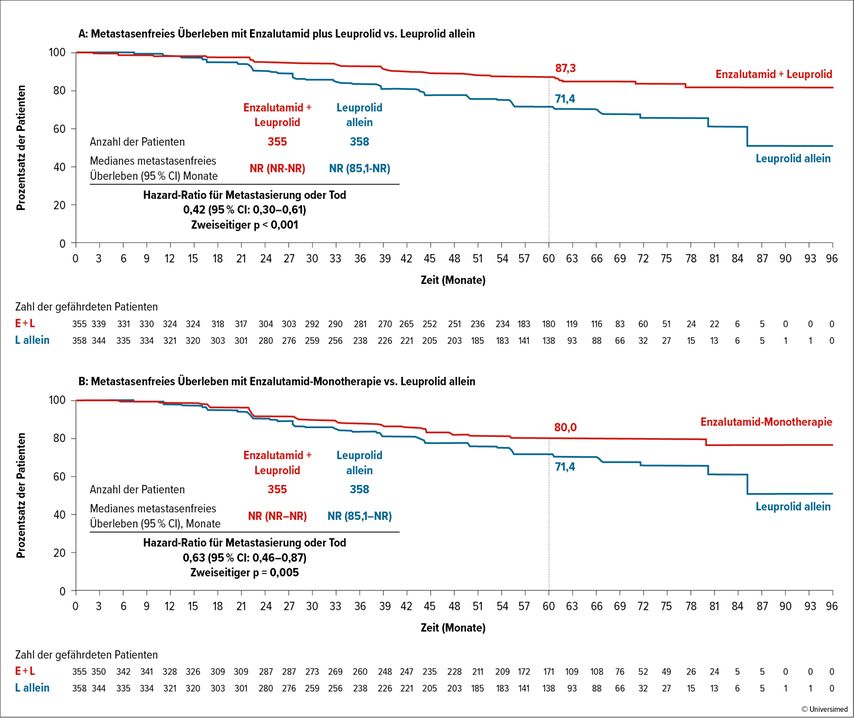
Abb. 2: Metastasenfreies Überleben der Patienten mit biochemischem Hochrisikorezidiv nach initial lokaler Therapie im EMBARK Trial: (A) Enzalutamid + ADT versus ADT-Monotherapie, (B) Enzalutamid-Monotherapie versus ADT-Monotherapie (modifiziert nach Freedland SJ et al., N Engl J Med 2023)7
Durchführung der Prostatabiopsie
Im Rahmen des Screenings und der Diagnostik des Prostatakarzinoms ist die Art der Durchführung der Prostatabiopsie weiterhin ein stark diskutiertes Thema. Nun wurden jedoch die lang erhofften Daten einer prospektiven, randomisierten Studie bezüglich transperinealer versus transrektale Biopspie veröffentlicht: der ProBE-PC-Trial. Insgesamt wurden 763 Patienten randomisiert, die Kohorte mit transrektaler Biopsie erhielt eine Standard-Antibiotikaprophylaxe (ohne rektalen mikrobiologischen Abstrich zuvor), die transperineale Biopsie wurde ohne Antibiotikaprophylaxe durchgeführt. Die Daten zeigten keinen signifikanten Unterschied in der Komplikationsrate zwischen den beiden Biopsiemodalitäten – und dies sowohl infektiologisch als auch nichtinfektiologisch.5 In dem ebenfalls rezent publizierten PREVENT-Trial wurde gleichfalls die transperineale mit der transrektalen Biopsie verglichen, in diesem Studiendesign wurde jedoch eine an die zuvor mittels rektalen Abstrichs abgenommene Kultur angepasste antibiotische Prophylaxe vor transrektaler Biopsie verabreicht. Die Ergebnisse zeigten ähnliche Komplikationen nach der Biopsie, mit einem höheren Vorkommen an Infektionen nach der transrektalen Biopsie. Onkologisch zeigte sich kein signifikanter Unterschied die Detektionsrate von Karzinomen betreffend.6 Zusammenfassend ist festzustellen, dass weiterhin unklar ist, ob es in naher Zukunft eine klare „One fits all“-Leitlinie bezüglich der Prostatabiopsiemodalität geben wird – wenn auch in Anbetracht der zunehmenden Raten an Resistenzen zumindest ein Vorgehen nach „Antibiotic Stewardship“ mit an Kulturergebnisse angepasster Antibiose naheliegend erscheint.
Systemische Therapie
Wenn auch ein großer Fokus beim diesjährigen EAU-Kongress auf Screening und Diagnostik des Prostatakarzinoms lag, gab es auch im Bereich der systemischen Therapie neue Updates. Im April 2024 wurde Enzalutamid für die Therapie des High-Risk-Prostatakarzinoms mit biochemischem Rezidiv nach initial lokaler Therapie in der EU zugelassen. Anlass für diese Zulassung sind die Daten der EMBARK-Studie. Hierbei wurden Patienten mit PSA-Anstieg nach lokaler, kurativ gerichteter Therapie eingeschlossen und mit Enzalutamid-Monotherapie, Enzalutamid in der Kombination mit Androgendeprivationstherapie (ADT) oder Placebo mit ADT therapiert. Nach 36 Wochen wurde ein Cut-off gesetzt und bei Patienten mit einem PSA unter 0,2ng/ml wurde die Therapie pausiert oder abgesetzt. Speziell an dem Studiendesign ist jedoch, dass bei einem erneuten Anstieg des PSA-Wertes nach Pausierung ein Wiederbeginn der Studienmedikation ermöglicht wurde. Als primärer Endpunkt wurde das metastasenfreie Überleben gewählt. Die Ergebnisse zeigten einen onkologischen Vorteil der Therapie von Enzalutamid mit ADT und Enzalutamid-Monotherapie im Vergleich zur ADT-Monotherapie. In Bezug auf das Nebenwirkungsprofil zeigte sich die Monotherapie mit Enzalutamid zwar als sicher und die Auswirkungen auf die sexuelle Funktion sowie Hitzewallungen waren geringer, andererseits traten bestimmte Nebenwirkungen, wie zum Beispiel Gynäkomastie, häufiger in der Enzalutamid-Monotherapie-Kohorte auf als in der Kohorte mit der Kombination aus Enzalutamid und ADT.7
Aufgrund der Daten des EMBARK-Trials fand nicht nur eine EMA-Zulassung statt, sondern auch ein Update der EAU 2024 Guidelines, in welchen die systemische Therapie von Enzalutamid mit oder ohne ADT bei High-Risk-M0-Patienten mit biochemischem Rezidiv (PSA-Verdopplungszeit ≤9 Monaten oder ≥2ng/ml über dem Nadir nach Radiatio oder ≥1ng/ml nach radikaler Prostatektomie mit oder ohne postoperative Strahlentherapie) empfohlen wurde.8
Literatur:
1 The Lancet Commission on prostate cancer: planning for the surge in cases - The Lancet. Accessed May 21, 2024. https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(24)00651-2/fulltext 2 Bratt O et al.: Population-based organised prostate cancer testing: results from the first invitation of 50-year-old men. Eur Urol 2024; 85(3): 207-14 3 UROsource. Accessed May 21, 2024. https://urosource.uroweb.org 4 Asif A et al.: Comparing biparametric to multiparametric MRI in the diagnosis of clinically significant prostate cancer in biopsy-naive men (PRIME): a prospective, international, multicentre, non-inferiority within-patient, diagnostic yield trial protocol. BMJ Open 2023; 13(4): e070280 5 Complications following transrectal and transperineal prostate biopsy: results of the ProBE-PC randomized clinical trial. J Urol. Accessed May 21, 2024. https://www.auajournals.org/doi/10.1097/JU.0000000000003788 6 Hu JC et al.: Transperineal versus transrectal magnetic resonance imaging–targeted and systematic prostate biopsy to prevent infectious complications: the PREVENT randomized trial. Eur Urol 2024; S0302-2838(23)03342-0 7 Freedland Stephen J et al.: Improved outcomes with enzalutamide in biochemically recurrent prostate cancer. N Engl J Med 2023; 389(16): 1453-65 8 EAU Annual Congress Milan 2024. Prostate Cancer Guidelines, https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-EANM-ESTRO-ESUR-ISUP-SIOG-Guidelines-on-Prostate-Cancer-2024_2024-04-09-132035_ypmy_2024-04-16-122605_lqpk.pdf
Das könnte Sie auch interessieren:
Kinderurologie Linz: Bekanntes Gesicht übernimmt Primariat
Seit 1. Juli hat die Kinderurologie des Ordensklinikums Linz Barmherzige Schwestern mit Prim. Priv.-Doz. Dr. Dr. Bernhard Haid, FEAPU, FEBU, einen neuen Abteilungsleiter.
Einblicke in die Rolle von „large language models“ in der urologischen Bildung
Die rasante Entwicklung der künstlichen Intelligenz (KI) hat auch das Feld der Medizin erfasst. In einer vergleichenden Analyse wurden große Sprachmodelle wie ChatGPT und BingAI anhand ...
Rolle der KI bei Steinleiden: Ist dies die Zukunft?
Künstliche Intelligenz hat mittlerweile Einzug in die moderne Medizin gehalten. Von computergestützter Patientenselektion und -aufklärung, über die Diagnostik bis zu Therapiealgorithmen ...