Neues Verständnis von PMR und LVV
Bericht: Mag.pharm. Irene Senn, PhD
Geprüft durch
Dr. Eva Manger
Universitätsklinik für Innere Medizin 2, Innsbruck
Dr. Philipp Bosch, MSc
Klinische Abteilung für Rheumatologie und Immunologie, Graz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Im Jahr 2024 wurden die Polymyalgia rheumatica (PMR) und die Großgefäßvaskulitis (LVV) erstmals in einer Leitlinie als Spektrumserkrankungen beschrieben. Diese Klassifikation eröffnet neue Perspektiven für Diagnose und Therapie.
PMR und LVV sind häufige chronisch-entzündliche rheumatische Erkrankungen des höheren Lebensalters und werden zunehmend als verschiedene Manifestationen derselben Erkrankung betrachtet. Die aktuellen Treat-to-target-Empfehlungen bestätigen diese Sichtweise: Sie definieren die kraniale Riesenzellarteriitis (cGCA), die Großgefäßvaskulitis (LV-GCA) und die PMR erstmals als Spektrum einer zusammenhängenden Erkrankung.1
Neue Erkenntnisse zur Ätiologie und Pathophysiologie
Genetik und Umweltfaktoren rücken als Auslöser einer PMR bzw. LVV zunehmend in den Fokus, während es weiterhin keine Evidenz für saisonales Clustering oder virale Ursachen gibt. Unter den Umweltfaktoren wurde kürzlich Luftverschmutzung als potenzieller Risikofaktor für eine GCA identifiziert.2 Auch die klonale Hämatopoese rückt als wichtiger Mechanismus zunehmend in den Fokus.
Klonale Hämatopoese als Risikofaktor
Klonale Hämatopoese (CH) entsteht durch somatische Mutationen in hämatopoetischen Stammzellen, insbesondere in Genen wie TET2 und JAK2.3,4 Die dadurch geförderte verstärkte Myelopoese und die erhöhte Ausschüttung proinflammatorischer Zytokine wie IL-1β und IL-6 spielen eine zentrale Rolle in der Pathogenese der GCA.3,4 Studien zeigen, dass bei 61% der GCA-Patienten eine CH nachgewiesen werden kann, im Vergleich zu nur 18% in altersangepassten Kontrollgruppen.5 Diese Erkenntnisse eröffnen spannende Perspektiven für die Rheumatologie. Neben der bewährten Zytokinblockade könnten zukünftige Therapieansätze direkt auf die klonalen Zellen oder das Inflammasom abzielen.
Die unterschätzte Rolle der Immunofibroblasten
Ein weiteres wichtiges Forschungsfeld sind die Immunofibroblasten. Lange Zeit galten sie ausschließlich als Produzenten von extrazellulärer Matrix und Vorläufer von Myofibroblasten. Neuere Studien belegen jedoch ihre aktive Beteiligung an der Pathogenese der GCA. Sie interagieren direkt mit T- und B-Zellen und sind maßgeblich an der Bildung tertiärer lymphoider Strukturen beteiligt, die die Entzündung fördern. Zudem rekrutieren sie Makrophagen und tragen so zur Persistenz der Entzündungsreaktion bei.6 „Die Fibroblasten spielen in der Pathogenese der GCA eine zentrale Rolle, werden jedoch mit den derzeitigen Therapien überhaupt nicht adressiert“, verdeutlichte Dr. Eva Manger von der Universitätsklinik für Innere Medizin2 in Innsbruck. Zukünftige Therapieoptionen könnten beispielsweise auf CAR-T-Zell-Therapien, spezifischen Vakzinen oder Antikörpern basieren. Diese innovativen Ansätze, kombiniert mit der bewährten Zytokinblockade, könnten die Therapie der GCA grundlegend verändern.
Diagnostik der PMR
Die Diagnostik der PMR basiert auf einem klinischen Algorithmus, der durch bildgebende Verfahren ergänzt werden kann. Bei diagnostischen Unsicherheiten empfiehlt sich eine Sonografie der Schultern und Hüften, um typische Befunde wie Bursitiden, Tenosynovitiden oder Synovitiden sichtbar zu machen.7
Zudem kann bei Patienten mit Schulterschmerzen auch die Magnetresonanztomografie (MRT) hilfreich sein, insbesondere zur Differenzierung zwischen entzündlichen und degenerativen Ursachen. Eine aktuelle Studie unterstrich die Bedeutung nichtsynovialer Strukturen bei der PMR-Diagnostik. Sie identifizierte Entzündungen an 6 spezifischen Stellen, die für PMR charakteristisch sind und eine präzisere Unterscheidung von degenerativen Differenzialdiagnosen ermöglichen (Abb. 1).8 Ergänzend dazu kann das FDG-PET/CT bei unklaren Befunden wertvolle Hinweise liefern, insbesondere zur Detektion subklinischer Gefäßentzündungen oder zum Ausschluss von Differenzialdiagnosen wie Malignitäten.9
Diagnostik der LVV
EULAR 2023: Sonografie der Axillararterien
In der Diagnostik der LVV gab es zuletzt wesentliche Fortschritte. Die EULAR-Empfehlungen 2023 rücken die Sonografie als diagnostisches Mittel der ersten Wahl in den Vordergrund.10,11 Eine wichtige Neuerung ist hierbei die Empfehlung, dass bei allen Patienten Ultraschalluntersuchungen nicht nur der Temporal-, sondern auch der Axillararterien durchgeführt werden sollten, um eine umfassendere Einschätzung der Gefäßbeteiligung zu ermöglichen. Auch das PET-CT gilt als valide Bildgebung, sofern hochauflösende Geräte verwendet werden. Der Zeitpunkt der Untersuchung ist hier entscheidend: Ein PET-CT sollte idealerweise innerhalb von 3 Tagen nach Beginn einer Glukokortikoidtherapie erfolgen, da die Sensitivität danach rasch abnimmt und nach 10 Tagen bereits unter 50% liegt.
Ultraschall-Score OGUS für Monitoring
Eine spannende Entwicklung in der Sonografie ist der OGU-Score (OGUS), der auf Intima-Media-Dicke(IMT)-Messungen der Temporal- und Axillararterien beruht. Der Score wurde von der OMERACT-Arbeitsgruppe entwickelt und kürzlich in einer Reliabilitätsstudie in Innsbruck evaluiert, die seine praktische Anwendbarkeit untermauerte.12 Dabei zeigte sich eine hohe Interrater-Reliabilität (ICC 0,72–0,84) sowie eine exzellente Intrarater-Reliabilität (ICC 0,91). Eine prospektive Kohorte bestätigte seine hohe Sensitivität zur Erfassung von Veränderungen über 24 Wochen. „Die Idee ist, diesen Score in Zukunft als Monitoring-Tool zu verwenden“, erklärte Manger. Der OGUS bietet vor allem für das Monitoring von Patienten unter IL-6-Blockade-Therapie vielversprechende Perspektiven, da herkömmliche Entzündungsmarker wie CRP und Blutsenkungsgeschwindigkeit in diesem Setting oft nicht zuverlässig sind.
Erste Studienergebnisse zum PET/MRT
Das 18-F-FDG-PET/MRT wurde im vergangenen Jahr erstmals in einer Studie zur Überwachung der Krankheitsaktivität bei LVV untersucht.13 Der neu entwickelte VAMP-Score kombiniert PET- und MRT-Metriken und zeigte im Vergleich zum etablierten PETVAS-Score eine höhere Sensitivität und Spezifität bei der Differenzierung zwischen aktiver und inaktiver Erkrankung. Zudem erfasst er Veränderungen der Krankheitsaktivität im Zeitverlauf. Trotz dieser vielversprechenden Ergebnisse bleibt der Einsatz des PET/MRT derzeit primär auf Studien beschränkt, da die Untersuchungen in der klinischen Praxis häufig nicht gut verfügbar sind.
Hürden bei der Temporalarterienbiopsie
Die Temporalarterienbiopsie (TAB) wird zwar weiterhin als diagnostischer Standard für die GCA angesehen, weist jedoch einige Einschränkungen auf, darunter Artefakte durch mechanischen Druck und eine geringere Sensitivität im Vergleich zur Sonografie. Biopsien unter 1cm sind zudem häufig nicht aussagekräftig, da sie den segmentalen Befall der GCA unzureichend erfassen. Altersbedingte Veränderungen wie Intima-Media-Verdickung oder lymphozytäre Infiltrate erschweren die Beurteilung zusätzlich.
Therapie
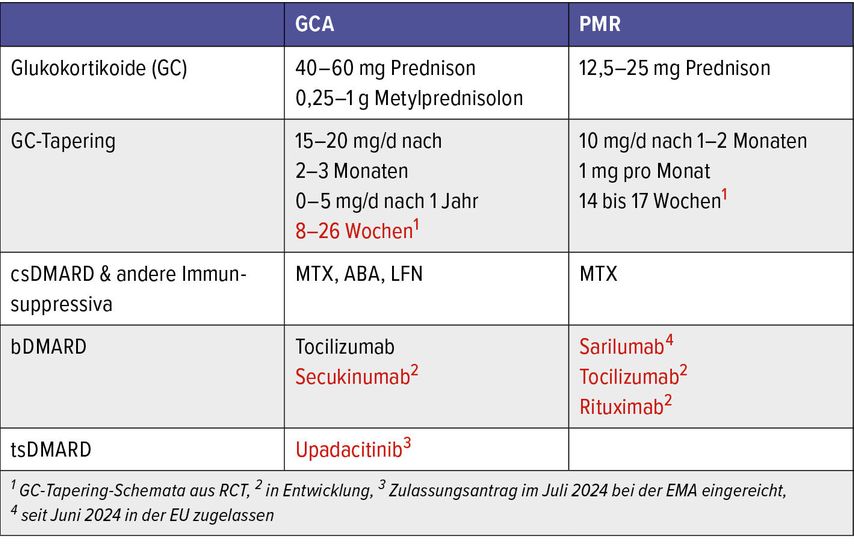
Die aktuellen ACR- und EULAR-Empfehlungen betonen nach wie vor die zentrale Rolle von Glukokortikoiden (GC) in der Behandlung von PMR und LVV.14–16 Neue Ansätze wie verkürzte GC-Ausschleichschemata, die Kombination mit Tocilizumab (TCZ) und innovative Wirkstoffklassen werfen jedoch die Frage auf, ob der derzeitige Standard of Care noch zeitgemäß ist (Tab. 1). Dieser Fragestellung widmete sich Dr. Philipp Bosch von der Klinischen Abteilung für Rheumatologie und Immunologie in Graz.
Tab. 1: Aktueller Standard of Care in der Behandlung von Riesenzellarteriitis (GCA) und Polymyalgia rheumatica PMR (schwarz) plus potenzielle zukünftige Änderungen (rot)
Verkürztes GC-Tapering und TCZ-Absetzstrategien
In den letzten Jahren rückten Strategien in den Fokus, die die Dosis und Therapiedauer von GC reduzieren (etwa durch kürzere Ausschleichschemata), um deren Nebenwirkungen zu minimieren. Gleichzeitig gewinnen Ansätze an Bedeutung, die das gezielte Absetzen von TCZ nach Erreichen einer stabilen Remission untersuchen. Mehrere Studien liefern hierzu vielversprechende Daten, werfen jedoch auch neue Fragen zur langfristigen Kontrolle und Rückfallprävention auf.
Proof-of-Concept-Studie
Eine kürzlich vorgestellte Proof-of-Concept-Studie untersuchte die Wirksamkeit von TCZ in Kombination mit einer auf 8 Wochen verkürzten Prednison-Therapie bei GCA-Patienten.17 Alle 30 Studienteilnehmer erreichten innerhalb von 4 Wochen eine Remission, nach 52 Wochen befanden sich 77% weiterhin in anhaltender, GC-freier Remission. Die Ergebnisse deuten darauf hin, dass TCZ in Kombination mit einer stark verkürzten GC-Therapie eine effektive Strategie zur Reduktion von GC-Nebenwirkungen sein könnte.
Absetzen von TCZ bei GCA
Die GUSTO-Studie untersuchte ein noch radikaleres Konzept mit einer nur dreitägigen intravenösen Methylprednisolon-Pulstherapie (500 mg/Tag), gefolgt von einer 52-wöchigen TCZ-Monotherapie bei neu diagnostizierter GCA.18,19 Von den 18 Studienteilnehmern erreichten 14 innerhalb von 24 Wochen eine Remission, nach 52 Wochen blieben 13 Patienten weiterhin in Remission. Zwei dieser Patienten erlitten leichte Rückfälle, die jedoch erfolgreich auf eine erneute TCZ-Therapie ansprachen. Die Langzeitbeobachtung zeigte, dass 11 der 13 Patienten auch nach dem Absetzen von TCZ über einen Zeitraum von bis zu 208 Wochen in Remission blieben. Eine Patientin entwickelte jedoch eine anteriore ischämische Optikusneuropathie, die zur Erblindung auf einem Auge führte.
Ein nahezu identisches Studiendesign wurde in der TOPAZIO-Studie untersucht.20,21 Nach 52 Wochen waren hier ebenfalls 13 von 18 Patienten in klinischer Remission, zudem wurde unter TCZ-Monotherapie eine signifikante Reduktion des PETVAS-Score erreicht. In der Verlängerungsstudie nach Absetzen von TCZ blieben zwar nach 24 Wochen weiterhin 11 von 13 Patienten in klinischer Remission, allerdings wurden 36 % der PET/CT-Bilder als aktiv interpretiert. Die Zugabe von Biologika könnte somit künftig eine verkürzte Therapiedauer mit GC ermöglichen. Welche Patientengruppe hierfür besonders geeignet ist, bleibt noch zu untersuchen, resümierte Bosch.
Absetzen von TCZ bei PMR
Die SEMAPHORE-Studie untersuchte die Wirksamkeit von TCZ bei Patienten mit aktiver, GC-abhängiger PMR. In der randomisierten, doppelblinden, placebokontrollierten Studie erhielten 101 Teilnehmer entweder TCZ (8mg/kg i.v. alle 4 Wochen) oder Placebo über 24 Wochen, kombiniert mit einer standardisierten Prednison-Reduktion.22,23
Der primäre Endpunkt (CRP PMR-AS <10 und Prednison ≤5mg/Tag oder Reduktion um ≥10mg) wurde in der TCZ-Gruppe von 67,3% und in der Placebo-Gruppe von 31,4% der Patienten erreicht. Jedoch zeigte sich nach Absetzen von TCZ eine hohe Rückfallrate: Innerhalb des 40-wöchigen Nachbeobachtungszeitraums erlitten 80,8% der Patienten einen Rückfall. Die mediane Zeit bis zum Rückfall betrug 15 Wochen. „Ob Tocilizumab abgesetzt werden kann und zu welchem Zeitpunkt, ist anhand der aktuell verfügbaren Daten schwer zu entscheiden“, kommentierte Bosch die Ergebnisse.
Wirkstoffe in der Pipeline für GCA und PMR
Verschiedene Immunmodulatoren, die bereits für andere Indikationen zugelassen sind, werden derzeit in Studien auf ihre Wirksamkeit bei GCA und PMR geprüft. Ziel ist es, GC weiter zu reduzieren, langfristige Remissionen zu erreichen und dabei das Nebenwirkungsprofil zu verbessern. Im Mittelpunkt aktueller Forschungen stehen IL-17A-Inhibitoren und JAK-Inhibitoren.
Secukinumab bei GCA
Die TitAIN-Studie, eine randomisierte, doppelblinde, placebokontrollierte Phase-II-Studie, untersuchte die Wirksamkeit und Sicherheit des IL-17A-Inhibitors Secukinumab bei Patienten mit GCA.24 52 Patienten erhielten entweder 300mg Secukinumab oder Placebo, jeweils kombiniert mit einem GC-Ausschleichschema über 26 Wochen. Die Ergebnisse waren vielversprechend: 70% der Patienten in der Secukinumab-Gruppe erreichten bis Woche 28 eine anhaltende Remission, verglichen mit nur 20% in der Placebo-Gruppe.
Upadacitinib bei GCA
Die SELECT-GCA-Studie, eine doppelblinde, randomisierte Phase-III-Studie, untersuchte den JAK-Inhibitor Upadacitinib in Kombination mit einem GC-Ausschleichschema bei Patienten mit GCA.25 Insgesamt wurden 428 Patienten eingeschlossen, die in drei Gruppen randomisiert wurden: Upadacitinib 15 mg, Upadacitinib 7,5 mg und Placebo.
Die Studie zeigte, dass 46 % der Patienten unter Upadacitinib 15 mg (+ GC-Tapering über 26 Wochen) eine anhaltende Remission erreichten, verglichen mit 29 % in der Placebo-Gruppe (+ GC-Tapering über 52 Wochen). Das Sicherheitsprofil war insgesamt vergleichbar mit Placebo, jedoch traten unter Upadacitinib häufiger Herpes zoster, Lymphopenie, Anämie und nichtmelanozytärer Hautkrebs auf
Sarilumab bei PMR
Die SAPHYR-Studie untersuchte den IL-6-Inhibitor Sarilumab bei Patienten mit PMR.26 In der Phase-III-Studie wurden 118 Patienten in zwei Gruppen randomisiert: Die eine Gruppe erhielt Sarilumab 200mg alle zwei Wochen in Kombination mit einem 14-wöchigen GC-Ausschleichschema, während die Kontrollgruppe Placebo und ein 52-wöchiges GC-Ausschleichschema erhielt.
Signifikant mehr Patienten in der Sarilumab-Gruppe (28,3%) erreichten eine anhaltende Remission im Vergleich zur Placebo-Gruppe (10,3%). Zudem wurden ein um 44% geringeres Risiko für Rezidive sowie eine deutlich geringere kumulative GC-Exposition (median 777mg vs. 2044mg) unter Sarilumab beobachtet. Zu den häufigsten Nebenwirkungen zählten Neutropenie, Arthralgie und Diarrhö.
Rituximab bei PMR
Die BRIDGE-PMR-Studie, eine randomisierte, kontrollierte Proof-of-Concept-Studie aus den Niederlanden, untersuchte die Wirksamkeit von Rituximab bei Patienten mit PMR.27 Die Patienten wurden in zwei Gruppen randomisiert, um entweder eine Einzeldosis Rituximab (1000mg i.v.) oder Placebo zu erhalten. Beide Gruppen erhielten ein beschleunigtes GC-Ausschleichschema über 17 Wochen.
Nach 52 Wochen erreichten 52% der Patienten in der Rituximab-Gruppe eine GC-freie Remission, definiert als PMR-AS <10, verglichen mit 21% in der Placebo-Gruppe. Diese Ergebnisse zeigen, dass eine Einzeldosis Rituximab eine stabile GC-freie Remission über ein Jahr ermöglichen und die GC-Exposition deutlich reduzieren kann.
Ausblick
Die vorgestellten Studien zeigen vielversprechende Ansätze, die GC-Belastung bei GCA und PMR zu reduzieren und gleichzeitig eine langfristige Remission zu ermöglichen. Sarilumab ist bereits seit Juni 2024 in der EU für PMR zugelassen, der Zulassungsantrag für Upadacitinib bei GCA wurde bereits bei der EMA eingereicht. Diese Entwicklungen könnten den Standard of Care für PMR und GCA grundlegend verändern, hin zu individuelleren und zielgerichteten Therapien mit deutlich reduziertem Glukokortikoid-Einsatz (Tab. 1).
Quelle:
Jahrestagung der Österreichischen Gesellschaft für Rheumatologie & Rehabilitation (ÖGR), 28.–30. November 2024, Wien
Literatur:
1 Dejaco C et al.: Ann Rheum Dis 2024; 83(1): 48-57 2 Bond M et al.: Arthritis Care Res (Hoboken) 2024; doi: 10.1002/acr.25404. Online ahead of print 3 Robinette ML et al.: Arthritis Rheumatol 2024; 76(3): 438-43 4 Oren O et al.: J Clin Invest 2024; 134(19): e180066 5 Gutierrez-Rodrigues F et al.: Ann Rheum Dis 2024; 83(4): 508-17 6 Xu S et al.: Autoimmun Rev 2024; 23(6): 103574 7 Camellino D et al.: Rheumatology (Oxford) 2021; 60(3): 1016-33 8 Fruth M et al.: RMD Open 2024; 10(2): e004169 9 Henckaerts L et al.: Rheumatology (Oxford) 2018; 57(11): 1908-16 10 Dejaco C et al.: Ann Rheum Dis 2024; 83(6): 741-51 11 Bosch P et al.: RMD Open 2023; 9(3): e003379 12 Dejaco C et al.: Ann Rheum Dis 2023; 82(4): 556-64 13 Pugh D et al.: Nat Commun 2024; 15(1): 7314 14 Maz M et al.: Arthritis Rheumatol 2021; 73(8): 1349-65 15 Hellmich B et al.: Ann Rheum Dis 2020; 79(1): 19-30 16 Dejaco C et al.: Ann Rheum Dis 2015; 74(10): 1799-807 17 Unizony S et al.: Lancet Rheumatol 2023; 5(12): e736-e42 18 Christ L et al.: Lancet Rheumatol 2021; 3(9): e619-26 19 Christ L et al.: Ann Rheum Dis 2024; 83(Suppl 1): 60 20 Muratore F et al.: Rheumatology (Oxford) 2024; 63(1): 64-71 21 Marvisi C et al.: Ann Rheum Dis 2024; 83(Suppl 1): 59 22 Devauchelle-Pensec V et al.: JAMA 2022; 328(11): 1053-62 23 Chevet B et al.: Ann Rheum Dis 2024; 83(Suppl 1): 58-9 24 Venhoff N et al.: Lancet Rheumatol 2023; 5(6): e341-50 25 Blockmans D et al.: Ann Rheum Dis 2024; 83(Suppl 1): 232 26 Spiera RF et al.: N Engl J Med 2023; 389(14): 1263-72 27 Bolhuis TE et al.: Lancet Rheumatol 2023; 5(4): e208-e14
Das könnte Sie auch interessieren:
Ein Leitlinien-Update für die rheumatologische Praxis
Die aktualisierten Leitlinien spiegeln wichtige Neuerungen in der Diagnose und Therapie der Osteoporose wider. Die österreichische Leitlinie der ÖGKM bietet eine fundierte Grundlage mit ...
Psoriasis-Arthritis: Es kann noch mehr erreicht werden
Erlauben es die aktuell verfügbaren Therapieoptionen, Psoriasis-Arthritis (PsA) so zu adressieren, dass sie für Patientinnen und Patienten keine Belastung mehr darstellt? „Treat to ...
CAR-T-Zell-Therapie beim systemischen Lupus – ein neuer Meilenstein?
Seit dem Jahr 2021 wird die CAR-T-Zell-Therapie auch in der Behandlung von Autoimmunerkrankungen eingesetzt – dies stellt ein relativ neues Anwendungsfeld dieser Methode außerhalb der ...