Therapieänderungen beim Urothelkarzinom
Autorin:
OÄ Dr. Dora Niedersüß-Beke, MBA
Zentrum für Onkologie, Hämatologie und Palliativmedizin
I. Medizinische Abteilung, Klinik Ottakring, Wien
Im Rahmen des EAU 2024 wurden interessante Studien zum Urothelkarzinom präsentiert und rege diskutiert. Eine immer größere Rolle spielt die Patientenselektion, um Patientengeeigntete Therapien anbieten zu können und unnötige Toxizitäten zu vermeiden.
Keypoints
-
Eine Interimsanalyse von CheckMate-247 mit Nivolumab zur adjuvanten Immuntherapie beim Hochrisiko-Urothelkarzinom ergab einen signifikanten Benefit im Gesamtüberleben, besonders in der Population mit PD-L1 ≥ 1.
-
Patienten in der ctDNA-negativen Patientengruppe von IMvigor 011 wiesen unabhängig vom Risikoprofil des Tumors ein ausgezeichnetes krankheitsfreies Überleben bzw. Gesamtüberleben auf.
-
Eine Subgruppenanalyse von EV-302 zeigt, dass Enfortumab Vedotin + Pembrolizumab unabhängig davon, ob der Tumor im oberen Harntrakt oder in der Blase lokalisiert ist, das progressionsfreie Überleben sowie das Gesamtüberleben signifikant verlängert.
-
Die Expression von Nectin-4 in Metastasen hat einen höheren prädiktiven Wert als die Expression am Primum.
Adjuvante Therapie
Interimsanalyse der CheckMate-247-Studie
Eine adjuvante Immuntherapie beim Hochrisiko-Urothelkarzinom nach einer neoadjuvanten Chemotherapie bei Cisplatin-unfitten oder nicht neoadjuvant vortherapierten Patienten hat sich, trotz ausständiger Gesamtüberlebensdaten, als Standard etabliert.
Beim diesjährigen EAU wurden erste positive Überlebensdaten zu dieser Thematik von Matt Galsky präsentiert. In der geplanten Interimsanalyse der CheckMate-247-Studie, adjuvante Therapie mit Nivolumab für ein Jahr vs. Placebo, wurde nach einem Follow-up von mindestens 36 Monaten ein signifikanter Benefit im Gesamtüberlebennachgewiesen, besonders in der Population mit PD-L1 ≥1 mit einer HR von 0,56. In den Subgruppenanalysen kristallisieren sich wiederum einige Gruppen wie z.B. jene mit N+ oder mit pT3-Tumoren heraus, die besonders profitiert hatten. Im Gegensatz dazu zeigt sich, wie auch in anderen adjuvanten Studien, dass die Lage des Primums – fehlender Benefit im Bereich des oberen Harntraktes – eine Rolle spielt. Das Toxizitätsprofil mit 18% Toxizität ≥Grad 3 und drei therapieassoziierten Todesfällen darf nicht unterschätzt werden und es bedarf daher einer sorgfältigen Patientenselektion.
Analyse der ctDNA-negativen Patientengruppe aus IMvigor 011
Passend zur Patientenselektion wurden auf dem EAU auch erste Ergebnisse zur „Zirkulierende Tumor-DNA“(„circulating tumor DNA“, ctDNA)-negativen Patientengruppe der IMvigor-011-Studie präsentiert. Diese noch laufende Studie selektiert Patienten anhand von positiver und negativer ctDNA post Zystektomie bei muskelinvasivemHochrisiko-Blasenkarzinom (MBIC). Patienten mit positiverctDNA erhalten 2:1 Atezolizumab bzw. Placebo adjuvant. Die ctDNA-negative Gruppe, die Gruppe, die beim EAU präsentiert wurde, erhielt serielle ctDNA-Bestimmungen ohne adjuvante Immuntherapie. In dieser Analyse hat sich gezeigt, dass Patienten unabhängig vom Risikoprofil des Tumors bei ctDNA-Negativität ein ausgezeichnetes krankheitsfreies Überleben bzw. Gesamtüberleben aufwiesen. Nach 18 Monaten gab es lediglich zwei Events im Gesamtüberleben bei insgesamt 171 untersuchten Patienten.
Diese und weitere Studien (TOMBOLA, MODERN) mit noch innovativerem Einsatz der ctDNA im adjuvanten Setting rekrutieren derzeit. Sollten auch diese Studien den prädiktiven Wert der ctDNA bestätigen, wird die Bestimmung als Marker für die Patientenselektion vor dem Einsatz einer adjuvanten Immuntherapie unerlässlich werden.
Therapie im la/metastasierten Setting
Seit der Präsentation der EV-302-Studie, die Enfortumab Vedotin (EV), ein gegen Nectin-4 gerichtetes „antibody-drugconjugate“ (ADC), in Kombination mit Pembrolizumab (P) untersuchte, wurde mit einem Schlag eine jahrzehntelange Platin-Ära beendet. In der Studie erhielten die Patienten EV(Tag 1,8)+P(Tag 1) alle 3 Wochen vs. Platin+Gemcitabin, gefolgt von einer Erhaltungstherapie mit Avelumab. Die dualen primären Endpunkte (PFS und OS) wurden statistisch hochsignifikant erreicht, das progressionsfreie Überleben wie auch das Gesamtüberleben wurden beinahe verdoppelt. In den vordefinierten Subgruppenanalysen überzeugt die Kombination unabhängig von einer Platintauglichkeit, demPD-L1-Status oder dem Metastasierungsmuster (viszerale Metastasen vs. Lymphknoten alleine). Die Gesamtansprechrate mit 67,7 vs. 44,4% und eine komplette Remissionsrate von 29,1% überzeugen ebenfalls.
Subgruppenanalyse der EV-302-Studie anhand der Lokalisation des Primums
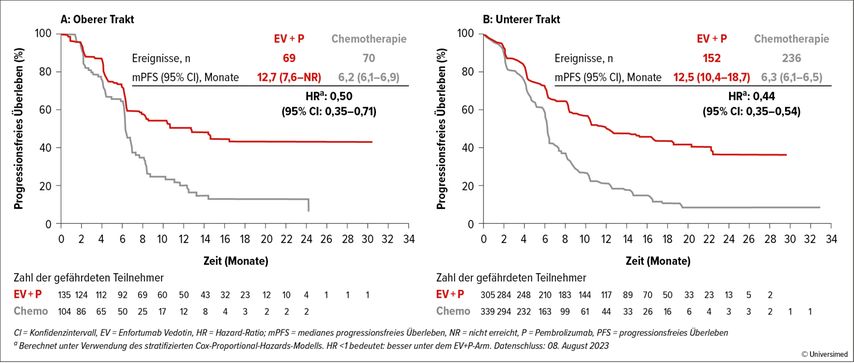
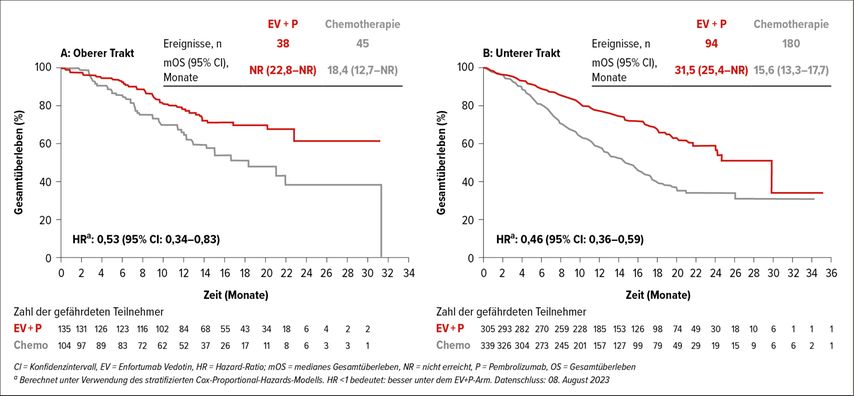
Beim EAU erfolgte die Präsentation der Endpunkte anhand der Lokalisation des Primums (oberer vs. unterer Harntrakt). Auch in dieser Subgruppenanalyse konnte der Benefit der Doublette, unabhängig davon, ob der Tumor im oberen Harntrakt – PFS 12,7 vs. 6,2 Monate (HR: 0,50) – oder in der Blase – PFS 12,6 vs.6,3 Monate (HR: 0,44) – lokalisiert ist, bestätigt werden (Abb. 1). Ähnlich beeindruckende Ergebnisse wurdenzum Gesamtüberleben präsentiert (Abb. 2).
Abb. 1: PFS-Subgruppenanalyse nach Lokalisation des Primums: Der Vorteil beim PFS war konsistent mit jenem der Gesamtpopulation, unabhängig von der Primärlokation der Erkrankung (modifiziert nach Bedke J et al., EAU 2024)
Abb. 2: OS-Subgruppenanalyse nach Lokalisation des Primums: Der Vorteil beim OS war konsistent mit jenem der Gesamtpopulation, unabhängig von der Primärlokation der Erkrankung (modifiziert nach Bedke J et al., EAU 2024)
Das Nebenwirkungsprofil, mit 55,9% Toxizität≥Grad 3, darf jedoch nicht unterschätzt werden. Besonders die Hauttoxizität sowie eine periphere Neuropathie im späteren Therapieverlauf können herausfordernd werden und müssen vom betreuenden Ärzteteam regelmäßig evaluiert werden. Diesbezüglich wäre eine Patientenselektion, im Sinne eines prädiktiven Biomarkers, besonders wünschenswert.
Eine deutsche Gruppe hat die Expression von Nectin-4 am Primum sowie an den Metastasen untersucht und konnte nachweisen, dass die Expression von Nectin-4 in Metastasen einen höheren prädiktiven Wert hat als die Expression am Primum. Weitere Untersuchungen zur Definierung von Biomarkern bei Enfortumab Vedotin laufen aktuell und werden hoffentlich zukünftig eine Selektion von Patienten ermöglichen.
Die Zulassung von EV+Pembrolizumab in Europa wird für Herbst 2024 erwartet.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Neue Daten zum Nierenzellkarzinom
Auf dem ASCO-Kongress 2024 wurden auf dem Gebiet des Nierenzellkarzinoms (RCC) zwar keine Daten präsentiert, die einen Paradigmenwechsel herbeiführen werden, es gab jedoch einige ...
Highlights zum Prostatakarzinom
Am diesjährigen Kongresses der American Society of Clinical Oncology (ASCO) standen bei der Behandlung des Prostatakarzinoms ein Update der EMBARK-sowie der NEPTUNES-Studie im Fokus.
Hodentumoren: Neues vom ASCO 2024
Obwohl dieses Jahr am ASCO wenige neue Daten und Erkenntnisse zum Thema Hodentumoren vorgestellt wurden, lässt sich ein Poster von Dr. Khalid Alkhatib hervorheben.