Den Griff der HCM lockern – gezielte Diagnostik und zielgerichtete Therapie
Bericht:
Dr. med. Sabina Ludin
Chefredaktorin
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die hypertrophe Kardiomyopathie (HCM) ist definiert durch eine linksventrikuläre Hypertrophie, die durch keine andere Pathologie verursacht wird.1 Sie ist häufiger als gemeinhin angenommen und betrifft etwa 1 von 500 Erwachsenen.2 Das frühzeitige Erkennen von Anzeichen für eine HCM und die Einleitung einer gezielten Abklärung sind zentral, da die HCM eine fortschreitende Erkrankung mit potenziell schweren Komplikationen ist. Für Patienten mit einer symptomatischen obstruktiven HCM steht mit dem spezifischen und reversiblen Myosin-Inhibitor Mavacamten seit Kurzem erstmals auch eine zielgerichtete medikamentöse Behandlung zur Verfügung, wie an einem Satellitensymposium im Rahmen der SGK-Jahrestagung zu erfahren war.
Die Diagnose einer HCM wird oft erst spät oder gar nicht gestellt, da die Symptome unspezifisch sind. Angina pectoris, Dyspnoe, Palpitationen, Synkope, Erschöpfung, körperliche Belastungsintoleranz, die in sehr unterschiedlicher Ausprägung auftreten können, sind Symptome, die an eine HCM denken lassen sollten.1 Auch die Familienanamnese, ein pathologisches EKG und ein Systolikum können Hinweise auf eine HCM sein. Das Erkennen dieser potenziellen HCM-Indikatoren ist ein erster und wichtiger Schritt in der Diagnose dieser progressiven Erkrankung, die zu einer fortschreitenden Herzinsuffizienz, Vorhofflimmern und Schlaganfall sowie plötzlichem Herztod führen kann.2
Effektive HCM-Diagnostik: Abklärung der Obstruktion mittels physiologischem Stress-Echo
Morphologisch äussert sich die HCM in einer asymmetrischen Hypertrophie des linken Ventrikels, die sich nicht allein durch die Belastung erklären lässt. Der Grenzwert für die Diagnose einer HCM liegt bei einer Wanddicke von ≥15mm (≥13mm bei positiver Familienanamnese) in mindestens einem Myokardsegment.1 Bei etwa 70% der HCM-Patienten führt die zunehmende Hypertrophie des Septums zu einer Obstruktion des linksventrikulären Ausflusstraktes (LVOTO).3 Da die obstruktive hypertrophe Kardiomyopathie (HOCM) mit einer schlechteren Prognose behaftet ist als die HCM ohne Obstruktion, ist es wichtig, in der Diagnostik aktiv nach einer Obstruktion zu suchen.4 «Die Obstruktion erzeugt ein meso- bis endsystolisches Herzgeräusch, das ein wenig an eine Aortenstenose erinnert und normalerweise am Erb’schen Punkt, seltener über der Aorta zu hören ist. Ein wichtiges Merkmal ist, dass das Systolikum bei HOCM dynamisch ist. Durch Provokation mittels Valsalva-Manöver oder Aufstehen aus der Hocke kann es verstärkt werden»,1 erklärte PD Dr. med. Pierre Monney vom CHUV in Lausanne. Das EKG zeigt bei der Mehrheit der HOCM-Patienten Auffälligkeiten wie Hypervoltage, abnorme ST- und T-Wellen sowie pathologische Q-Zacken (Pseudoinfarkt-Q-Zacke) in unterschiedlicher Kombination.1
Die Echokardiografie ist zentral für die Diagnose und die Verlaufskontrolle der HCM. Neben der Messung der Wanddicke muss nach Hinweisen auf eine LVOTO, wie eine systolische Vorwärtsbewegung («systolic anterior motion», SAM) der Mitralklappe, Anomalien der Papillarmuskeln und einen erhöhten LVOT-Gradienten (≥30mmHg), gesucht werden. «Es ist wichtig zu wissen, dass die LVOTO bei etwa der Hälfte der HOCM-Patienten in Ruhe nicht nachweisbar ist. Hier liegt eine latente Obstruktion vor, die durch ein Valsalva-Manöver oder körperliche Belastung provoziert werden muss»,3betonte PD Dr. Monney. «Die physiologische Stress-Echokardiografie mit Messung des LVOT-Gradienten unmittelbar nach einer Belastung auf dem Fahrradergometer oder dem Laufband ist die effektivste Methode, um eine latente LVOTO nachzuweisen.»1
Die kardiale Magnetresonanztomografie (CMR) dient der morphologischen Beurteilung bei Patienten mit unklarem Echobefund sowie zur Charakterisierung des Gewebes und zur Quantifizierung der Fibrose («late gadolinium enhancement»). Die CMR ist auch hilfreich, um wichtige Differenzialdiagnosen wie Morbus Fabry, Amyloidose oder andere Phänokopien auszuschliessen.5
Neue zielgerichtete Therapie der HCM
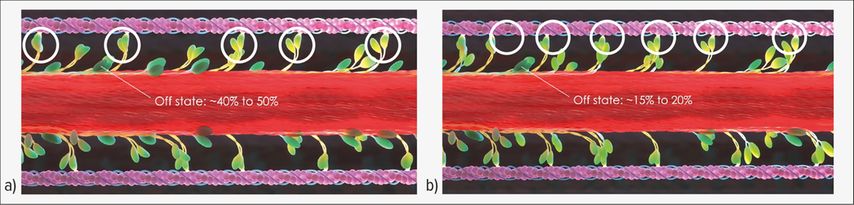
Pathophysiologisch beruht die HCM auf einer Dysfunktion der myokardialen Sarkomere. Die Sarkomere sorgen als kleinste kontraktile Einheit der Muskelzellen für eine geregelte Kontraktion und Relaxation. Entscheidend für die Kontraktilität sind die Querverbindungen zwischen Myosin und Aktin. Im gesunden Muskel sind 40–50% der Myosinköpfe inaktiv (Off-Zustand). Bei HCM sind jedoch nur etwa 15–20% der Myosinköpfe inaktiv, wodurch es zu einem Überschuss an Aktin-Myosin-Querverbindungen kommt (Abb. 1).6–10 Die Folgen dieser Fehlfunktion sind u.a. eine Hyperkontraktilität mit geringer mechanischer Effizienz, eine verminderte Relaxation und eine Hypertrophie.
Abb. 1: Sarkomerische Dysfunktion bei hypertropher Kardiomyopathie (HCM). a) Im gesunden Herzmuskel sind 40–50% der Myosinköpfe inaktiv und bilden keine Querverbindung zu Aktin. b) Bei HCM sind nur 15–20% der Myosinköpfe inaktiv und es kommt zu einem Überschuss an Aktin-Myosin-Querverbindungen
Mit Mavacamten (Camzyos®) steht nun erstmals ein Medikament zur Verfügung, das bei diesem Pathomechanismus ansetzt. Mavacamten bindet reversibel an kardiales Myosin und vermindert dadurch die Anzahl der Aktin-Myosin-Querverbindungen. «Dies führt zu einer Abschwächung der Hyperkontraktilität, einer verbesserten Relaxation, einer geringeren Steifheit des Herzgewebes und einer verbesserten Energetik und Compliance des Herzmuskels»,6–10 erklärte PD Dr. med. Annina Vischer vom Universitätsspital Basel. In der Schweiz ist Mavacamten seit April 2023 zur Verbesserung der körperlichen Leistungfähigkeit und assoziierter Symptome für erwachsene Patienten mit symptomatischer (NYHA II–III) HOCM zugelassen.11
Mavacamten wurde u.a. in den beiden Phase-III-Studien EXPLORER-HCM12 und VALOR-HCM13 untersucht. In beide Studien wurden erwachsene symptomatische Patienten (NYHA-Klasse II oder III in EXPLORER-HCM resp. III/IV in VALOR-HCM) mit einer dokumentierten HOCM und einem LVOT-Spitzengradienten von ≥50mmHg in Ruhe oder nach Provokation eingeschlossen. In VALOR-HCM mussten die Patienten die Kriterien für eine Septumreduktionstherapie (SRT) erfüllen. In beiden Studien wurde Mavacamten mit Placebo (+/– Hintergrundtherapie) verglichen.
In EXPLORER-HCM erreichten nach 30 Wochen in der Verumgruppe mehr als doppelt so viele Probanden den primären Endpunkt – definiert als Zunahme der maximalen Sauerstoffaufnahme (VO2peak) um ≥1,5ml/kg/min plus Verbesserung um ≥1 NYHA-Klasse resp. Zunahme des VO2peak um ≥3ml/kg/min ohne Verschlechterung der NYHA-Klasse – als in der in der Placebogruppe (37% vs. 17%; 95% CI: 8–30,1; p=0,0005).12 «Sehr eindrücklich ist auch die Reduktion des LVOT-Gradienten um 48mmHg unter Mavacamten, während der Gradient unter Placebo unverändert blieb»,12 sagte PD Dr. Vischer. «Ein ähnliches Bild zeigte sich für die Biomarker: Unter Mavacamten kam es zu einer signifikanten Verminderung und z.T. Normalisierung von NT-proBNP und hs-cTnI. Das deutet darauf hin, dass es unter der Behandlung zu tiefgreifenden Veränderungen am Herzen kommt.»12
In VALOR-HCM wurde untersucht, ob die Patienten nach 16 Wochen Behandlung die Kriterien für eine SRT immer noch erfüllten. Es stellte sich heraus, dass dies für 82% der Patienten unter Mavacamten nicht mehr der Fall war (vs. 23%; 95% CI: 43,99–73,87; p<0,0001).13 Die Resultate hinsichtlich der sekundären Endpunkte (Verminderung des LVOT-Gradienten und der Biomarker) waren vergleichbar mit denjenigen in EXPLORER-HCM.13 In beiden Studien zeigte sich zudem, dass der Einfluss von Mavacemten auf die linksventrikuläre Auswurffraktion trotz seiner negativ inotropen Wirkung sehr gering und nicht signifikant grösser war als unter Placebo.12,13
Die Behandlung mit Mavacamten wird in der Regel mit einer Dosis von 5mg/d gestartet. Die Dosis wird in den folgenden Wochen anhand des LVOT-Gradienten und der LVEF auftitriert (maximale Dosis: 15mg/d).11 Mavacamten wird primär durch Cytochrom-P450-Enzyme metabolisiert, weshalb auf mögliche Wechselwirkungen geachtet werden muss.11
Fazit
Die Diagnose der HCM beginnt beim Erkennen von HCM-Indikatoren und wird mittels EKG und multimodaler Bildgebung bestätigt. Ein besonderes Augenmerk liegt dabei auf der aktiven Suche nach einer latenten Obstruktion mithilfe der physiologischen Stress-Echokardiografie. Für Patienten mit einer symptomatischen HOCM steht mit dem Myosin-Inhibitor Mavacamten (Camzyos®) seit Kurzem erstmals eine spezifische, zielgerichtete medikamentöse Behandlung zur Verfügung, die sich in Phase-III-Studien als effektiv erwiesen hat.
Quelle:
Symposium der Firma Bristol-Myers Squibb SA im Rahmen der SGK-Jahrestagung, 21. bis 23. Juni 2023, Basel
Literatur:
1 Elliott PM et al.: 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: The task force for the diagnosis and management of hypertrophic cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2733-79 2 Maron BJ et al.: Diagnosis and evaluation of hypertrophic cardiomyopathy: JACC State-of-the-Art review. J Am Coll Cardiol 2022; 79: 372-89 3 Maron MS et al.: Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation 2006; 114: 2232-9 4 Maron MS et al.: Contemporary natural history and management of nonobstructive hypertrophic cardiomyopathy. J Am Coll Cardiol 2016; 67: 1399-409 5 Rapezzi C et al.: Diagnostic work-up in cardiomyopathies: bridging the gap between clinical phenotypes and final diagnosis. A position statement from the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34: 1448-58 6 Anderson RL et al.: Deciphering the super relaxed state of human β-cardiac myosin and the mode of action of mavacamten from myosin molecules to muscle fibers. Proc Natl Acad Sci USA 2018; 115: E8143-52 7 Nag S et al.: The myosin mesa and the basis of hypercontractility caused by hypertrophic cardiomyopathy mutations. Nat Struct Mol Biol 2017; 24: 525-33 8 Spudich JA et al.: Three perspectives on the molecular basis of hypercontractility caused by hypertrophic cardiomyopathy mutations. Pflugers Arch 2019; 471: 701-17 9 Alamo L et al.: Effects of myosin variants on interacting-heads motif explain distinct hypertrophic and dilated cardiomyopathy phenotypes. eLife 2017; 6: e24634 10 Sequeira V et al.: Energetic drain driving hypertrophic cardiomyopathy. FEBS Lett 2019; 593: 1616-26 11 Fachinformation Mavacamten: swissmedicinfo.ch 12 Olivotto I et al.: Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2020; 396: 759-69 13 Desai MY et al.: Myosin inhibition in patients with obstructive hypertrophic cardiomyopathy referred for septal reduction therapy. J Am Coll Cardiol 2022; 80: 95-108
Die Referenzen sind auf Anfrage bei Bristol-Myers Squibb SA erhältlich.
Kurzfachinformation
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, den Verdacht einer neuen oder schwerwiegenden Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe «Unerwünschte Wirkungen».
CAMZYOS® (Mavacamten). WWH: Kann Herzinsuffizienz aufgrund systolischer Dysfunktion auslösen. Echokardiografische Untersuchungen der LVEF vor und während Anwendung erforderlich. Behandlungsbeginn bei LVEF <55% nicht empfohlen. Behandlungsunterbruch bei LVEF <50% oder Verschlechterung des klinischen Zustands. Vorsicht bei gleichzeitiger Gabe von bestimmten CYP450-Inhibitoren und -Induktoren wegen Herzinsuffizienzrisiko geboten. I: Behandlung erwachsener Patienten mit symptomatischer (NYHA II-III) obstruktiver hypertropher Kardiomyopathie zur Verbesserung der körperlichen Leistungsfähigkeit und assoziierter Symptome. D: 2,5 mg, 5 mg, 10 mg oder 15 mg 1x/d. Die empfohlene Initialdosis beträgt 5 mg 1x/d, die Maximaldosis beträgt 15 mg 1x/d. Die Initiierung oder Auftitrierung von CAMZYOS® bei Patienten mit LVEF <55% ist nicht empfohlen. Eine regelmässige Bewertung des LVEF und des LVOT-Gradienten unter Valsalva ist für eine sorgfältige Titration erforderlich, um eine LVEF ≥50% aufrechtzuerhalten und einen angemessenen Ziel-Valsalva-LVOT-Gradienten zu erreichen. Für Titrationshinweise während der Initiierungs- und Erhaltungsphase, Dosisanpassungen bei gleichzeitiger Gabe anderer Arzneimittel und bei Behandlungsunterbruch siehe Fachinformation. Bei LVEF <50% während der Behandlung mit CAMZYOS®, muss die Behandlung unterbrochen werden. KI: Überempfindlichkeit gegen Wirkstoff oder Hilfsstoffe. Schwangerschaft. W/VM: Mavacamten verringert LVEF und kann Herzinsuffizienz durch systolische Dysfunktion auslösen. Asymptomatische LVEF-Reduktion, interkurrente Erkrankungen (z.B schwere Infektionen) und Arrhythmien bei der Dosierung berücksichtigen. Regelmässige Beurteilung des klinischen Zustands vor und während der Behandlung mit CAMZYOS®. IA: Bei Initiierung, Absetzen oder Dosisanpassung einer gleichzeitigen Anwendung mit starkem CYP2C19-Inhibitor wird Dosisanpassung von Mavacamten und/oder zusätzliche klinische Kontrolle empfohlen. Diese sollten in Betracht gezogen werden bei moderatem oder schwachem CYP2C19- oder starkem CYP3A4-Inhibitor. Bei Absetzen oder Dosisreduktion der gleichzeitigen Behandlung mit starkem CYP2C19-oder CYP3A4-Induktor, werden zusätzliche klinische Kontrollen empfohlen. Diese sollten in Betracht gezogen werden bei Initiierung oder Dosiserhöhung des Induktors. Intermittierende Gabe von CYP2C19-Hemmer oder starkem CYP2C19-Induktor oder starkem CYP3A4-Hemmer oder -Induktor nicht empfohlen. UAW: Schwindel, Herzinsuffizienz, systolische Dysfunktion (LVEF <50%). P: Hartkapseln zu 2,5 mg, 5 mg, 10 mg oder 15 mg: 28. (B). ZI: Bristol-Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen. Ausführliche Informationen siehe Arzneimittel-Fachinformation unter www.swissmedicinfo.ch. (V001)
Mit freundlicher Unterstützung durch Bristol-Myers Squibb SA
CV-CH-2300046 07.2023