Erkrankungen der Gallenwege und des Pankreas – diagnostisches Vorgehen und endoskopische Verfahren
Autor:innen:
PD Dr. med. Emanuel Burri
Chefarzt
Dr. med. Christina Raichle
Leitende Ärztin
Klinik Gastroenterologie und Hepatologie
Kantonsspital Baselland, Liestal
E-Mail: emanuel.burri@ksbl.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die endoskopischen Verfahren zur Diagnostik und Therapie von Erkrankungen der Gallenwege und des Pankreas haben sich in den letzten Jahren deutlich weiterentwickelt. Die Endosonografie (EUS) und die endoskopische retrograde Cholangiopankreatikografie (ERCP) bieten heute zahlreiche therapeutische Möglichkeiten, welche wenig invasiv sind und chirurgische oder radiologische Verfahren ersetzen können.
Keypoints
-
Bei komplizierter Choledocholithiasis bietet die SpyGlassTM-DS-II-Cholangioskopie die Möglichkeit einer direkten Visualisierung und gezielten elektrohydraulischen Fragmentierung der Konkremente unter Sicht in den Gallenwegen.
-
Die Endosonografie-gesteuerte Gallengangsdrainage ist der perkutanen Drainage im Hinblick auf den technischen Erfolg und das klinische Outcome deutlich überlegen.
-
Die visuelle Inspektion von suspekten Gallengangsstenosen mit der SpyGlass-Cholangioskopie hat eine diagnostische Genauigkeit von 80–90%.
-
Bei chronischer Pankreatitis erreichen bis zu 74% der Patienten durch endoskopische Therapien eine langfristige Schmerzlinderung.
Erkrankungen der Gallenwege
Choledocholithiasis
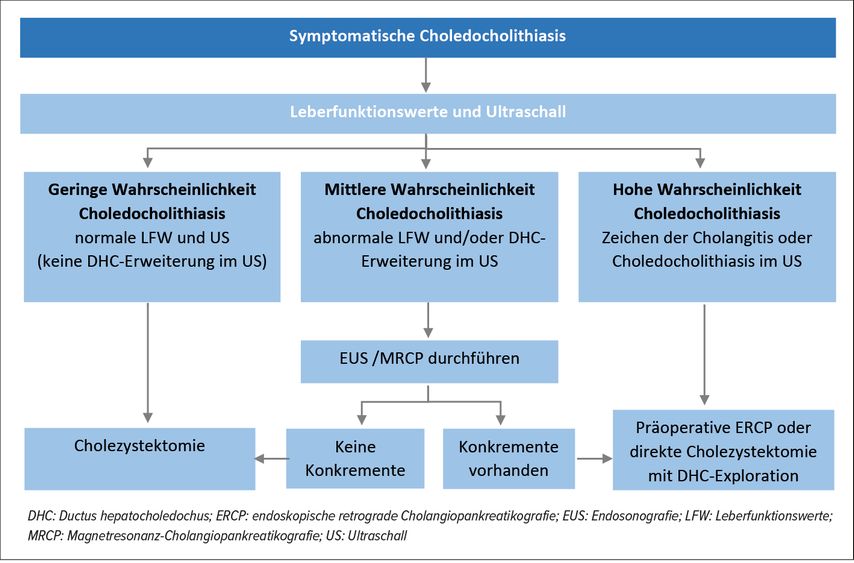
Gallengangsteine (Choledocholithiasis) treten bei 8–18% aller Patienten mit Gallenblasensteinen (Cholezystolithiasis) auf.1 Die Patienten klagen über kolikartige Schmerzen im rechten Oberbauch (20min bis Stunden), verbunden mit Übelkeit, Erbrechen und häufig Ikterus. Mit der Abdomensonografie können die intra- und extrahepatischen Gallengwege beurteilt und zusammen mit den Laboruntersuchungen kann die weitere Abklärung gesteuert werden (Abb. 1). Bei einer hohen Wahrscheinlichkeit für eine Choledocholithiasis kann direkt eine endoskopische retrograde Cholangiopankreatikografie (ERCP) durchgeführt werden. Sind weitere Abklärungen indiziert, wird meist eine Endosonografie (EUS) durchgeführt. Zeigt diese eine Choledocholithiasis, kann in der gleichen Sitzung die ERCP erfolgen. Je nach lokaler Expertise kann als Alternative zur EUS eine Magentresonanz-Cholangiopankreatikografie (MRCP) durchgeführt werden.2
Die ERCP ist die Therapie der Wahl bei Choledocholithiasis. Nach Intubation der Papilla Vateri mit dem Führungsdraht wird in aller Regel eine Papillotomie durchgeführt. Gelegentlich ist zusätzlich eine Ballondilatation der Papille notwendig, damit die Öffnung gross genug ist für die Extraktion der Konkremente.2 Die Post-ERCP-Pankreatitis stellt die häufigste Komplikation nach ERCP dar. Die Inzidenz liegt bei 3,5–9,7%. Weitere seltenere Komplikationen sind Cholangitis, Cholezystitis, Blutung und Perforation.3
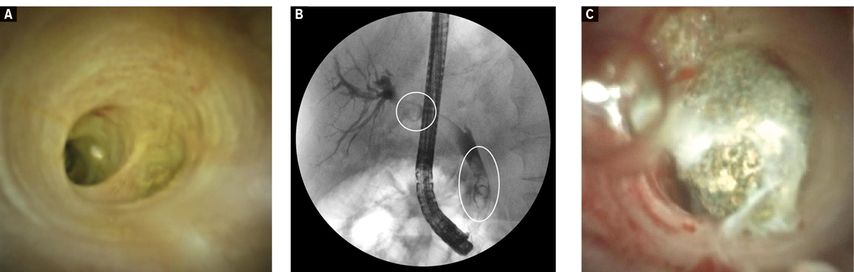
Es wird zwischen einer einfachen und einer komplizierten Choledocholithiasis unterschieden. Eine komplizierte Situation ist definiert durch den Steindurchmesser (>1,5cm), die Anzahl der Konkremente (>3), ihre Form (fassförmig), die Lokalisation (intrahepatisch, im Ductus cysticus) sowie anatomische Faktoren (enger Ductus hepatocholedochus [DHC] distal des Konkrements, sigmoidförmiger DHC, impaktierter Stein). Während kleinere Steine mittels Ballon- oder Korbkatheter direkt aus den Gallenwegen extrahiert werden können, ist bei einer komplizierten Choledocholithiasis häufig eine Fragmentierung (Lithotripsie) notwendig. Diese kann mechanisch durch spezielle Katheter oder durch die früher verwendete extrakorporale Schallwellenlithotripsie (ESWL) erreicht werden. In Endoskopiezentren besteht zudem die Möglichkeit, die Konkremente unter Sicht, durch den Einsatz des Ein-Operator-Cholangioskops (SpyGlassTM DS II, Boston Scientific Corp., MA, USA) mit einer elektrohydraulischen Lithotripsie (EHL) oder einer YAG-Laser-Sonde zu zertrümmern. Das Cholangioskop wird über den Arbeitskanal des Endoskops in den Gallengang eingeführt («Mother-Baby-Prinzip») und ermöglicht die Visualisierung der Konkremente. Über den Arbeitskanal des Cholangioskops kann dann eine 1mm breite bipolare EHL-Sonde eingeführt werden, an deren Spitze es zu elektrischen Entladungen kommt, welche im wässrigen Medium durch Plasmaexpansion mit Ausbildung einer Kavitationsblase Druckwellen erzeugen (Abb. 2). Auch grosse Konkremente können damit in 95% erfolgreich fragmentiert werden.2,4
Abb. 2: Ein-Operator-Cholangioskopie (SpyglassTM DS II) bei komplizierter Choledocholithiasis. A: unauffälliger Gallengang; B: multiple Konkremente im DHC (ERCP); C: Konkremente im DHC (Cholangioskopie)
Eine veränderte Anatomie, z.B. durch ein ampulläres Duodenaldivertikel oder nach Operationen (z.B. Billroth-II-Operation, Roux-en-Y-Magenbypass), kann die ERCP technisch sehr anspruchsvoll machen. Bei Patienten mit Roux-en-Y-Magenbypass kann der biliäre Zugang nur durch eine Enteroskopie-assistierte ERCP, eine Laparoskopie-assistierte transgastrische ERCP oder durch eine EUS-gesteuerte transgastrische ERCP (EDGE) erzielt werden. Im letzteren Fall wird EUS-gesteuert ein Metallstent als Verbindung zwischen den ausgeschlossenen Restmagen und den verbliebenen Magenpouch (Gastrogastrostomie) bzw. das Jejunum (Gastrojejunostomie) gelegt. Über diesen Zugang kann dann die ERCP erfolgen. Die EDGE ist hinsichtlich der Erfolgsrate vergleichbar mit der Laparoskopie-assoziierten ERCP (97% vs. 97%), jedoch der Enteroskopie-assistierten ERCP deutlich überlegen (100% vs. 60%).5,6
Akute Cholezystitis
Die Diagnose einer Cholezystitis kann in aller Regel mittels Abdomensonografie gestellt werden. Hier finden sich typischerweise eine verdickte (>3mm), mehrgeschichtete Gallenblasenwand sowie teilweise Flüssigkeit im Gallenblasenbett. Unter Einbezug der Dopplersonografie lässt sich zudem eine Hyperämie feststellen. Bei etwa 95% der Patienten mit einer akuten Cholezystitis liegt eine Cholezystolithiasis vor. Ohne Behandlung führt die Cholezystitis in 10% zu einer gedeckten bzw. in 1% zu einer freien Perforation.7,8
Die laparoskopische Cholezystektomie stellt den Goldstandard der Therapie der akuten Cholezystitis dar. Bei Patienten, die aufgrund schwerer Komorbiditäten nicht für eine operative Therapie qualifizieren, kann alternativ eine interventionelle Gallenblasendrainage durchgeführt werden. Neben der perkutanen Gallenblasendrainage (PT-GBD) hat sich in den letzten Jahren die EUS-gesteuerte Gallenblasendrainage (EUS-GBD) als weitere Option etabliert. Verschiedene Studien, welche diese beiden Therapieoptionen miteinander verglichen haben, konnten sowohl eine Überlegenheit bezüglich des technischen Erfolges (96% vs. 89%) als auch ein besseres klinisches Outcome hinsichtlich der 1-Jahres-Komplikationsrate (25,6% vs. 77,5%), der Reinterventionsbedürftigkeit nach 30 Tagen (2,6% vs. 30%) und der ungeplanten Wiedervorstellungen (15,4% vs. 50%) in der EUS-GBD-Gruppe im Vergleich zur PT-GBD-Gruppe zeigen.9,10 So empfehlen auch aktuelle internationale Guidelines, eine EUS-GBD der PT-GBD vorzuziehen.11
Gallengangsstenosen
Es ist zwischen benignen und malignen Gallengangsstenosen zu unterscheiden. Zu den benignen Ursachen biliärer Stenosen zählen iatrogene Ursachen (z.B. nach Lebertransplantation oder Cholezystektomie), entzündliche Veränderungen (u.a. primär sklerosierende Cholangitis, IgG4-assoziierte Cholangiopathie, autoimmune Cholangitis, chronische und Autoimmunpankreatitis), das Mirizzi-Syndrom und die ischämische Cholangiopathie. In 76–85% liegt jedoch eine maligne Ursache zugrunde (Adenokarzinom des Pankreas, cholangiozelluläres Karzinom).12 In der Diagnostik unklarer Gallengangsstenosen hat sich die Cholangioskopie als neues diagnostisches Verfahren etabliert. Durch eine visuelle Inspektion der suspekten Gallengangsstenosen alleine kann eine diagnostische Genauigkeit von 80–90% erzielt werden, da neoplastische Veränderungen typischerweise ein papilläres Muster sowie eine unregelmässige Gefässstruktur aufweisen. Gezielte Biopsien weisen eine geringere Sensitivität von 60–85% auf.13 Im Vergleich hierzu liegt die Sensitivität bei der Bürstenzytologie während einer ERCP bei nur 42%.14
Benigne Gallengangsstenosen werden meist mit endoskopischer Dilatation (Ballon- oder Bougie-Katheter) und sequenzieller Einlage multipler Kunststoffstents in mehreren Sitzungen therapiert. Bei dieser Technik liegt die Erfolgsrate bei bis zu 94%, im Vergleich zu 60% bei Einlage eines einzelnen Kunststoffstents. Zu den häufigsten Komplikationen zählen Cholangitis, Pankreatitis, Stentokklusion und Stentdislokation.15,16 Es können auch vollbeschichtete selbstexpandierende Metallstents («fully covered», fcSEMS) eingesetzt werden, wobei diese den Plastikstents hinsichtlich einer erfolgreichen Therapie der Stenose nicht überlegen sind.17 Als neue Option sind auch biologisch abbaubare, selbstexpandierende Stents verfügbar, die eine klinische Erfolgsrate von 83% zeigen, wobei bislang nur wenige klinische Daten vorliegen.18
Bei der Therapie von malignen Gallengangsstenosen handelt es sich oft um palliative Verfahren, da bei Diagnosestellung bereits etwa 70% der Stenosen inoperabel sind. Trotz geringerer Rezidivrate bei chirurgisch angelegter biliodigestiver Anastomose im Vergleich zu Gallengangstents werden endoskopische Verfahren aufgrund der geringeren Mortalität (10% vs. 16%) und der niedrigeren Komplikationsrate meist bevorzugt.19,20 Ausser bei Stenosen im Hilusbereich (meist Einsatz von unbeschichteten SEMS) kommen hauptsächlich fcSEMS zur Anwendung. Mehrere Metaanalysen konnten jedoch keinen signifikanten Unterschied zwischen unbeschichteten SEMS und fcSEMS bezüglich des klinischen Outcomes finden.11,21,22 Um die Stentoffenheit zu erhöhen, kann zusätzlich eine Radiofrequenzablation durchgeführt werden, wobei deren Nutzen nicht klar gezeigt wurde.23
Zunehmend werden in spezialisierten Zentren auch EUS-gesteuerte Verfahren zur Drainage der Gallenwege (EUS-BD) durchgeführt, v.a. wenn der klassische transpapilläre Zugang nicht möglich ist.11,21 Im Vergleich zur früher meist üblichen perkutanen transhepatischen Gallendrainage (PTCD) weist die EUS-BD bei identischer Erfolgsrate eine geringere Komplikations- und Reinterventionsrate auf.24 Bei der EUS-BD bestehen drei verschiedene Zugangswege: Entweder kann mittels Rendezvous-Verfahren EUS-gesteuert ein Führungsdraht transhepatisch oder über den DHC antegrad via Papille in das Duodenum eingelegt werden; oder es können nicht anatomische direkte Zugangswege geschaffen werden und ein Metallstent kann eingelegt werden. Dies kann vom Magen in die Leber (Hepatikogastrostomie) oder vom Duodenum in den Gallengang (Choledochoduodenostomie) bzw. in die Gallenblase (Cholezystogastrostomie, Cholezystoduodenostomie) erfolgen. Bei all diesen Zugangswegen wird EUS-gesteuert mit einer 19-G-Hohlnadel punktiert und ein Führungsdraht eingelegt. Über diesen wird dann in der Regel ein «lumen-apposing» Metallstent (LAMS) eingebracht. Erste Studien haben gezeigt, dass der technische (91–94%) und klinische Erfolg der EUS-BD im Vergleich zur ERCP ähnlich bis grösser ist und das Vorgehen dabei eine ähnliche bis niedrigere Komplikationsrate (v.a. weniger Pankreatitiden) aufweist.25–27 Auch ergab eine kürzliche Studie, dass die EUS-BD der ERCP vor hepatobiliärer Chirurgie im Hinblick auf die klinische und technische chirurgische Erfolgsrate (97% vs. 75%, 97% vs. 83%) überlegen ist und kürzere Hospitalisationsdauern aufweist.28 Derzeit wird in weiteren randomisierten, kontrollierten Studien untersucht, ob eine primäre EUS-BD bei malignen Gallengangsstenosen im Vergleich zur ERCP auch längerfristig überlegen ist.29,30
Erkrankungen des Pankreas
Akute Pankreatitis
Die häufigste Ursache einer akuten Pankreatitis stellen mit 17–40% Gallensteine dar. Kann bei einer akuten biliären Pankreatitis ein Konkrement im DHC nachgewiesen werden, sollte innerhalb von 72h eine ERCP zur biliären Drainage durchgeführt werden. Bei zusätzlicher Cholangitis ist die ERCP bereits innerhalb der ersten 24h anzustreben. Zudem sollte zeitnah eine Cholezystektomie erfolgen.2,31–33
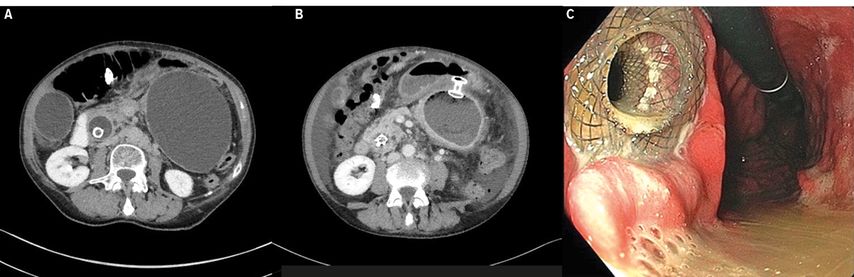
In bis zu 10% der Fälle kommt es nach einer akuten Pankreatitis zu lokalen Komplikationen, wie Bildung von (peri)-pankreatischen Flüssigkeitskollektionen, Pankreaspseudozysten, akuten nekrotischen Kollektionen sowie abgekapselten Nekrosen, sog. Walled-off-Nekrosen (WON).Grösstenteils sind Patienten mit Pseudozysten asymptomatisch. Kommt es bei grossen Pseudozysten zu abdominalen Schmerzen oder einer Magenausgangsobstruktion, sollte eine Drainage der Kollektion erfolgen. Eine Drainage ist ebenfalls indiziert bei infizierter Nekrose oder symptomatischer WON. Auch hier kommen heutzutage hauptsächlich EUS-gesteuerte transgastrische oder transduodenale Verfahren zum Einsatz. EUS-gesteuert wird die Flüssigkeitskollektion punktiert, ein Führungsdraht eingelegt und entweder ein Kunststoffstent oder ein LAMS platziert. Die Einlage eines LAMS ist technisch einfacher und schneller. Mit einem dezidierten Kathetersystem kann die Punktion ohne Führungsdraht Elektrokauter-geführt erfolgen und es kann direkt die Stentplatzierung erfolgen. LAMS weisen breite Verankerungskragen an beiden Seiten sowie ein grosses Lumen auf, welches eine Okklusion durch nekrotisches Gewebe verhindern soll (Abb. 3). Im Falle einer WON kann über das weite Lumen des LAMS auch eine endoskopische Nekrosektomie erfolgen.33,34 Eine aktuelle Metaanalyse, welche den Einsatz von LAMS und Kunststoffstents zur Drainage von pankreatischen Pseudozysten und WON miteinander verglichen hat, zeigte eine ähnliche technische (97,6% vs. 97,5%) und klinische Erfolgsrate (90,1% vs. 84,2%) beider Stentarten. Die LAMS-Gruppe zeigte jedoch eine signifikant niedrigere Komplikationsrate (16% vs. 20,2%).33,35
Abb. 3: Grosse Pankreaspseudozyste vor und nach transgastrischer Einlage eines LAMS. A) Pseudozyste ohne LAMS (CT); B) Pseudozyste mit LAMS (CT); C) endoskopisches Bild eines eingelegten LAMS
Chronische Pankreatitis
Bei der chronischen Pankreatitis (CP) handelt es sich um eine fortschreitende Erkrankung, charakterisiert durch chronische Inflammation und Parenchymfibrose des Pankreas sowie Verlust der Azinus- und Inselzellen. Dies kann im Verlauf zu einer exokrinen und endokrinen Pankreasinsuffizienz führen. Als weitere Komplikationen der CP, für welche endoskopische Therapieoptionen zur Verfügung stehen, sind neben den Pankreaspseudozysten und biliären Gangstenosen (siehe oben) auch Pankreasgangstrikturen sowie die Pankreatikolithiasis zu nennen.36
Wird eine Pankreasgangstriktur festgestellt, sollte vor einer endoskopischen Therapie immer eine maligne Ursache ausgeschlossen werden. Als Erstlinientherapie einer dominanten, symptomatischen Striktur werden eine sequenzielle Dilatation und ein Mehrfachstenting des Pankreasganges über ein Jahr empfohlen.34 Metallstents bringen hier keinen Vorteil gegenüber Kunststoffstents.37 Im kurzfristigen Verlauf kann durch das Stenting des Pankreasgangs eine Schmerzlinderung in bis zu 88% erzielt werden, wobei eine langfristige Schmerzlinderung (9,5 Jahre) nach Mehrfachstenting in 69–74% zu erwarten ist. Eine Restenosierung tritt in bis zu 10,4% auf. Die Komplikationsrate bei den endoskopischen Eingriffen zur Strikturtherapie liegt bei ca. 8%, wobei es am häufigsten zu Pankreatitiden, Stentverschlüssen und Stentmigrationen kommt.38,39
In Fällen, in denen eine transpapilläre, ERCP-gesteuerte Stenteinlage nicht gelingt, besteht die Möglichkeit des anspruchsvolleren EUS-gesteuerten transgastrischen Zugangs. Dabei wird der Pankreasgang vom Magen her punktiert, ein Führungsdraht in den dilatierten Pankreasgang eingelegt und über die Papilla major in das Duodenum vorgeschoben (Rendezvous-Verfahren), sodass der Stent via ERCP über den Führungsdraht eingelegt werden kann. Alternativ kann die Stenteinlage direkt über den transgastrischen Zugang (EUS-gesteuerte Pankreatikogastrostomie) erfolgen.40 Eine aktuelle Metaanalyse zeigte eine technische und klinische Erfolgsrate dieser Eingriffe von 85% bzw. 89%, wobei die Komplikationsrate im Vergleich zur konventionellen Stenteinlage mittels ERCP höher war (total 18,1%, akute Pankreatitis 6,6%, Blutung 4,1%, Perforation und/oder Pneumoperitoneum 3,1%).41 Diese Eingriffe werden deshalb nur an ausgewählten Zentren durchgeführt.
Bei über 50% der Patienten mit einer CP bilden sich Pankreasgangkonkremente. Die Prävalenz der Konkremente steigt mit der Krankheitsdauer und liegt nach 5 bzw. 14 Jahren ab Krankheitsbeginn bei 50% bzw. 100%.42 Über viele Jahre war die ESWL die einzige nicht chirurgische Therapieoption. Heutzutage kann mit der Ein-Operator-Pankreatikoskopie (SpyGlassTM DS II, Boston Scientific Corp., MA, USA) in Kombination mit EHL- oder einer YAG-Laser-Sonde eine direkte Lithotripsie erreicht werden.34 In bisherigen retrospektiven Studien lag die Erfolgsrate damit bei 43–100%.43 Eine kürzlich publizierte prospektive, multizentrische Arbeit konnte durch Einsatz dieser endoskopischen Therapieoption eine vollständige Konkremententfernung in 90% mit Schmerzreduktion in bis zu 82,4% zeigen.44
Ausblick
Die interventionelle Endoskopie bei Erkrankungen der Gallenwege und des Pankreas hat sich in den letzten Jahren sehr stark weiterentwickelt, sodass neue Verfahren wie EUS-gesteuerte biliäre Drainagen und endoskopische Pankreaseingriffe invasivere chirurgische Eingriffe sowie die konventionelle ERCP ersetzen können. Ob diese neuen endoskopischen Therapieoptionen den bisher etablierten Modalitäten tatsächlich überlegen sind, muss in randomisierten, kontrollierten Studien weiter untersucht werden. Auch muss geprüft werden, ob ein Einsatz dieser Verfahren auch ausserhalb von Kompetenzzentren sinnvoll ist.
Literatur:
1 Ko CW, Lee SP: Gastrointest Endosc 2002; 56: 165-9 2 Manes G et al.: Endoscopy 2019; 51: 472-91 3 Dumonceau JM et al.: Endoscopy 2020; 520: 127-49 4 Gutierrez OIB et al.: Clin Gastroenterol Hepatol 2018; 16: 918-26.e1 5 Bukhari M et al.: Clin Gastroenterol Hepatol 2018; 88: 484-94 6 Prakash S et al.: Endoscopy 2022; 54: 52-61 7 Date RS et al.: Int J Surg 2012; 10: 63-8 8 Halpin V: BMJ Clin Evid 2014: 0411 9 Teoh AYB et al.: Gut 2020; 69: 1085-91 10 Mohan BP et al.: Endoscopy 2020; 52: 96-106 11 Van der Merwe SW et al.: Endoscopy 2022; 54: 185-205 12 Singh A et al.: Gastroenterol Rep (Oxf) 2015; 3: 22-31 13 Navaneethan U et al.: Gastrointest Endosc 2016; 84: 649-55 14 Burnett AS et al.: J Surg Res 2013; 184: 304-11 15 Costamagna G et al.: Gastrointest Endosc 2001; 54: 162-8 16 Van Boeckel P et al.: BMC Gastroenterol 2009; 9: 96 17 Visconti TAC et al.: Endosc Int Open 2018; 6: E914-23. 18 Siiki A et al.: Gastrointest Endosc 2018; 87: 1132-7 19 De Lima SLA et al.: Int J Hepatobiliary Pancreat Dis 2015; 5: 35 20 Distler M et al.: JOP 2010; 11: 568-74 21 Dumonceau JM et al.: Endoscopy 2018; 50: 910-30 22 Tringali A et al.: Endoscopy. 2018; 50: 631-41 23 Albers D et al.: Gastrointest Endosc 2022; 96: 970-9 24 Sharaiha RZ et al.: Gastrointest Endosc 2017; 85: 904-14 25 Paik WH et al.: Am J Gastroenterol 2018; 113: 987-97 26 Bang JY et al.: Gastrointest Endoc 2018; 88: 277-82 27 Park JK et al.: Gastrointest Endosc 2018; 88: 277-82 28 Tyberg A et al.: J Clin Gastroenterol 2022; doi: 10.1097/MCG.0000000000001795 29 Itonaga M et al.: Medicine (Baltimore) 2021; 100: e25268 30 Chen YI et al.: Trials 2019; 20: 696 31 Da Costa DW et al.: Lancet 2015; 386: 1261-8 32 Nealon WH et al.:Ann Surg 2004; 239: 741-9 33 Arvanitakis M et al.: Endoscopy 2018; 50: 524-46 34 Dumonceau JM et al.: Endoscopy 2019; 51: 179-93 35 Guzmán-Calderón E et al.: J Hepato-Biliary-Pancreatic Sci 2022; 29: 181-292, e1-e9 36 Forsmark CE: Gastroenterology 2013; 144: 1282-91.e3 37 Shen Y et al.: Pancreatol 2014; 14: 87-90 38 Jafri M et al.: JOP 2017; 18: 125-32 39 Tringali A et al.: Endoscopy 2019; 51: 930-5 40 Ergun M et al.: Endoscopy 2011; 43: 518-25 41 Chandan S et al.: Endosc Int Open 2020; 8: E1664-72 42 Ammann RW et al.: Gastroenterol 1984; 86: 820-8 43 Beyna T et al.: Dig Endosc 2018; 30: 29-37 44 Gerges C et al.: Endoscopy 2023; 55: 150-7
Das könnte Sie auch interessieren:
Das kardiovaskuläre Risiko von IBD-Patienten
Eine aktive IBD erhöht das Risiko für kardiovaskuläre Erkrankungen, während bestehende kardiovaskuläre Probleme die Wahl der Medikation erschweren. Das Ziel ist es, die richtige Balance ...
Aktuelle Studien aus Gastroenterologie und Hepatologie
Am Jahreskongress der Schweizerischen Gesellschaft für Gastroenterologie (SSG) und der Swiss Association for the Study of the Liver (SASL) vom 11. bis 12. September 2025 in Interlaken ...
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...