L’hyperglycémie pendant la grossesse
Compte-rendu:
Claudia Benetti
Journaliste médicale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le diabète sucré pendant la grossesse est associé à des risques pour la mère et l’enfant.1 Le Pr Dr méd. Roger Lehmann, de Zurich, a expliqué lors du cours Diabetes Update Refresher du FOMF quelles sont les directives en vigueur pour le diagnostic et le traitement d’un diabète gestationnel et d’un diabète préexistant pendant la grossesse.
Keypoints
-
Aucun dépistage du diabète gestationnel (DG)
-
Un test HGPO (dose de 75g) doit être réalisé chez toutes les femmes entre la 24e et la 28e SG (exception: GL à jeun ≥5,1mmol/l ou <4,4mmol/l).
-
Valeurs de GL pour le diagnostic du DG: ≥5,1mmol/l pour la GL à jeun, ≥10,0mmol/l pour la valeur à 1h après le test HGPO et ≥8,5mmol/l pour la valeur à 2h après le test HGPO
-
Si la GL à jeun est ≥5,1mmol/l en début de grossesse, il s’agit d’un DG.
-
Valeurs cibles de GL pendant la grossesse: <5,3mmol/l pour la GL à jeun, <8,0mmol/l à 1h postprandiale, <7,0mmol/l à 2h postprandiale
-
Les mesures liées au mode de vie sont essentielles pour la prévention et le traitement du DG.
-
L’IMC et la GL de la mère sont des facteurs prédictifs indépendants du poids de naissance.
-
La prévention et le traitement du DG réduisent le risque de complications périnatales ainsi que de conséquences tardives chez la mère et l’enfant.
Sur les 80000 naissances annuelles en Suisse, environ une sur six est associée à une forme de diabète, qu’il s’agisse de diabète de type 2 (DT2) préexistant, connu ou non, ou de diabète gestationnel. Le diabète de type 1 (DT1) ne concerne qu’environ 160 naissances par an.
«Les critères de diagnostic habituels s’appliquent au diabète sucré préexistant non diagnostiqué», a expliqué R. Lehmann. Concrètement, le diagnostic de diabète préexistant peut être posé si, lors de la première consultation prénatale, l’une des valeurs limites suivantes est atteinte ou dépassée: glycémie (GL) à jeun ≥7mmol/l, HbA1c ≥6,5%, GL occasionnelle ou GL à 2h après l’hyperglycémie provoquée par voie orale (HGPO) ≥11,1mmol/l.2 «L’HbA1c n’est pas appropriée pour le diagnostic du diabète gestationnel, mais elle l’est pour celui du diabète préexistant qui n’a pas encore été diagnostiqué», précise R. Lehmann.
Risque d’hypoglycémie plus élevé au début de la grossesse
Au cours de la grossesse, les besoins en insuline évoluent. Chez les femmes atteintes de DT1, il diminue de 15 à 20% au cours du premier trimestre et augmente ensuite de 5% par semaine jusqu’à la 36e semaine de grossesse (SG). Les besoins en insuline à la 36e SG sont supérieurs de 50% par rapport à ceux avant la grossesse et de 70 à 100% par rapport à la valeur la plus basse au premier trimestre.3
Cette meilleure sensibilité à l’insuline entre la 7e et la 14e SG s’accompagne d’un plus grand nombre d’hypoglycémies.4 «Les patientes doivent être informées de cela», a souligné l’intervenant. Les femmes qui souhaitent avoir un enfant et qui sont atteintes de DT1 ou de DT2 doivent en outre savoir que l’HbA1c doit être <6,5% avant la grossesse.2 En effet, le risque d’anomalies congénitales augmente à partir d’une HbA1c de 6,5%. Le risque augmente de manière linéaire par rapport au taux d’HbA1c et s’élève à environ 10% pour un taux d’HbA1c de 10%.5 En comparaison, le risque d’anomalies congénitales est de 2% pour les grossesses sans diabète.
Diabète gestationnel: définition et dépistage
Par définition, le diabète gestationnel (DG) correspond à une intolérance au glucose détectée pour la première fois pendant la grossesse. «Cette définition est indépendante du type de traitement et de la persistance ou non de l’état après l’accouchement», précise R. Lehmann. Elle n’exclut pas non plus la possibilité d’une intolérance au glucose ou d’un diabète sucré préexistant·e.1
On distingue également le diabète préexistant (DT1, DT2 ou autre forme de diabète) et l’hyperglycémie pendant la grossesse. Cette dernière se subdivise en diabète préexistant, mais encore inconnu, et en DG. Le DG comprend la forme précoce (avant la 24e SG) et la forme classique (entre la 24e et la 28e SG).1
Un test HGPO pour toutes les femmes enceintes
«Pour le dépistage du DG, il existe une recommandation claire de réaliser un test HGPO à une dose de 75g chez toutes les femmes enceintes entre la 24e et la 28e SG», a expliqué R. Lehmann. Les valeurs limites pour la présence d’un DG sont les suivantes: ≥5,1mmol/l pour la GL à jeun, ≥10,0mmol/l pour la valeur à 1h après le test HGPO et ≥8,5mmol/l pour la valeur à 2h après le test HGPO.6
Un dépistage du DG avant la 24e SG n’est indiqué que pour les femmes présentant un risque accru. Les facteurs de risque incluent un âge >35 ans, un IMC >30kg/m2, des antécédents de prédiabète/DG, un syndrome des ovaires polykystiques, un traitement par des corticoïdes ou des antipsychotiques, un poids de naissance >4500g lors d’une grossesse précédente, des avortements habituels et un hydramnios. Un test HGPO avant la 24e SG n’est toutefois pas recommandé. À ce stade, une GL à jeun ≥5,1mmol/l suffit pour diagnostiquer un DG.7 Si la valeur est inférieure, un test HGPO est également réalisé dans la population à risque entre la 24e et la 28e SG.7
Les preuves disponibles concernant les valeurs limites diagnostiques du test HGPO pendant la grossesse sont fournies entre autres par la grande étude multicentrique internationale HAPO, menée sur 25000 participantes de quatre continents.8 «L’étude a montré que le risque de macrosomie augmente régulièrement avec l’augmentation des valeurs pour tous les types de GL – GL à jeun, valeur à 1h ou 2h après le test HGPO», a déclaré R. Lehmann.
Le DG: un risque pour la mère et l’enfant
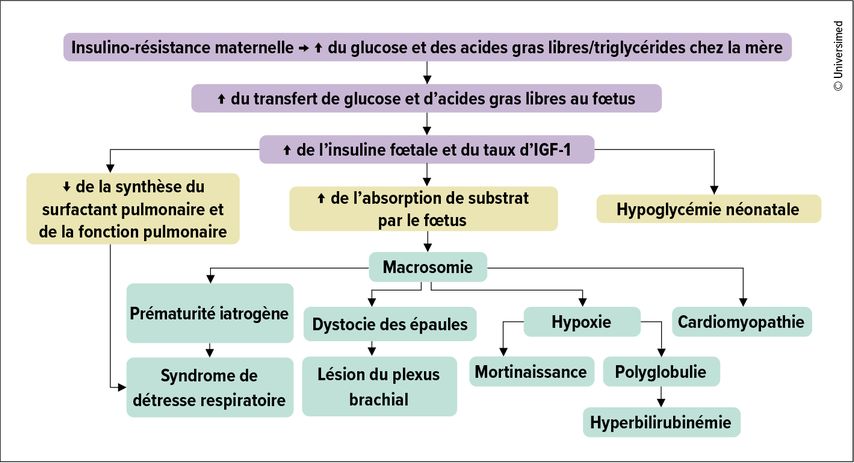
Un DG non traité comporte plusieurs risques. Par exemple, la probabilité de survenue d’une pré-éclampsie et d’une éclampsie est plus élevée, et 63% des femmes concernées développent un DT2 manifeste après 10 à 15 ans. Toutefois, un DG non traité augmente également le risque de macrosomie et de complications associées, telles que la dystocie des épaules, l’hypoglycémie postnatale chez le nouveau-né et l’augmentation du taux de césarienne, ainsi que d’autres complications néonatales (Fig. 1). On sait en outre qu’une GL à jeun >5,8mmol/l au cours des quatre à huit dernières SG est associée à une fréquence accrue de mort in utero.
La bonne nouvelle est que les risques peuvent être réduits de manière significative lors de la première manifestation d’un DG, rien qu’en modifiant le mode de vie. De même, un diagnostic et un traitement précoces du diabète préviennent les conséquences tardives chez la mère et l’enfant. «Les femmes souffrant de DG sont toutefois des patientes à risque. Elles doivent continuer à être suivies de près après l’accouchement», a déclaré R. Lehmann.
Contrôle de la GL jusqu’à la 20e SG
Des valeurs cibles de GL spécifiques s’appliquent à la grossesse. Les glucomètres destinés à un usage à domicile étant imprécis (+/–15%), la Société Suisse d’Endocrinologie et de Diabétologie (SSED) a défini des valeurs cibles faciles à retenir, qui diffèrent légèrement des valeurs internationales. Elle recommande les valeurs cibles suivantes pour les femmes enceintes: GL à jeun <5,3mmol/l, GL postprandiale à 1h <8,0mmol/l et à 2h <7,0mmol/l.6
«On a jusqu’à la 20e SG pour contrôler la GL en cas de diabète connu pendant la grossesse, car le fœtus réagit après aux pics hyperglycémiques en produisant davantage d’insuline», a expliqué R. Lehmann. Des études montrent qu’un bon contrôle de la GL réduit significativement le risque de complications périnatales chez la mère et l’enfant.9,10
Il faut également faire attention à la prise de poids
«Outre un bon contrôle de la GL, une prise de poids normale de la mère pendant la grossesse est également essentielle pour éviter une prise de poids excessive chez le fœtus ainsi que le développement ultérieur d’un diabète chez la mère et l’enfant», a souligné le spécialiste. En effet, l’obésité est, avec le DG et un diabète préexistant, l’un des principaux facteurs de risque de macrosomie.11 Il existe une relation directe entre l’IMC de la mère et celui de l’enfant: «plus le poids de la mère est important, plus celui de l’enfant l’est aussi».12 L’IMC et la GL de la mère sont des facteurs prédictifs indépendants du poids de naissance. Le risque d’un poids de naissance supérieur au 90e percentile est de 2,07 en cas d’obésité et de GL normale, de 2,58 en cas de DG et de poids idéal, et de 5,35 en cas de DG et d’obésité.13 «Il est donc important de souligner que les femmes en surpoids devraient prendre moins de poids pendant la grossesse que celles ayant un poids idéal. Pour les femmes obèses, on peut même affirmer qu’elles ne devraient pas du tout prendre de poids pendant la grossesse ou qu’elles devraient prendre 4 à 5kg au maximum», explique R. Lehmann.
Traitement du DG: l’accent est mis sur les mesures liées au mode de vie
La prévention et le traitement du DG reposent sur l’alimentation, une faible prise de poids, l’activité physique et, le cas échéant, l’insuline. Les trois premières mesures suffisent pour une grande partie des femmes enceintes, un quart d’entre elles ont besoin d’insuline en complément. L’activité physique permet surtout aux femmes ayant un IMC >30kg/m2 de réduire significativement le risque de DG,14,15 mais elle est également très efficace pour le traitement du DG et entraîne notamment une forte diminution de la GL postprandiale.16 «En ce qui concerne l’alimentation, il faut veiller à réduire le nombre de calories. Les glucides doivent globalement être consommés en faible quantité et plutôt le midi et le soir que le matin. Il est également important d’éviter la malnutrition protéique», a expliqué R. Lehmann.
Si, en plus des mesures liées au mode de vie, un traitement médicamenteux est nécessaire pour atteindre les valeurs cibles de GL, l’insuline est utilisée. La metformine et les sulfonylurées ne sont pas indiquées pour le traitement du DG. Une croissance excessive du fœtus est également une indication pour l’utilisation d’insuline.
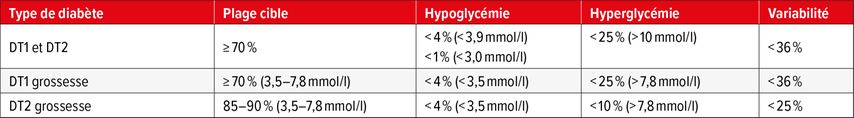
Chez les femmes enceintes atteintes de DT2, une insulinothérapie doit être initiée si les valeurs cibles de GL et le temps passé dans la plage cible (Tab. 1) ne sont pas atteints à >85–90% en une à deux semaines.
Tab. 1: Objectifs de temps passé dans la plage cible pour le diabète de type 1 (DT1) et de type 2 (DT2)
«Toutes les insulines courantes telles que Novo Rapid®, Humalog®, Insulatard HM®, Levemir®, Lantus®, Toujeo® et Tresiba® conviennent pour le traitement pendant la grossesse. Des études portant spécifiquement sur les femmes enceintes ont certes uniquement été réalisées pour Levemir® et Tresiba®, mais l’expérience montre que les autres insulines peuvent également être utilisées sans problème», ajoute-t-il. 40 à 50% des besoins en insuline doivent être couverts par de l’insuline basale et 50 à 60% par de l’insuline en bolus en trois doses prandiales. «Les doses d’insuline nécessaires sont considérables chez les femmes atteintes de DT2 ou de DG. Elles s’élèvent à environ 0,7U/kgPC au premier trimestre, à 0,8U/kgPC au deuxième trimestre et à 0,9U/kgPC au troisième trimestre», a indiqué le spécialiste.
Pendant la période périnatale, l’insuline est arrêtée chez les femmes atteintes de DG et la GL est contrôlée toutes les trois heures. Si la plage cible de 5 à 10mmol/l est dépassée, il faut administrer de l’insuline. Chez les femmes présentant un diabète préexistant, seule l’insuline basale est administrée pendant l’accouchement (ou perfusion insuline-glucose) et la GL est contrôlée toutes les deux à trois heures. La plage cible se situe également entre 5 et 10mmol/l. «Il est important de savoir qu’en cas de DT1, les besoins en insuline diminuent d’un tiers à un quart au cours des 24 à 48 premières heures post-natales», a déclaré R. Lehmann.
Chez les femmes atteintes de DG, un test HGPO doit être réalisé 6 semaines après l’accouchement afin d’effectuer une reclassification. La suite dépend de la présence d’une GL normale, d’un trouble de la GL à jeun, d’une intolérance au glucose, d’un DT1, d’un DT2 ou d’une forme particulière de diabète.
Source:
FOMF Diabetes Update Refresher, du 9 au 12 novembre 2023, Zürich
Littérature:
1 Sweeting A et al.: A clinical update on gestational diabetes mellitus. Endocr Rev 2022; 43: 763-93 2 American Diabetes Association: Standards of medical care in diabetes 2012. Diabetes Care 2012; 35(Suppl 1):S11-63 3 Jovanovic L et al.: Declining insulin requirement in the late first trimester of diabetic pregnancy. Diabetes Care 2001; 7: 1130-6 4 Nielsen LR et al.: Hypoglycemia in pregnant women with type 1 diabetes: predictors and role of metabolic control. Diabetes Care 2008; 31: 9-14 5 Bell R et al.: Peri-conception hyperglycaemia and nephropathy are associated with risk of congenital anomaly in women with pre-existing diabetes: a population-based cohort study. Diabetologia 2012. doi: 10.1007/s00125-012-2455-y 6 Lehmann R et al.: [New insights into diagnosis and management of gestational diabetes mellitus: recommendations of the Swiss Society for Endocrinology and Diabetes.] Ther Umsch 2009; 66: 695-706 7 Boyd EM et al.: International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care 2010; 33: 676-82 8 HAPO Study cooperative Research Group; Boyd EM et al.: Hyperglycemia and adverse pregnancy outcomes. N Engl J Med 2008; 358: 1991-2002 9 Crowther CA et al.: Effect of treatment of gestational diabetes mellitus on pregnancy outcomes. N Engl J Med 2005; 352: 2477-86 10 Landon MB et al.: A multicenter, randomized trial of treatment for mild gestational diabetes. N Engl J Med 2009; 361: 1339-48 11 Spellacy WA et al.: Macrosomia—maternal characteristics and infant complications. Obstet Gynecol 1985; 66: 158-61 12 Green JR et al.: Influence of maternal body habitus and glucose tolerance on birth weight. Obstet Gynecol 1991; 78: 235-9 13 Catalano PM et al.: The hyperglycemia and adverse pregnancy outcome study: associations of GDM and obesity with pregnancy outcomes. Diabetes Care 2012; 35: 780-6 14 Dye TD et al.: Physical activity, obesity, and diabetes in pregnancy. Am J Epidemiol 1997; 146: 961-5 15 Tobias DK et al.: Physical activity before and during pregnancy and risk of gestational diabetes mellitus: a meta-analysis. Diabetes Care 2011; 34: 223-9 16 Jovanovic-Peterson L, Peterson CM: Is exercise safe or useful for gestational diabetic women? Diabetes 1991; 40 (Suppl 2): 179-81
Das könnte Sie auch interessieren:
Biomarqueurs hématologiques des infections – qu’est-ce qui est pertinent etdans quel cas?
Le dosage de différents biomarqueurs joue un rôle important dans le dépistage des infections fongiques invasives. L’évaluation d’un biomarqueur positif en cas d’infections fongiques ...
«Grâce à la Young Oncology Academy, j’ai pu me constituer un réseau»
La Young Oncology Academy (Academy) du Swiss Cancer Institute est un programme de promotion et de mentorat pour les jeunes oncologues. Le programme s’adresse aux médecins-assistants qui ...
«Ce serait bien d’établir un lien»
Le cancer du poumon de Michael Emmenegger-Müller a changé sa vie, mais pas sa motivation à s’engager pour les autres. Il a fondé l’organisation «Leben mit Lungenkrebs» (Vivre avec le ...