Mise à jour sur l’insuffisance cardiaque: HFrEF, HFpEF et HFmrEF – quoi de neuf?
Auteur:
Dr méd. Tobias Höfflinghaus
Leiter Kardiologie
Stadtspital Zürich Waid
Leiter Herzinsuffizienzprogramm
Stadtspital Zürich
Vorstandsmitglied Arbeitsgruppe Herzinsuffizienz der Schweizerischen Gesellschaft für Kardiologie
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Une insuffisance cardiaque peut survenir au cours de la phase finale de toutes les maladies cardiaques. Par conséquent, les causes, les examens et les possibilités de traitement sont très variés. Cet article se concentre spécifiquement sur les nouvelles avancées en matière d’insuffisance cardiaque et leur application clinique au quotidien.
Keypoints
-
La fréquence de l’IC est en hausse et de nombreuses possibilités d’évaluation et de traitement sont disponibles.
-
En cas de suspicion, il convient de procéder à un examen cardiologique précoce afin d’éliminer les causes réversibles et de permettre un traitement ciblé en fonction du sous-type d’IC.
-
Dans l’idéal, les personnes concernées doivent être incluses dans un programme de traitement de l’IC. Les spécialistes peuvent alors contribuer à une prise en charge optimale des patients, en collaboration avec le médecin de premier recours.
La classification de l’insuffisance cardiaque (IC) en fonction de la fraction d’éjection du ventricule gauche s’est avérée pratique, car la plupart des grandes études cliniques n’ont pu démontrer une efficacité que pour l’IC avec fraction d’éjection réduite (HFrEF). Il existe donc de nombreuses options thérapeutiques. Si les mêmes études ont été menées sur l’IC avec fraction d’éjection préservée (HFpEF), aucun traitement n’a montré de bénéfice significatif jusqu’à récemment. Ces dernières années, d’importants progrès ont toutefois été réalisés dans ce domaine. Il existe en outre une zone grise concernant l’IC avec fraction d’éjection modérément réduite (HFmrEF).
Situation épidémiologique
L’IC est globalement en augmentation et entraîne fréquemment une hospitalisation ainsi qu’une mortalité élevée. L’évolution démographique, caractérisée par le vieillissement de la population, favorise cette tendance, tout comme les conséquences tardives de l’hypertension artérielle, des valvulopathies et des maladies coronariennes (MC).1 Environ 10% de la population âgée de plus de 75 ans présente une IC.2 L’IC (aiguë) survient plus rarement en raison d’une myocardite ou à la suite d’un infarctus du myocarde aigu. Le pronostic dépend de la symptomatologie, de l’altération de la fonction cardiaque, des hospitalisations, de la pression artérielle, de la possibilité de recompensation, etc. Les comorbidités fréquentes, telles que l’insuffisance rénale, assombrissent nettement le pronostic. Sans traitement, la mortalité est élevée mais peut être réduite de manière significative par des mesures pharmacologiques, entre autres. Malgré cela, environ 50% des patients meurent dans les cinq ans.
Causes de l’IC
Souvent, les lésions tardives résultant d’un infarctus du myocarde, d’une hypertension artérielle, d’une valvulopathie, etc. entraînent une faiblesse de la fonction cardiaque (due à un remodelage ventriculaire défavorable) ou une perturbation de la fonction diastolique (due à une fibrose croissante du myocarde). Ce peut être également une combinaison des deux. En vertu de la loi des tubes communicants, les pressions pathologiques de la moitié gauche du cœur peuvent avoir des répercussions directes sur le système artériel pulmonaire ainsi que sur le ventricule et l’oreillette droits, entraînant ainsi une insuffisance cardiaque droite. En outre, le système rénine-angiotensine-aldostérone et le système sympathique sont activés, ce qui entraîne une rétention croissante de liquide et de sodium ainsi qu’une vasoconstriction, avec une aggravation supplémentaire de l’IC.
Symptômes de l’IC
Des troubles apparaissent lorsque le cœur ne parvient pas à assurer une perfusion optimale des organes. En cas d’IC antérograde, les symptômes classiques tels qu’une plus grande fatigabilité et une intolérance à l’effort prédominent, tandis qu’en cas d’IC rétrograde, une dyspnée, un œdème des jambes ou même une perte d’appétit peuvent apparaître. Une combinaison des deux est plus fréquente. En cas de multimorbidité ou d’âge avancé, il existe souvent des symptômes non spécifiques tels que fatigue, faiblesse et fragilité.
Étapes de clarification
En cas de symptômes et de troubles typiques, l’étape suivante devrait consister à déterminer le taux de peptides natriurétiques ou à effectuer une échocardiographie.2 Si le NT-proBNP est inférieur au seuil de 125pg/ml, une IC est très probablement exclue. D’une part, l’échocardiographie permet dans de nombreux cas de procéder à une classification étiologique directe (p.ex. valvulopathie de haut grade, indications de MC) et, d’autre part, la fraction d’éjection du ventricule gauche détermine la poursuite du traitement médicamenteux.
Diagnostics différentiels
De nombreuses maladies peuvent avoir pour symptôme principal une dyspnée. En médecine de premier recours, on diagnostique souvent des causes infectieuses aiguës, comme une bronchite, alors qu’en milieu hospitalier, les causes cardiaques sont fréquentes.3
Il n’est pas rare que la dyspnée soit l’expression d’un problème multifactoriel d’origine cardiaque combiné à d’autres comorbidités comme une BPCO et à un déconditionnement supplémentaire.
Une élévation des peptides natriurétiques peut également être observée en cas d’insuffisance rénale, d’âge avancé ou d’embolie pulmonaire, alors que les valeurs peuvent être faussement basses en cas d’obésité (au-delà d’un IMC de 35kg/m2, les taux de BNP devraient être doublés).4
Enfin, la dyspnée peut également être un symptôme d’infarctus aigu du myocarde (personnes âgées, diabétiques) et, en cas de micro-angiopathie» l’équivalent d’une angine de poitrine.
Détermination de la fraction d’éjection du ventricule gauche pour la classification de l’IC
Auparavant, les IC étaient classées selon des critères morphologiques et fonctionnels en IC avec fraction d’éjection préservée (HFpEF; FEVG >50% + critères supplémentaires) et avec fraction d’éjection réduite (HFrEF; FEVG <40%). Cependant, un nombre non négligeable de patients présentent une FEVG modérément réduite (désormais appelé HFmrEF; FEVG 40–50%) et se trouvaient donc dans une zone grise sans recommandations thérapeutiques claires.2
Au cours de l’évolution de l’IC, la FEVG ne reste pas figée, mais connaît d’une part des variations liées à la mesure (en raison de la volémie, de la pression artérielle, de la fréquence cardiaque; de la qualité d’image; de l’examinateur) et d’autre part, la fonction d’éjection peut s’améliorer nettement grâce à la mise en place d’un traitement adéquat.5 Des événements cardiaques supplémentaires tels qu’un infarctus du myocarde ou une nouvelle valvulopathie peuvent aggraver la situation, tout comme une mésobservance du traitement médicamenteux. L’absence d’amélioration ou la poursuite de la détérioration de la FEVG sont corrélées à un mauvais pronostic.5
Caractéristiques des différents sous-types
Sur le plan physiopathologique, une lésion des cardiomyocytes entraîne une inflammation stérile dans le cas d’une HFrEF, tandis que dans le cas d’une HFpEF, il existe une inflammation systémique chronique due à différents facteurs de risque métaboliques, comme par exemple le diabète sucré, l’obésité ou l’hypertension artérielle, qui entraîne une hypertrophie, une fibrose et un trouble de la fonction diastolique (du point de vue physiopathologique, ce sont donc les comorbidités qui entraînent le problème cardiaque).6 Au niveau des protéomes, tous les sous-types d’IC présentent des signatures protéiques différentes pour la transduction du signal, les protéines structurelles, les médiateurs, etc.7 de sorte que cette distinction est biologiquement mesurable et plausible.
Dans le cas d’une HFrEF, la mortalité cardiovasculaire est nettement plus élevée que dans le cas d’une HFmrEF et d’une HFpEF, où les décès sont plus souvent dus à des problèmes non cardiaques.
La maladie cardiovasculaire est plus présente dans les groupes HFrEF et HFmrEF, alors que dans le groupe HFpEF, on retrouve des patient·es plus âgé·es, une fibrillation auriculaire plus fréquente, une hypertension artérielle et de nombreuses comorbidités non cardiaques. Parmi les causes plus rares, on retrouve dans le groupe HFrEF différentes formes de cardiomyopathies d’étiologies infectieuses/inflammatoires, génétiques ou métaboliques, et dans le groupe HFpEF des cardiomyopathies restrictives comme une amylose cardiaque.5
Diagnostic avancé
Le principe de base du diagnostic avancé est d’identifier les causes potentiellement traitables de l’IC.
La MC est fréquente et devrait donc être envisagée à chaque nouveau diagnostic. L’ECG de repos est souvent non spécifique. L’ergométrie est insuffisante pour exclure une MC en raison de sa faible sensibilité et spécificité. S’il existe une angine de poitrine concomitante, une coronarographie invasive doit être réalisée directement, sinon des techniques d’imagerie telles qu’une échocardiographie d’effort, un scanner coronaire, une scintigraphie myocardique ou une IRM cardiaque seront utilisées. La situation clinique détermine à chaque fois l’étape diagnostique suivante. L’IRM cardiaque est idéale pour rechercher une MC (cicatrice, ischémie, viabilité) ou des formes plus rares d’IC, comme une amylose, une sarcoïdose ou une myocardite, et pour évaluer très précisément l’anatomie et la fonction cardiaques.
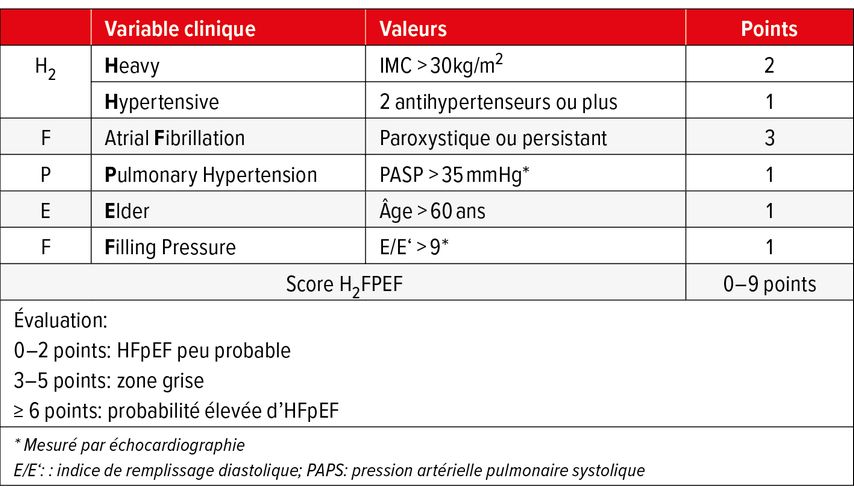
En cas de dyspnée inexpliquée et de résultats équivoques pour une HFpEF, le score H2FPEF (Tab. 1)8 peut renforcer la fiabilité du diagnostic. Outre quelques paramètres cliniques, une échocardiographie est également nécessaire. Par comparaison directe, le score H2FPEF s’est avéré nettement supérieur au score HFA-PEFF9, plus complexe.10
Traitement médicamenteux
HFrEF
Dans le cas de l’HFrEF, le traitement par inhibiteurs de l’ECA ou inhibiteurs des récepteurs de l’angiotensine et de la néprilysine (ARNI), bêtabloquants, antagonistes de l’aldostérone (ARM) et inhibiteurs du SGLT2 est parfaitement prouvé et établi. En outre, des diurétiques sont prescrits selon les besoins.2
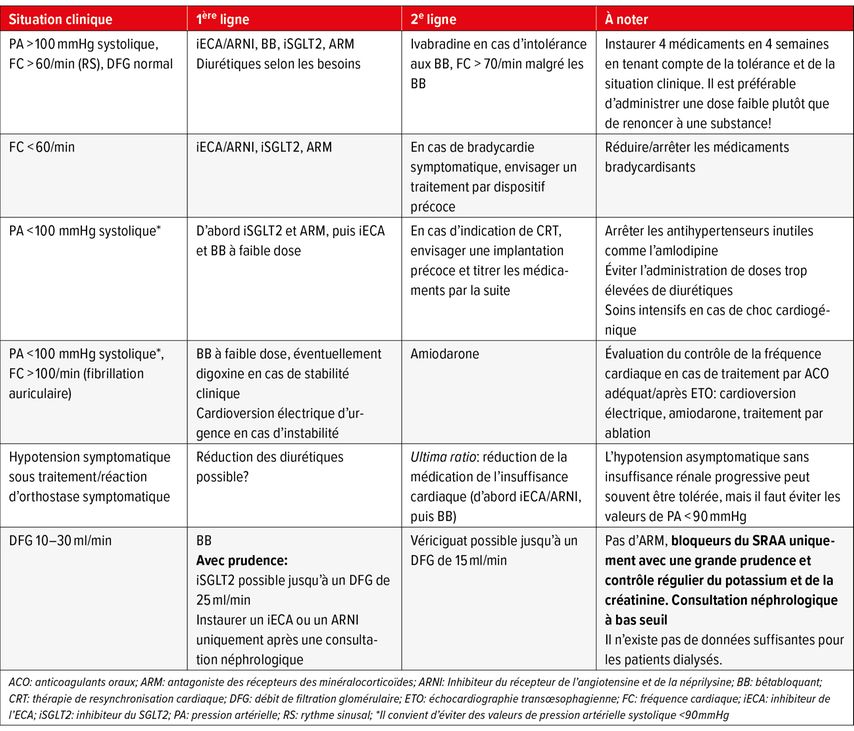
Auparavant, on préconisait une mise en place séquentielle du traitement, qui prenait beaucoup de temps. Désormais, les médicaments doivent être combinés plus tôt et titrés plus rapidement (les 4 médicaments doivent être instaurés en l’espace de 4 semaines). Il convient de noter que ceci ne peut pas être appliqué à tous les patients et qu’une évaluation individuelle est toujours de mise. Avant le début du traitement, les principaux paramètres à prendre en compte sont la pression artérielle (en position couchée et debout) et le pouls, la fonction rénale, le NT-proBNP et l’ECG (rythme sinusal ou fibrillation auriculaire)11 (Tab. 2).
Tab. 2: Outil d’aide à la décision dans différents scénarios cliniques (adapté entre autres de Mc Donagh et al., 2021; Rosano et al., 2021)2,11
Afin d’éviter une nouvelle hospitalisation pour IC, un traitement par vériciguat peut être envisagé chez les patients traités de manière optimale et dont le taux de BNP est stabilisé à un niveau bas (tenir compte de la limitatio de l’Office fédéral de la santé publique OFSP).12
HFpEF
Pour l’HFpEF, de nombreuses études médicamenteuses ont été décevantes jusqu’à récemment: les iECA, les ARNI, les sartans, les bêtabloquants ou les ARM n’ont pas apporté de bénéfices convaincants.2 Récemment, des améliorations significatives des critères d’évaluation combinés de la mortalité et du taux de réhospitalisation ont pu être démontrées pour la classe des iSGLT2: l’étude EMPEROR-Preserved13 a montré une réduction relative du risque de 21% avec l’empagliflozine (réduction absolue du risque: 3,3%; p<0,001) et l’étude DELIVER14 a montré une réduction relative du risque de 18% avec la dapagliflozine (réduction absolue du risque: 3,1%; p<0,001), dans les deux cas par rapport au placebo. Alors que dans le cas de l’HFrEF, les iSGLT2 ont également réduit de manière significative la mortalité (critère d’évaluation secondaire) dans les études, ce n’est pas le cas pour l’HFpEF où la réduction du taux d’hospitalisation est significative, mais pas la réduction de la mortalité.
HFmrEF
Les études portant sur l’HFmrEF sont plus difficiles à évaluer étant donné que de grandes études randomisées font actuellement (encore) défaut. Les recommandations concernant un traitement par iECA, sartans, ARNI, bêtabloquants et ARM sont principalement basées sur des sous-analyses de grandes études et n’ont que des recommandations de classe IIb, niveau de preuve C (= faible niveau de preuve issu des études, reposant principalement sur les avis d’experts).2
Dans une analyse groupée du sacubitril-valsartan dans les études PARADIGM (HFrEF) et PARAGON (HFpEF), une réponse thérapeutique significative a également été observée dans la population de l’étude HFmrEF.15 Il convient ici de tenir compte de la limitatio de l’OFSP pour l’ARNI.
De petites études (de registres) montrent une bonne réponse thérapeutique aux iECA et aux bêtabloquants16 (à la dose la plus élevée possible) ainsi qu’aux ARM.17
Les iSGLT2 peuvent être prescrits indépendamment de la fraction d’éjection du ventricule gauche: dans une analyse groupée de Jhund et al. portant sur les patients inclus dans les études DELIVER (HFpEF) et DAPA-HF (HFpEF et HFmrEF) un effet cohérent de la dapagliflozine a été démontré sur l’ensemble du spectre de la FEVG en termes de réduction des taux de mortalité et d’hospitalisation pour IC.18
Stratégies diurétiques en cas de décompensation
Les diurétiques de l’anse sont un pilier important du traitement en cas de décompensation et de signes de congestion (recommandation ESC de classe IA). La dose initiale doit être suffisamment élevée (une à deux fois la dose quotidienne de diurétiques de l’anse comme dose initiale de furosémide par voie IV19) et la mise en place d’un traitement complémentaire par un diurétique thiazidique comme la métolazone,20 un iGLT221 ou l’acétazolamide22 doit être envisagée à un stade précoce. Il ne semble pas y avoir de différence significative entre le torasémide et le furosémide en termes de recompensation.23
En milieu hospitalier, outre l’effet diurétique, l’excrétion urinaire de sodium devrait être initialement surveillée et les diurétiques devraient être contrôlés en conséquence afin de remédier à l’excès de sel qui l’accompagne.19
Suite à une décompensation, il est nécessaire de trouver la dose de diurétique la mieux tolérée et la plus efficace. Il n’est pas rare que les personnes concernées présentent un excès de diurétiques après une hospitalisation. Cela peut se traduire par une faiblesse générale, une hypotension (orthostatique), une sensation de soif intense ou une insuffisance rénale aggravée. Souvent, lorsque le traitement de l’IC est bien établi, que la situation clinique est stable et que le patient est correctement informé, il est possible de ne pas avoir recours aux diurétiques et de les utiliser uniquement lorsque la situation l’exige.
Traitement non médicamenteux
Il existe des procédures de chirurgie cardiaque et, de plus en plus, des techniques interventionnelles pour corriger les valvulopathies de la valve aortique, de la valve mitrale et, depuis peu, de la valve tricuspide. En cas d’HFrEF, un défibrillateur automatique implantable (DAI) ou une thérapie de resynchronisation cardiaque doivent être envisagés. C’est également le cas pour un traitement par ablation en cas de fibrillation auriculaire.2
Le pontage aortocoronarien est préférable à un traitement pharmacologique optimisé en cas de maladie coronarienne sévère et d’HFrEF.24 Ce bénéfice n’est pas démontré pour les mesures de revascularisation interventionnelle, même si la viabilité est avérée.25
Dans l’idéal, les personnes concernées doivent être incluses dans un programme interdisciplinaire de prise en charge de l’IC2 (recommandation de l’ESC de classe IA). Outre l’éducation des patient·es, il est possible d’optimiser le traitement de l’IC et de réagir rapidement en cas d’aggravation clinique.
C’est dans les 30 premiers jours suivant une hospitalisation que la mortalité est la plus élevée, surtout si les patient·es ont été hospitalisés longtemps ou ont connu une évolution compliquée. C’est pourquoi un contrôle en consultation d’insuffisance cardiaque devrait être effectué dans les 7 à 10 jours suivant la sortie.
Dans l’étude STRONG-HF26, un traitement de haute intensité (indépendamment de la fonction ventriculaire gauche) avec une titration rapide des médicaments dans les 14 jours suivant l’hospitalisation et des contrôles fréquents en consultation d’insuffisance cardiaque pendant 180 jours présentait un avantage significatif par rapport au traitement standard en termes de réhospitalisation et de décès (15,2% vs 23,3%; p=0,0021). Le nombre d’effets secondaires indésirables, tels que l’hypotension, était certes plus élevé dans le groupe à haute intensité, mais les effets secondaires graves étaient aussi fréquents que dans le groupe standard.
Une restriction stricte du sodium ne réduit pas le taux d’événements tels que les hospitalisations et les consultations aux urgences, ni la mortalité globale,27 mais il convient d’éviter les excès de sel et de liquide.2
Perspectives futures et questions en suspens
À l’été 2023, les directives européennes sur l’insuffisance cardiaque seront mises à jour et préciseront notamment la place du traitement diurétique et les recommandations concernant les iSGLT2.
Littérature:
1 OFS: Statistique des causes de décès 2019. https://www.bfs.admin.ch/bfs/fr/home.html 2 Mc Donagh T et al.: Eur Heart J 2021, 42: 3599-726 3 Berliner D et al.: Dtsch Ärztebl Int 2016; 113: 834-45 4 Maisel A et al.: Eur J Heart Fail 2008, 10; 824-39 5 Savarese G et al.: Nature Rev Cardiol 2022; 19: 100-16 6 Simmonds S et al.: Cells 2020; 9:242 7 Adamo L et al.: JACC 2020; 76: 1982-94 8 Reddy Y et al.: Circulation 2018; 138: 861-70 9 Pieske B et al.: Eur Heart J 2019; 40: 3297-317 10 Reddy Y et al.: JAMA Cardiol 2022; 7: 891-9 11 Rosano G et al.: Eur J Heart Fail 2021; 23: 872-81 12 Armstrong P et al.: N Engl J Med 2020; 382: 1883-93 13 Anker S et al.: N Engl J Med 2021; 385: 1451-61 14 Solomon S et al.: N Engl J Med 2022; 387: 1089-98 15 Solomon S et al.: N Engl J Med 2019; 381,1609-20 16 Straw S et al.: Clin Res Cardiol 2023; 112: 111-22 17Enzan N et al.: ESC Heart Failure 2020; 7: 336-44 18Jhund P et al.: Nature Med 2022; 28: 1956-64 19Mullens W et al.: Eur J Heart Fail 2019; 21: 137-55 20Trulls JC et al.: Eur Heart J 2023; 44: 411-21 21 Voors A et al.: Nat Med 2022; 28: 568-74 22 Mullens W et al.: N Engl J Med 2022; 387: 1185-95 23 Mentz R et al.: JAMA 2023; 329: 214-23 24 Velazquez E et al.: N Engl J Med 2016; 374: 1511-20 25 Perera D et al.: N Engl J Med 2022; 387: 1351-60 26 Mebazaa A et al.: Lancet 2022; 400: 1938-52 27 Ezekowitz J et al.: Lancet 2022; 399: 1391-400
Das könnte Sie auch interessieren:
Séquelles cardiopulmonaires à long terme après une infection sévère par le SARS-CoV-2
Le SARS-CoV-2 a entraîné une crise sanitaire mondiale et a posé des défis considérables aux systèmes de santé.1 Si le Covid-19 était initialement considérée comme une maladie ...
Posters et communications sélectionnés
Lors du congrès annuel de la Société Suisse d’Endocrinologie et de Diabétologie, les endocrinologues et diabétologues suisses ont fourni une vue d’ensemble de leurs nombreuses recherches ...
Analogues de l’incrétine par rapport à la chirurgie bariatrique
La question du meilleur traitement pour la perte de poids a fait l’objet d’un débat pour et contre dans le cadre du congrès 2024 de l’EASD. Alors que la facilité d’accès et la bonne ...